蓝莓叶多酚提取物对3种细菌的抑菌活性*
王亚丽,李颖畅,马春颖,李作伟,齐凤元,刘珊
(渤海大学化学化工与食品安全学院,食品科学研究院,辽宁省食品安全重点实验室,辽宁锦州,121013)
蓝莓叶多酚是蓝莓叶中的次生代谢产物,包括花色苷类、黄酮类、黄酮醇类、木质素类和酚酸等[1]。Matsuo等[2]从兔眼蓝莓叶中鉴定出咖啡酰奎尼酸、黄酮苷、黄烷-3-醇、原花青素。Deng等[3]对蓝莓叶多酚进行分析,鉴定出五倍子酸、香草酸、阿魏酸、原儿茶素酸、绿原酸等。蓝莓叶多酚是蓝莓中重要的生物活性成分,具有多种生物活性,富含黄豆粉的蓝莓叶多酚可以降低血糖、控制体重增加及降低小鼠血清中的胆固醇含量[4]。兔眼蓝莓叶中低聚花青素可以抑制人类T细胞的病毒通过T细胞的凋亡和细胞周期停滞进行扩散[5]。关于多酚类物质对腐败菌和致病菌的抑菌效果及抑菌机制方面有一些报道,如王向阳等[6]认为茶多酚对枯草芽孢杆菌、蜡样芽孢杆菌和克柔念球菌的蛋白质合成有抑制作用并且破坏其细胞壁。Nakayama等[7]认为,绿茶提取物可抑制金黄色葡萄球菌、大肠杆菌吸收基质和分泌物质,并且抑制酶的活性。蓝莓叶多酚作为一种天然植物提取物,很早以前就用在蛋糕、米饭等防腐保鲜上[8],其抑菌活性和抑菌机理目前尚不完全明确。
本文以常见的致病菌革兰氏阳性金黄色葡萄球菌、革兰氏阴性大肠埃希式杆菌和水产品中典型的革兰氏阴性铜绿假单胞菌为试验菌,探讨蓝莓叶多酚pH值对其抑菌性的影响,同时通过测定蓝莓叶多酚处理后细菌的生长曲线、紫外吸收物质、电导率值的变化以及细胞形态变化,明确蓝莓叶多酚的抑菌作用,以期为蓝莓叶多酚应用于水产品等食品保鲜提供理论依据。
1 材料和方法
1.1 材料与主要仪器
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(E.coli)、铜绿假单胞菌(Pseudomonas aeruginosa);蓝莓叶多酚(纯度>80%),渤海大学化学化工与食品安全重点实验室提供;LB肉汤培养基、LB营养琼脂培养基,青岛高科园海博生物技术有限公司;氯化钠(分析纯),天津市化学试剂批发公司;磷酸(分析纯),天津市天力化学试剂有限公司。
THZ-D台式恒温振荡器,太仓市实验设备厂;LRH系列生化培养箱,上海一恒科技有限公司;SWCJ-2FD型洁净工作台,苏净集团苏州安泰空气技术有限公司;UV-2550型紫外-可见光分光光度计,尤尼柯(上海)仪器有限公司;FE20型pH计,METTLER TOLEDO公司;高速冷冻离心机,Thermo公司;LDZX-40SC型立式可控电热压力蒸汽灭菌器,上海申安医疗器械厂;DHG-9123A电热恒温鼓风干燥箱,上海申贤恒温设备厂;S-4800型场发射扫描电镜,日本日立。
1.2 实验方法
1.2.1 菌悬液的制备
取1环斜面保存的金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌,分别接种于5 mL LB肉汤培养基中过夜活化2次(30℃,160 r/min),根据实验需要用无菌生理盐水稀释至适当浓度。
1.2.2 蓝莓叶多酚的最低抑菌浓度
参考付慧等[9]方法,用二倍稀释法将蓝莓叶多酚配成2%、1%、0.5%、0.25%、0.125%、0.062 5%的溶液,在无菌平皿中分别加入1 mL不同浓度稀释液,然后倒入约15 mL培养基,充分混匀,平放凝固后取0.5 mL供试菌悬液于平板上涂布均匀,置于30℃下培养24 h,观察,确定蓝莓叶多酚的最低抑菌浓度,并以此浓度进行后续实验。
1.2.3 pH值对蓝莓叶多酚抑菌活性的影响
将0.125%的蓝莓叶多酚用0.1mol/L NaOH和HCl调成 8 个 pH 值梯度:4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,应用牛津杯法观察 pH值对蓝莓叶多酚抑菌活性的影响。
1.2.4 细菌生长曲线的测定
取少量金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌培养至对数期,加入蓝莓叶多酚,使其终浓度为最低抑菌浓度,于30℃,160 r/min摇床振荡培养。每隔2 h分别取样,在595 nm处测定其吸光值。以时间为横坐标,OD595nm值为纵坐标,绘制生长曲线,另以不添加蓝莓叶多酚的为对照组。
1.2.5 紫外吸收值的测定
取少量金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌培养至对数期,离心(4 000 r/min,10 min),用0.1 mol/L磷酸缓冲液(pH=7.4)洗涤3次,用等量的最低抑菌浓度的蓝莓叶多酚磷酸盐溶液悬浮,于30℃,160 r/min摇床振荡培养,每隔2 h取样,离心(4 000 r/min,10 min)除去菌体,测上清液的OD260nm值。
1.2.6 菌液电导率值的测定
根据张新虎等[10]的方法,将生长到对数期的金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌用0.1 mol/L磷酸缓冲液(pH=7.4)洗涤3次,取5 mL菌液与0.125%蓝莓叶多酚溶液等体积混合,每隔10 min测1次电导率;以无菌水替代蓝莓叶多酚作为对照组。
1.2.7 扫描电镜观察
参照Yi等[11]的方法进行操作。
2 结果与分析
2.1 蓝莓叶多酚的最低抑菌浓度(MIC)

表1 最低抑菌浓度的确定Table 1 The determination of minimum inhibitory concentration
由表1可知,蓝莓叶多酚对3种菌均有抑制作用,对大肠杆菌最低抑菌浓度为0.125%,对金黄色葡萄球菌、铜绿假单胞菌的最低抑菌浓度为0.062 5%,由此确定采用0.125%的浓度进行后续实验。此结果还说明蓝莓叶多酚提取物既可以抑制革兰氏阳性菌,也可以抑制革兰氏阴性菌,这和Deng等[3]的研究结果一致。
2.2 pH值对蓝莓叶多酚抑菌活性的影响
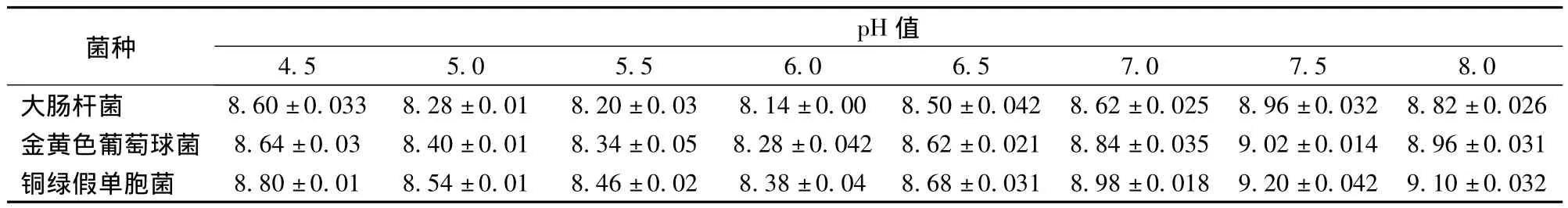
表2 蓝莓叶多酚pH值对供式菌抑菌圈直径的影响 单位:mmTable 2 Effect of pH value of blueberry leaf polyphenol on inhibition zone
由表2可知,在pH值为4.5~5.5的范围内,抑菌活性随着pH值增大略有降低,分析可能是由于酸性条件下,非极性酚类化合物质的酚羟基电离度减小,疏水性增强,更容易溶于细胞膜的脂类和蛋白质的疏水区域,从而破坏微生物细胞膜的完整性[9]。在pH值为7.0~8.0范围内,其抑菌活性较强;当pH7.5时,抑菌活性最强,这可能是由于多酚中的单体物质在不同的pH值下,其含量和功能活性不同[12]。
2.3 细菌生长曲线
由图1可以看出,各对照组大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌正常生长,培养一段时间后达到对数期,细菌数量迅速增加;与对照组相比,加入蓝莓叶多酚处理组的细菌生长速度相对缓慢,菌含量始终处于低水平。结果说明,蓝莓叶多酚可以抑制试验菌的生长,且对3种试验菌的生长均有抑制作用。此结果和 C^oté等[13]、Caillet等[14]研究蔓越橘水溶性多酚对菌体生长规律的影响一致。
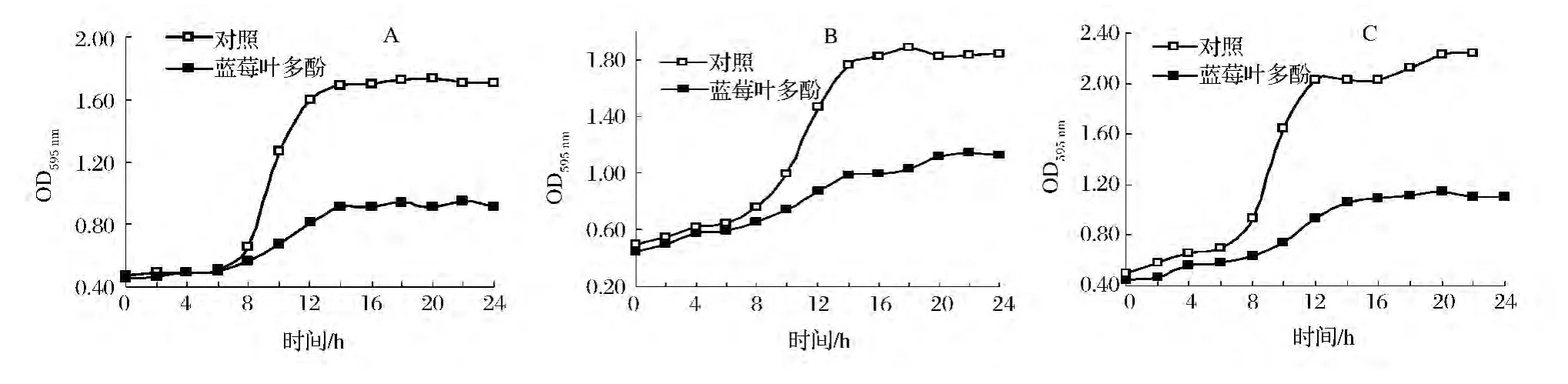
图1 蓝莓叶多酚对试验菌生长曲线的影响Fig.1 Effect of blueberry leaf polyphenol on growth curve of test organisms
2.4 蓝莓叶多酚对菌液紫外吸收值的影响
细胞膜是细菌的天然保护屏障,如果遭到破环,K+,PO3-等离子首先泄露出来,随后是大分子物质如DNA、RNA等,通过测定在260 nm处吸光值的变化可以间接了解细胞膜的完整性[15]。图2中A、B、C分别显示了蓝莓叶多酚对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌膜完整性的影响。由图2可知,蓝莓叶多酚处理组在260 nm波长处的吸光值均显著(P<0.05)大于对照组,并随着作用时间的延长,吸光值显著上升,而对照组吸光值基本不变。说明蓝莓叶多酚可以破坏大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌细胞膜的完整性而显示其抑菌活性。Serajus Salaheen等[16]研究也表明蓝莓果中的多酚能够破坏空肠弯曲杆菌细胞膜。

图2 蓝莓叶多酚对菌液紫外吸收值的影响Fig.2 Effect of blueberry leaf polyphenol on ultraviolet absorption value
2.5 蓝莓叶多酚对菌液电导率值的影响
微生物的质膜为菌体提供最基本的屏障,由带有嵌入型蛋白质的磷脂双分子层构成,抵抗外界的破坏。当细菌遇到强抑菌剂时,其细胞膜遭到破坏,菌体的保护屏障被打破,细胞内电解质泄露到培养液中,从而使培养液的电导率值升高。因此,菌液电导率值的变化反映了细菌细胞膜通透性的变化[17-18]。从图3可以看出,与对照组相比,0.125%蓝莓叶多酚组的电导率值始终处于较高水平,且随着作用时间的延长,电导率值逐渐升高,而对照组电导率值基本上不变,两者之间差异显著(P<0.05)。这可能是由于多酚固有的解偶联活性,使得膜两侧的电化学质子梯度减小,干扰了细胞ATP的合成,并对细胞的主动运输产生影响,从而使得细胞膜的通透性变大[19]。说明蓝莓叶多酚能增强大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌细胞膜的通透性,从而表现出抑菌性。
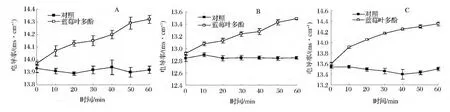
图3 蓝莓叶多酚对菌液电导率值的影响Fig.3 Effect of blueberry leaf polyphenols on conductivity value
2.6 扫描电镜观察

图4 试验菌细胞形态Fig.4 Morphology of test bacteria cell
正常的典型革兰氏阴性大肠杆菌、铜绿假单胞菌和革兰氏阳性金黄色葡萄球菌如图4中 A1、B1、C1,具有规则的细胞形态和完整的细胞膜。经蓝莓叶多酚处理过的大肠杆菌、铜绿假单胞菌和金黄色葡萄球菌如图4中A2、B2、C2。可以看出,细胞形态发生了明显变化,细胞表面有明显的断层,细胞壁出现凹陷。分析原因可能是由于多酚类物质的局部疏水性和螯合金属离子的能力,能够结合到细胞外膜和在细胞外膜上发生化学反应,从而导致细胞膜流动性消失和细胞的不规则性[20]。电镜结果与电导率值、紫外吸收物质的变化,证实了蓝莓叶多酚具有破坏菌体细胞膜的作用。
3 结论
(1)蓝莓叶多酚有较强的抑菌效果,显示出一定的抗菌广谱性。
(2)蓝莓叶多酚对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌的最低抑菌浓度分别为0.062 5%、0.125%、0.062 5%。
(3)蓝莓叶多酚在pH值7.0~8.0范围内抑菌活性较强。
(4)3种试验菌培养液的电导率值、紫外吸收物质值的变化和细胞的扫描电镜观察结果说明蓝莓叶多酚能增大细胞通透性,破坏细胞结构的完整性从而达到抑菌作用。
[1]张清安,范学辉.多酚类物质抗氧化活性评价方法研究进展[J].食品与发酵工业,2011,37(11):169-172.
[2]Matsuo Y,Fujita Y,Ohnishi S,et al.Chemical constituents of the leaves of rabbiteye blueberry(Vaccinium ashei)and characterisation of polymeric proanthocyanidins containing phenylpropanoid units and A-type linkages[J].Food Chemistry,2010,121(4):1 073 -1 079.
[3]YUN Deng,YANG Gui-yun,YUE Jin,et al.Influences of ripening stages and extracting solvents on the polyphenolic compounds,antimicrobial and antioxidant activities of blueberry leaf extracts[J].Food Control,2014,38:184 - 191.
[4]Roopchand D E,Kuhn P,Rojo L E,et al.Blueberry polyphenol-enriched soybean flour reduces hyperglycemia,body weight gain and serum cholesterol in mice[J].Pharmacol Res,2013,68(1):59 -67.
[5]Nagahama K,Eto N,Sakakibara Y,et al.Oligomeric proanthocyanidins from rabbiteye blueberry leaves inhibits the proliferation of human T-cell lymphotropic virus type 1-associated cell lines via apoptosis and cell cycle arrest[J].Journal of Functional Foods,2014(6):356 -366.
[6]王向阳,周政子,刘绘景.茶多酚对萝卜干3种致病菌的抑菌机理研究[J].中国食品学报,2013,13(8):96-101.
[7]Nakayama M,Shigemune N,Tsugukuni T,et al.Mechanism of the combined anti-bacterial effect of green tea extract and NaCl against Staphylococcus aureus and Escherichia coli O157:H7[J].Food Control,2012,25(1):225 - 232.
[8]魏国华,许新德,邵斌,等.天然食品防腐剂-乌饭树叶提取物[J].中国食品添加剂,2008(6):143-145.
[9]付慧,杨萍,汪秋宽.茶多酚的制备及其抑菌活性的研究[J].食品科技,2012,37(6):273 -276.
[10]张新虎,何静,沈慧敏.苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探[J].草业学报,2008,17(3):99-104.
[11]YI S M,WANG W,BAI F L,et al.Antimicrobial effect and membrane-active mechanism of tea polyphenols against Serratia marcescens[J].Word J Microbiol Biotechnol,2014,30(2):451 -460.
[12]Friedman M,Jürgens H S.Effect of pH on the stability of plant phenolic compounds[J].Food Chem,2000,48(6):2 101-2 110.
[13]C^oté J,Caillet S,Doyon G,et al.Antimicrobial effect of cranberry juice and extracts[J].Food Control,2011,22(8):1 413-1 418.
[14]Caillet S,Caillet J,Sylvain J F,et al.Antimicrobial effects of fractions from cranberry products on the growth of seven pathogenic bacteria[J].Food Control,2012,23(2):419-428.
[15]孙延忠,曾洪梅,石萍,等.武夷菌素对番茄灰霉菌的作用方式[J].植物病理学报,2003,33(5):434-438.
[16]Salaheen S,Nguyen C,Hewes D,et al.Cheap extraction of antibacterial compounds of berry pomace and their mode of action against the pathogen Campylobacter jejuni[J].Food Control,2014,46:174 -181.
[17]钱红丽,陶妍,谢晶.茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J].微生物学通报,2010,37(11):1 628-1 633.
[18]MT马迪根,JM马丁克.微生物生物学[M].第11版.李明春,等译.北京:科学出版社,2009:95-113.
[19]Escher B I,Hunziker R,Schwarzenbach R P.Kinetic model to describe the intrinsic uncoupling activity of substituted phenols in energy transducing membranes[J].Environmental Science and Technology,1999,33(4):560 -570.
[20]Lacombe A,Wu V C H,Tyler S,et al.Antimicrobial action of the American cranberry constituents;phenolics,anthocyanins,and organic acids,against Escherichia coli O157:H7[J].International journal of food microbiology,2010,139(1):102 -107.

