稳定剂对电解锰废渣中高浓度可溶性锰稳定效果的影响
杜 兵,但智钢,肖 轲,王 军,段 宁(.中国科学院生态环境研究中心,北京 00084;.中国环境科学研究院,重金属清洁生产工程技术中心,北京 000;3.北京师范大学水科学研究院,北京 00875)
稳定剂对电解锰废渣中高浓度可溶性锰稳定效果的影响
杜 兵1,2,但智钢2*,肖 轲2,3,王 军1,段 宁2(1.中国科学院生态环境研究中心,北京 100084;2.中国环境科学研究院,重金属清洁生产工程技术中心,北京 100012;3.北京师范大学水科学研究院,北京 100875)
为满足大宗废渣经济性处理的需要,从碱性物质、磷酸盐、碳酸盐类药剂筛选出“物美价廉”稳定剂,考察了CaO、MgO和Ca10(PO4)6(OH)2及其与NaHCO3和Na3PO4的组合对电解锰废渣中的可溶性锰的稳定化效果,并采用矿物组成分析、锰价态分析和形态变化探讨可溶性锰固定机理.结果表明:投加10%MgO锰渣中可溶性锰固定率达到100%,9%CaO+5%NaHCO3和9%CaO+5%Na3PO4的组合实现可溶性锰固定率95%以上.上述3组稳定剂将可溶性Mn2+先转变为沉淀态锰进一步转变为高价态含锰物相.后两组中NaHCO3或Na3PO4的加入促进了Mn2+向Mn3+、Mn4+的转化.
电解锰废渣;稳定化;氧化钙;氧化镁;浸出;形态分析
金属锰作为一种重要的工业原料,对钢铁产业尤为重要,有“无锰不成钢”之说.95%金属锰是通过电解法制备.我国电解锰行业自2000年起得到了快速的发展,已成为世界上最大的电解锰生产国、消费国和出口国,到2012年,产量已超过2.11Mt/a[1].
电解锰废渣(锰渣)是在碳酸锰矿粉中加入硫酸溶液后,经压滤产生的酸性浸出渣[2],是电解锰行业主要工业固体废弃物,每生产1t金属锰平均产渣量为9~11t(矿石品位10%~14%),由此每年新增锰渣约为2000万t,历年累积已超过8000 万t,存量巨大.
目前,锰渣大多是堆放处置,许多堆放场防渗防漏建设不规范[3],极易导致锰渣中污染物通过渗滤液污染土壤、周围水体,对堆放场周围环境和人带来环境污染和健康隐患.经检测,锰渣库周边河水中Mn含量超地下水质III类标准.对电解锰生产操作工的头发、指甲和尿液样本进行检测,发现他们头发、指甲和尿液中锰超标率分别为70%、76%和100%[4].锰渣中可溶性锰极可能是造成污染的主要源头,因此亟须对电解锰废渣进行处理.
常用的处理方法有生物处理、焚烧处理、化学处理技术等.由于锰渣几乎不含生物质和易燃成分,不宜采用生物和焚烧处理.化学处理技术包括药剂稳定化和固化技术.目前国内外选用的固化基材大多数是水泥,使用水泥固化会产生不同程度的体积增容[5],水泥使用量越高,增容量越大.针对水泥固化问题,目前国外已经开始研究新的稳定化技术——药剂稳定化.药剂直接作用目标污染物,将其转化为低溶解性、低迁移性的形态,可大幅度降低释放量[6].药剂稳定化技术可以在降低污染物释放量的同时,达到处理物料少增容或不增容,有利于废物物料资源化利用,提高废物物料的总体效率和经济性.
稳定剂有很多种类,如碱性物质、磷酸盐、硫化物、碳酸盐、螯合物等.已有锰渣稳定剂的报道,主要使用碱性物质,如生石灰[7-8]、氢氧化钠[9],实验表明,生石灰、氢氧化钠有较好的稳定效果,但是处理后物料pH值较高(pH>12),从而导致物料腐蚀性超标[10].如何筛选出更合适的稳定剂,在保持锰高效固定的同时,又能使得处理后锰渣满足一般工业固体废物贮存、处置场污染控制标准规定的固废浸出液pH值在6~9范围内[11].
针对上述问题,本试验扩大稳定剂种类,从碱性物质、磷酸盐、碳酸盐中筛选稳定剂进行可溶性锰固定试验,从而确定“物美价廉”的稳定剂或稳定剂组合.通过毒性浸出方法(HJ/299-2007[12]和HJ/T 557-2010[13])和锰的价态分析、形态分析来评价稳定化效果,结合处理后物料的矿物组成分析揭示可溶性锰固定机理.
1 材料与方法
1.1 锰渣
实验用锰渣取自宁夏某锰业公司的新鲜锰渣,按照《工业固体废弃物采样制样技术规范》(HJ/T 20-1998)所述方法取样,并密封保存.样品经105℃烘干、研磨,取100目(0.15mm)筛下物进行化学成分分析(以氧化物计),测试结果表明,锰渣主要成分为SiO2(27.93%)、SO3(37.31%)、CaO(15.39%)、Al2O3(5.78%)、Fe2O3(5.29%)和MnO(5.08%).
依据《固体废物浸出毒性浸出方法 硫酸硝酸法》(HJ/T 299-2007)[12]测定浸出液中污染物浓度,结果见表1.可以看出,锰渣浸出液中锰离子浓度达到1820mg/L,其他重金属浓度均未超过浸出毒性浸出标准(GB 5085.3-2007)[14]限值.

表1 锰渣浸出毒性检测结果Table 1 Test of leaching toxicity of EMSW
根据《矿物岩石分析》DZG20.01-1991[15],对锰渣中总锰、碳酸锰、可溶性锰和二氧化锰测定,它们质量分数分别为2.16%、2.10%、1.53% 和0.029%.
1.2 稳定剂
选用碱性物质、磷酸盐和碳酸盐3种不同稳定剂,分别进行单一稳定剂和组合稳定剂对锰渣中可溶性锰进行固定,稳定剂见表2.
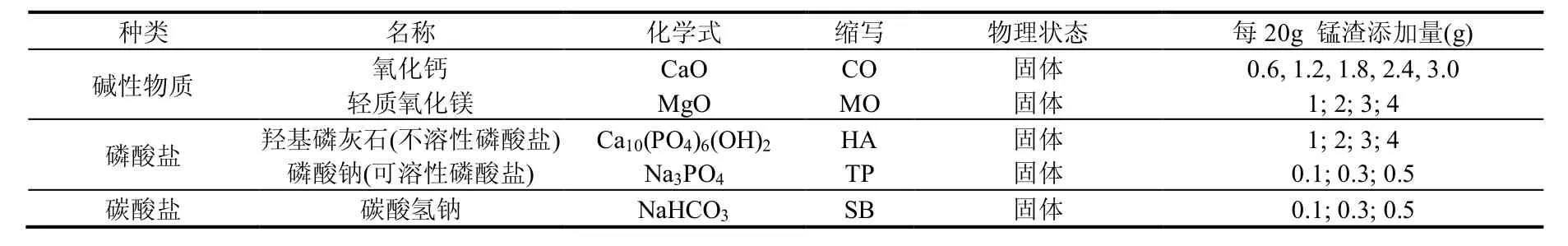
表2 锰渣可溶性锰稳定剂种类及添加量Table 2 Stabilizers and additions tested for stabilization of the EMSW
1.3 试验原料制备
锰渣中可溶性锰主要是硫酸锰,其在渣中所占质量分数较低(<2%),若直接进行稳定化处理,处理后锰的形态及矿物组成检测不准确,造成分析困难.为获得高质量和准确的表征结果,向锰渣原料投加了分析纯的硫酸锰以提高可溶性锰的含量.使用搅拌机(IKA RW20)充分混匀成泥浆,然后在60℃下烘干、粉磨,并过100目(0.15mm)筛,取筛下物备用.经测定,重新制备的原料中锰的质量分数为5.75%,其浸出液锰浓度为3650mg/L.
1.4 锰的固定试验
称取20g锰渣干样品,将稳定剂分别按照一定比例与锰渣样品充分混合,按照液固比(L/S)为1:2加入去离子水搅拌混合,在养护箱内放置2周(养护箱湿度为90%,温度35℃),养护后在60℃下烘干,研磨备用,每组试验设置3个平行试验,未处理样品作为空白对照.
1.5 浸出方法
处理后样品浸出方法采用《固体废物浸出毒性浸出方法 硫酸硝酸法》(HJ/T 299-2007)[12]和《固体废物浸出毒性浸出方法 水平振荡法》(HJ/T 557-2010)[13].因高液固比会促进金属离子浸出[16],本试验中液固比为20:1.为了更好比较各种稳定剂的固锰效果,采用如下公式计算固定效率:

式中:C0S是稳定剂处理前浸出液中锰的质量浓度,mg/kg;CL为稳定剂处理后浸出液中锰的浓度,mg/L;L/S为液固比,L/mg.
1.6 浸出液锰及pH值的测定
采用原子吸收光谱仪(Jena novAA 350)和紫外可见分光光度计(SHIMADZU UV-1240)测定浸出液中锰离子浓度,测试精度分别为0.005mg/L和0.01mg/L.浸出液pH值使用Orion pH电极9107BNMD进行测定.
1.7 锰价态分析
(1)Mn2+测定:称取一定量预先处理好的锰渣放置于烧杯中,加少量水润湿,再加入20mL(NH4)2SO4(3mol/L)及1mL H2SO4(5mol/L),在70℃左右下加热约30min,过滤至100mL容量瓶中,根据浓度与吸光度的标准曲线,得出Mn2+浓度.
(2)Mn3+和Mn4+测定:称取一定量预先处理好的锰渣于烧杯中,加入过量的已知量草酸钠(约0.4g),再加入10mL H2SO4(5mol/L),80℃左右下加热约30min,过滤至锥形瓶中,加热滤液至70~80℃,然后用高锰酸钾趁热滴定,至溶液变为粉红色且半分钟不褪色即为终点,平行测定两次.反应方程式见式(2)、式(3):

(3)总锰的测定:称取一定量预先处理好的锰渣于烧杯中,加入过量的草酸钠(约0.32g),再加入10mL H2SO4(5mol/L),在70 ℃左右加热约30min,过滤至100mL容量瓶中,分别稀释不同倍数后,使用与(1)相同的方法,测出总锰的浓度(mg/L).
(4)根据(1)(2)(3)操作即分别可得3个关系方程式,建立三元一次方程组,求解得到Mn2+、Mn3+和Mn4+的含量.
1.8 处理前后锰的形态分析

表3 连续浸出步骤Table 3 Sequential extractions
通过连续浸出可以掌握锰渣中锰的原始形态、可利用的物理化学浸出量、移动以及转化特性.国内外对于土壤中重金属形态变化分析方法已经得到普遍认可[17-18],然而对于固体废物中重金属形态的分析研究,目前还没有公认的、普遍适用的分析方法[19].但Herck等[20]提出的浸出程序有很好的借鉴,为了更加准确获得锰的形态信息,对其进行了部分改进,采用七步法连续浸出.即取样品0.5g(精确到0.0001g),液固比为200:1,浸出液均为100mL,因为高液固比可以更大限度的将可溶部分溶解,避免无法预测的溶解度限制.按表3时间首先进行水平振荡浸出,然后进行离心,每步浸出结束后均要使用100mL高纯水冲洗浸出液固体的残留部分,然后浸出液定容到250mL容量瓶,测定其中锰的浓度和溶液pH值.
2 结果分析与讨论
2.1 可溶性锰稳定剂的固定效果
不同的浸出方法会产生不同浸出液的浓度和pH值,从而影响对于浸出效果的判断,为了更全面掌握稳定剂的浸出效果,采用浸出毒性浸出方法中的酸性浸出和水浸出进行浸出实验,图1为酸性浸出和水浸出条件下,稳定剂的固锰效果.

图1 不同稳定剂下可溶性锰的固定效率:CO,HA,MO,CO+SB,CO+TP,CO+HAFig.1 Immobilization efficiency of soluble Mn after treatment with CO,HA,MO,CO+SB,CO+TP,CO+HA

如图1(a~c)所示,采用单一药剂CO、HA、MO时,固定效率随着药剂投加量的增加呈现递增趋势.投加CO时,锰的固定率升高的同时,酸浸和水浸条件下浸出液的pH值也逐渐升高,当CO投加量高于9%时,锰的固定率在90%以上,浸出液pH值高于9.0.当MO投加量为10%时,锰的固定率接近100%,水浸出液的pH值低于9.0.在相同投加量下,HA的固定效率要远低于CO和MO.
图1(d~e)所示为CO与SB、TP和HA分别组合后的固定效果.可以看出前两者组合添加进一步提高可溶性锰的固定效果,且浸出液pH值不高于9.0,与HA的组合固定效果略差,也不能降低对浸出液pH值.对比TP和HA两种磷酸盐浸出后浸出液pH值,发现TP组合的浸出液pH值略低于HA组合,可能原因是由于它们溶解度产生的差别,TP是可溶性磷酸盐,它的溶解性和移动性较强,从而增加了锰渣体系对磷酸盐的吸附[21],而HA为水难溶性磷酸盐,它的溶解过程缓慢,磷酸盐释放量较少,反应过程需要持续较长的时间[22-23],因此,造成了在处理后浸出液pH值差异.
2.2 不同稳定化药剂处理后锰的价态分析
锰元素在渣中的价态变化有利于分析锰的固定机理.在强碱性条件下,硫酸锰可生成二羟化锰沉淀.二羟化锰极不稳定,易被空气氧化成二氧化锰及其水合物或四氧化三锰[24],化学反应如式(4)~式(6):为了分析稳定剂处理前后锰的价态变化,对渣中不同价态锰浓度进行测试,结果见图2.
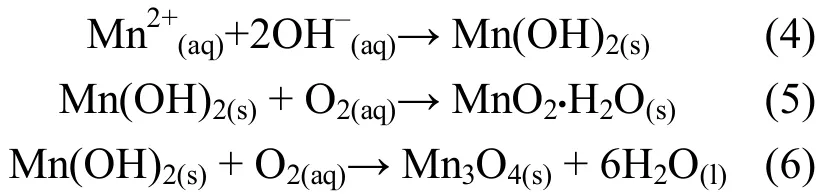
从图2可知,原渣中锰的价态主要是二价、三价和四价,Mn2+占了总锰96%以上.不同稳定剂加入后,各价态锰发生了显著变化.加入9%CO后,锰渣中Mn3+和Mn4+含量比原渣增加了15倍和2.2倍;再组合加入5%SB后,Mn3+含量略有降低,而Mn4+含量增加3.5倍.加入9%CO+5%TP后,Mn3+含量较9%CO时含量明显降低,而Mn4+含量却增加了2.3倍;加入9%CO+5%HA后,Mn3+含量和Mn4+含量略微增加.加入10%MO后,Mn3+和Mn4+含量较原渣分别增加了1.7倍和7.7倍.
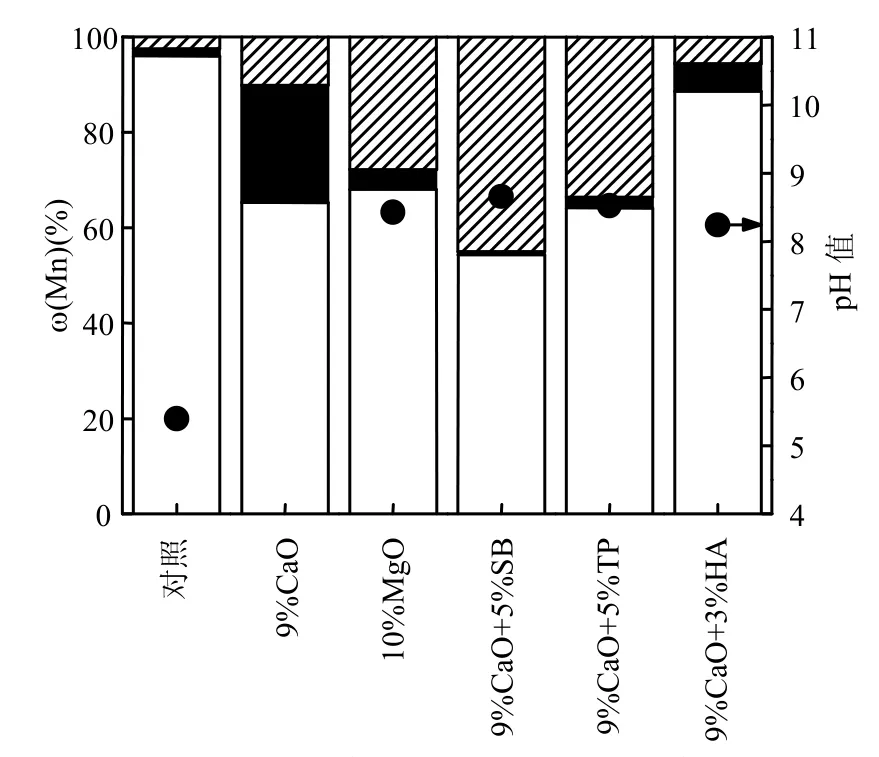
图2 不同稳定剂处理后锰价态变化Fig.2 Valence state analysis of manganese with different stabilizing reagents

可以看出,CO组合SB和TP,以及单一MgO均有助于Mn2+向Mn4+的转化,增加Mn4+含量;SB的加入一方面可以提高处理后锰渣的酸中和能力;另一方面,碳酸盐的水解有助于锰的固定和氧化.Mn2+的氧化速率与O2浓度和OH-浓度的平方成正比[25].当pH值在8.0~9.5之间时,锰的氧化产物中存在MnOOH[26],试验中加入不同稳定剂后,锰渣的pH在8.0~9.5之间,检测存在Mn3+,可能的成分为MnOOH;OH-与C在Mn2+产物存在竞争关系,Mn(OH)2(aq)+ C↔ MnCO3(aq)+ 2OH-说明了存在这种竞争.当加入SB时,C促进平衡向右方向进行,生成MnCO3,它在碱性和空气氧化条件下生成的产物是Mn3O4和γ-MnOOH,这两种产物不稳定,容易发生变化,形成稳定态的MnO2,这极可能是加入SB后Mn2+氧化成更多Mn4+的原因之一. Morgen[26]试验发现,在CO2缓冲体系下,随着pH值的升高,MnCO3、Mn(CO3含量会逐渐升高,也会有利于Mn2+的氧化.TP的加入也会促进Mn2+向Mn4+的转变,P与Mn(OH)2反应的机理尚不清楚,但是TP和SB中引入的非金属阳离子会氧化Mn2+,这是因为在反应的开始能够产生比Mn3O4和γ-MnOOH更不稳定的Mn3+产物,该产物容易转变为更为稳定的MnO2;其次,Na+、Ca2+可能会生成几种不同类型的含Mn4+的氧化物.
MO具有较高的活性和吸附性能和有较强的缓冲性能,最高pH值不超过9.0,以及具有处理使用安全可靠不具腐蚀性等独特性能[27],是处理重金属废水的常用方法之一.MO投加到水中,首先发生水化反应,产生的氢氧化镁和OH-再和MnSO4反应,见式(7)~式(9),从而将可溶态的Mn2+转变为不溶态的Mn2+和Mn3+、Mn4+.

2.3 处理后样品矿物组成分析
对不同稳定剂处理后的锰渣采用X射线粉末衍射仪进行物相分析,结果如图3所示.
原渣中锰的物相主要是硫酸锰,但其衍射强度比较微弱.在处理后所有样品中,MnSO4物相的峰都消失了,显示MnSO4参与反应转变为新的物相.加入CO后,锰渣中出现新的物相,在d=7.05Å和5.34Å出现衍射峰,与α-Mn0.98O2特征峰吻合,在d=3.78Å和3.31Å处衍射峰推测可能C-Mn2O3,这两种矿物成分的存在,与处理后锰的价态分析结果一致.在加入9%CO+5%SB和10%MO后,在d=1.62Å和3.79Å出现衍射强度,比对判断可能为MnO2;在处理后的样品中都发现了Mn3O4,这进一步说明固定后锰形成高价态物相.
锰渣中还含有一些非晶相的成分,也会影响稳定剂处理后锰产物的判断.锰的氧化物大多是细小的颗粒,多属于微米级和纳米级,结晶度差,通常都被当作是无定形[28],因此,XRD分析技术应用于复杂湿法冶金固废体系,其结论还还需要结合化学形态分析.

图3 不同稳定剂处理后锰废XRD图谱Fig.3 XRD patterns of EMSW samples treated with different stabilizing reagents: the control sample and EMSWQ= SiO2, Ch= CaSO4∙xH2O, Cs= CaSO4, G= CaSO4∙2H2O, Ms= MnSO4, Hm=Mn3O4, Mo=MnO2, S= CaMn4Si5O14∙2H2O, M9=Mn0.98O2, B= Mn2O3. (a)原渣, (b)9%CO, (c)9%CO+5%TP, (d)9%CO+3%HA, (e)9%CO+5%SB, (f)MO
2.4 锰的化学形态分析
可溶性锰的固定效果与其形态特别相关.按表3的浸出法,对不同稳定剂处理后的锰渣进行连续浸出,结果如图4所示.
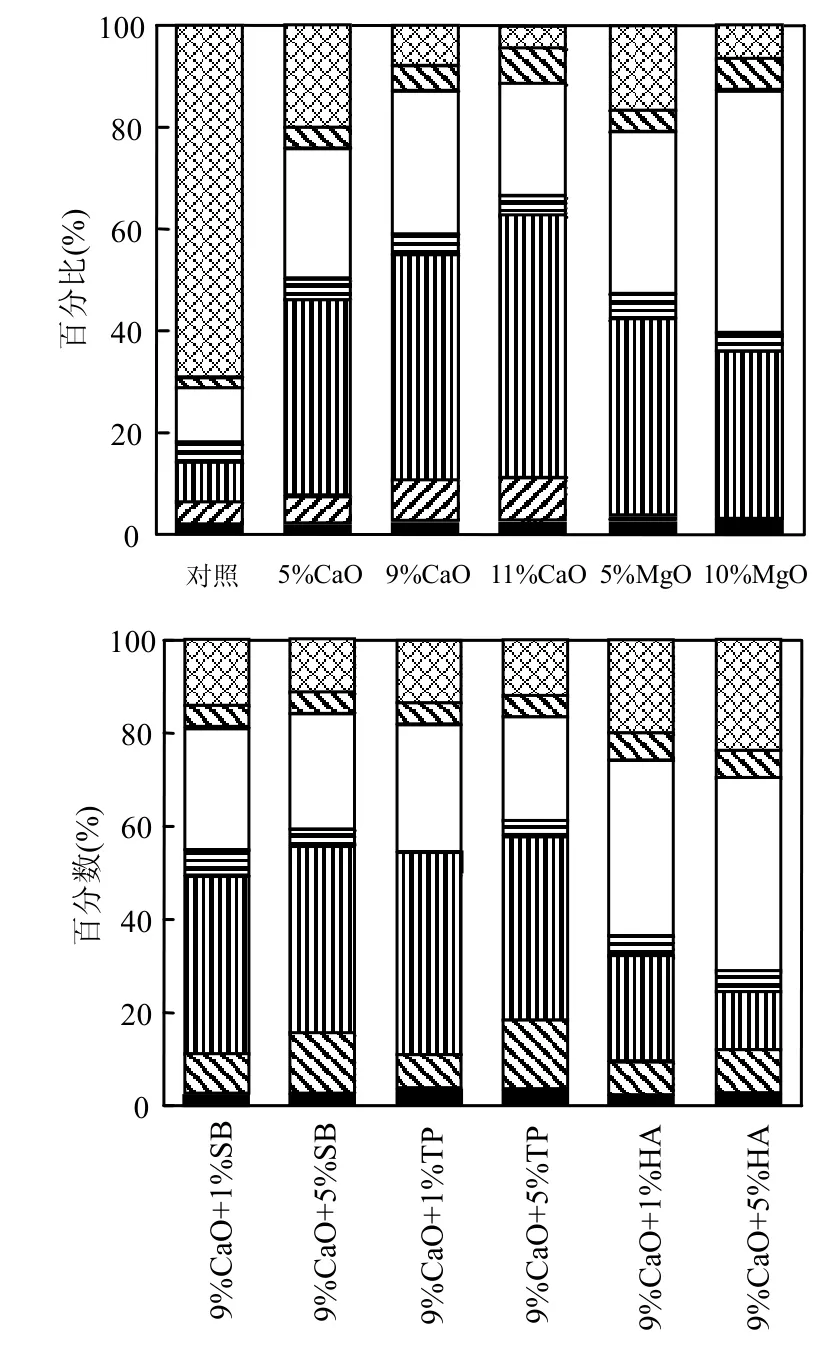
图4 不同稳定剂处理电解锰废渣后锰的化学形态Fig.4 Distribution of manganese over various chemical forms in EMSW treated with stabilizing reagents

从图4可知,原渣中锰的形态主要是水溶态锰和酸溶态锰,两者占了总锰的80%以上,还有11%的还原态锰.处理后,锰渣中各种形态的锰(除残渣态)的含量发生了显著变化.单一CO加入,投加量从5%增加到11%,锰渣中水溶态锰含量逐渐减少,酸溶态锰和还原态锰含量逐渐增加,说明水溶态锰转变为沉淀和被氧化生成高价态锰.加入MO后,锰的形态变化与CO变化类似.
与单一9%CO相比,9%CO+5%SB加入后水溶态锰和酸溶态含量略微增加,易氧化还原态锰含量减少,但是中等氧化态锰含量增加,说明加入SB后生成了更多的高价态的锰,这与之前价态分析的结果一致.组合加入TP后也产生了类似的结果.TP、HA与CO共同作用沉淀Mn的作用机理可能是磷酸盐诱导产生吸附作用,磷酸盐与锰反应形成沉淀,或者是矿物材料和磷酸盐表面产生吸附作用,具体作用机理还比较复杂[29],需要进一步研究.
3 结论
3.1 以CaO和MgO为主的稳定剂对锰渣中锰有较好的固定效果.投加10%的氧化镁,可溶性锰固定率达到100%,投加9%CaO+5%NaHCO3和9%CaO+5%Na3PO4,可以实现可溶性锰95%以上的固定率,且浸出液pH值不高于9.
3.2 锰渣中高浓度可溶性锰经稳定剂处理后,可溶性Mn2+生成成沉淀,然后部分沉淀转变为含高价锰的物相.
3.3 与其他稳定剂相比,单一稳定剂MgO以及CaO组合NaHCO3和Na3PO4条件下,锰渣中会生成更多的Mn3+和Mn4+,尤其是转变为中等强度还原态锰,这有利于可溶性锰固定效果的长期稳定性.
[1]Du B, Zhou C, Dan Z, et al.Preparation and characteristics of steam-autoclaved bricks produced from electrolytic manganese solid waste [J]. Construction and Building Materials, 2014,50: 291-299.
[2]周长波,何 捷,孟俊利,等.电解锰废渣综合利用研究进展 [J].环境科学研究, 2010,23(8):1044-1048.
[3]蒙美福,周立强.电解金属锰渣库建设环境安全性问题初探 [J].中国锰业, 2010,28(2):51-53.
[4]王允雨.电解锰业硒及重金属污染对人体健康风险研究 [D].淮南:安徽理工大学, 2012.
[5]Paria S, Yuet P K.Solidification-stabilization of organic and inorganic contaminants using portland cement: a literature review [J]. Environmental Reviews, 2006,14(4):217-255.
[6]Conner J R, Hoeffner S L.A critical review of stabilization/ solidification technology [J]. Critical Reviews in Environmental Science and Technology, 1998,28(4):397-462.
[7]胡 南,周军媚,刘运莲,等.硫酸锰废渣的浸出毒性及无害化处理的研究 [J]. 中国环境监测, 2007,23(2):49-52.
[8]彭德姣,胡 南,彭清静,等.硫酸锰废渣的浸出毒性及处理研究[J]. 环境污染治理技术与设备, 2006,7(11):100-102.
[9]王积伟,周长波,杜 兵,等.电解锰渣无害化处理技术 [J]. 环境工程学报, 2014,8(1):329-333.
[10]GB 5085.1-2007 危险废物鉴别标准腐蚀性鉴别 [S].
[11]GB 18599-2001 一般工业固体废物贮存、处置场污染控制标准 [S].
[12]HJ/T 299-2007 固体废物浸出毒性浸出方法硫酸销酸法 [S].
[13]HJ/T 557-2010 固体废物浸出毒性浸出方法水平振荡法 [S].
[14]GB 5085.3-2007 危险废物鉴别标准 浸出毒性鉴别 [S].
[15]DZG 20.01-1991 矿物岩石分析 [S].
[16]Barna R, Rethy Z, Tiruta-Barna L.Release dynamic process identification for a cement based material in various leaching conditions. Part I. Influence of leaching conditions on the release amount [J]. Journal of Environmental Management, 2005,74(2): 141-151.
[17]卢 聪,李青青,罗启仕,等.场地土壤中有效态砷的稳定化处理及机理研究 [J]. 中国环境科学, 2013,33(2):298-304.
[18]李 平,王兴祥,郎 漫,等.改良剂对Cu, Cd污染土壤重金属形态转化的影响 [J]. 中国环境科学, 2012,32(7):1241-1249.
[19]杨 杰,鲁 荔,杨金燕,等.攀枝花地区土壤及矿物中3种重金属形态及健康风险 [J]. 安全与环境学报, 2014,14(1):242-247.
[20]Van Herck P, Vandecasteele C.Evaluation of the use of a sequential extraction procedure for the characterization and treatment of metal containing solid waste [J]. Waste Management,2001,21(8):685-694.
[21]周世伟,徐明岗.磷酸盐修复重金属污染土壤的研究进展 [J].生态学报, 2007,27(7):3043-3050.
[22]Cao R X, Ma L Q, Chen M, et al.Phosphate-induced metal immobilization in a contaminated site [J]. Environmental Pollution, 2003,122(1):19-28.
[23]Cao X, Ma L Q, Chen M, et al. Impacts of phosphate amendments on lead biogeochemistry at a contaminated site [J]. Environmental Science and Technology, 2002,36(24):5296-5304.
[24]Tebo B M, Johnson H A, McCarthy J K, et al. Geomicrobiology of manganese (II) oxidation [J]. TRENDS in Microbiology, 2005,13(9):421-428.
[25]Kessick M A, Morgan J J. Mechanism of autoxidation of manganese in aqueous solution [J]. Environmental Science and Technology, 1975,9(2):157-159.
[26]Morgan J J. Kinetics of reaction between O2and Mn (II) species in aqueous solutions [J]. Geochimica et Cosmochimica Acta,2005,69(1):35-48.
[27]Cubukcuoglu B, Ouki S. Solidification/stabilisation of electric arc furnace waste using low grade MgO [J]. Chemosphere, 2012,86(8):789-796.
[28]Post J E.Manganese oxide minerals: Crystal structures and economic and environmental significance [J]. Proceedings of the National Academy of Sciences, 1999,96(7):3447-3454.
[29]Ndiba P, Axe L, Boonfueng T. Heavy metal immobilization through phosphate and thermal treatment of dredged sediments [J]. Environmental Science and Technology, 2008,42(3):920-926.
Effects of different reagents on the stabilization of soluble manganese from electrolytic manganese solid waste.
DU Bing1,2, DAN Zhi-gang2*, XIAO Ke2,3, WANG Jun1, DUAN Ning2(1.Research Center for Eco-Environmental Sciences,Chinese Academy of Sciences, Beijing 100085, China;2.Technology Center for Heavy Metal Cleaner Production Engineerings, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;3.College of Water Sciences, Beijing Normal University, Beijing 100875, China). China Environmental Science, 2015,35(4):1088~1095
In order to satisfy the requirement of economical treatment for a large quantity of solid waste, the sort of reagents, such as alkaline materials, phosphate and carbonate, were examined. The immobilization effectiveness of reagents, such as CaO, MgO, and Ca10(PO4)6(OH)2or those reagents in combination with NaHCO3, Na3PO4were investigated. Mineral composition, valence states and speciation of manganese were measured to analyze the stabilization mechanism on soluble manganese. The results showed that the stabilization efficiency of soluble manganese can reach 100% on the condition of 10% addition of magnesium oxide accounting for the mass of EMSW. The immobilization efficiency of soluble manganese could achieve 95% using 9%CaO+5%NaHCO3and 9%CaO+5%Na3PO4. Those stabilizers made the conversion of soluble manganese to precipitated manganese and parts of them to high-charged oxidation products. The addition of CaO in combination with 5%NaHCO3and 5% Na3PO4would be favorable for the transformation of Mn2+to Mn3+and Mn4+.
electrolytic manganese solid waste;stabilization;calcium oxide;magnesium oxide;leachability;speciation
X705
A
1000-6923(2015)04-1088-08
杜 兵(1984-),男,河南信阳人,中国科学院生态环境研究中心博士生,主要从事含重金属固体废物污染控制研究.发表论文10余篇.
2014-09-09
国家科技支撑计划(2012BAF03B03);中央级公益性科研院所基本科研业务专项(2013-YSKY-20)
* 责任作者, 副研究员, danzg@craes.org.cn

