Ca2+对酸性硫酸盐环境中次生铁矿物合成的影响
刘奋武,高诗颖,崔春红,梁剑茹,周立祥*(.山西农业大学资源环境学院,环境工程实验室,山西 太谷03080;.南京农业大学资源与环境科学学院,环境工程系,江苏 南京 0095)
Ca2+对酸性硫酸盐环境中次生铁矿物合成的影响
刘奋武1,高诗颖1,崔春红2,梁剑茹2,周立祥2*(1.山西农业大学资源环境学院,环境工程实验室,山西 太谷030801;2.南京农业大学资源与环境科学学院,环境工程系,江苏 南京 210095)
通过摇瓶培养试验,在富铁酸性硫酸盐环境中,探析0、50、100、200或400mg/L Ca2+加入对嗜酸性氧化亚铁硫杆菌(A. ferrooxidans)生物合成次生铁矿物过程的影响.分析了体系pH值、氧化还原电位(ORP)、Fe2+氧化率、总Fe沉淀率以及次生铁矿物矿相等相关指标的变化情况.结果表明,0~24h培养过程中,各体系pH值、ORP、Fe2+氧化率及总Fe沉淀率变化幅度基本一致.24~108h培养过程中,体系中Ca2+加入量越大,Fe2+氧化越迅速,相应总Fe沉淀率相对较高.400mg/L Ca2+的加入使得体系Fe2+在72h氧化完全,总Fe沉淀率在108h达到39.1%.0、50、100或200mg/L Ca2+加入的体系在24~84h培养过程中,体系Fe2+氧化速率随着Ca2+加入量逐渐增加而依次升高,并在84h Fe2+氧化完全,且在108h,相应体系总Fe沉淀率分别为27.0%、29.7%、33.9%或36.9%.不同体系所得次生铁矿物均为施氏矿物与黄铁矾的混合物.本研究结果对明晰富铁酸性硫酸盐环境钙离子调控生物成因次生铁矿物合成的影响机理有一定指导意义.
钙离子;氧化亚铁硫杆菌;次生铁矿物;铁沉淀率;矿相
酸性矿山废水(AMD)是煤矿和各种金属矿在开采和利用过程中,其中的含硫矿物(主要为硫铁矿)与地下(表)水接触,在空气和微生物的共同作用下,形成的一种酸度极高并含有大量Fe2+、Fe3+、SO42-及(类)重金属的离子的一类废水[1-3].其若未经有效处理任意排放, 将会对矿山周边地区的地表水、地下水或土壤环境造成极大污染,进而间接危害动植物健康[4-5].已有较多研究表明,在类似AMD的富铁酸性硫酸盐环境中,氧化亚铁硫杆菌(A. ferrooxidans)可介导施氏矿物或黄铁矾等次生铁矿物的合成[6-7],相关方程式如下:

从上述方程式可以得出, 次生铁矿物合成过程可以有效去除AMD 体系中的Fe2+、Fe3+和SO42-[8-9].前人研究证实,黄铁矾或施氏矿物等次生铁矿物合成过程亦能够通过吸附或共沉淀的形式去除酸性硫酸盐体系中Cr、Cd、As、Pb、Hg等(类)重金属离子[10-11],故次生铁矿物合成过程对酸性矿山废水中Fe、SO42-及重金属等污染物的迁移行为具有重要影响.
酸性矿山废水是基于地下(表)水环境而产生的,探索地下(表)水关键离子对生物成因次生铁矿物合成的影响对揭示酸性矿山废水中污染物迁移规律具有重要意义.地下(表)水环境中普遍存在K+、Na+、Mg2+、Ca2+等主要阳离子[12].作为参与次生铁矿物黄铁矾合成的主要反应离子,K+与Na+对酸性硫酸盐体系次生铁矿物合成过程的影响被研究人员广泛关注[13-14],且已证实K+成矾能力约为Na+的200倍[15].另外, Mg2+含量能够通过影响酸性硫酸盐体系初期生物成因次生铁矿物粘附形态,进而调控次生铁矿物合成量.例如,当体系Mg2+含量达到48mg/L时,体系初期产生的次生铁矿物紧密粘附于反应器底部,前期矿物不能较好的为后期矿物合成提供晶种,进而使得矿物合成量降低. 而当体系Mg2+含量降低为4.8mg/L时,体系初期产生的次生铁矿物却分散于溶液中,通过良好的晶种刺激作用加速矿物合成[7].然而,关于地下(表)水环境中Ca2+对酸性硫酸盐体系次生铁矿物合成影响的相关研究却鲜见报道.鉴于此, 本研究在改进型9K液体培养基这一典型酸性硫酸盐环境中,采用A. ferrooxidans催化合成次生铁矿物,探讨Ca2+含量对矿物合成体系pH值、氧化还原电位(ORP)、Fe2+氧化率、总Fe沉淀率及次生铁矿物矿相的影响.本研究结果可为揭示地下(表)水环境Ca2+对生物成因次生铁矿物合成的调控机理提供一定的科学思路.
1 材料与方法
1.1 氧化亚铁硫杆菌(A. ferrooxidans)接种液的制备
A. ferrooxidans LX5 (CGMCC No.0727)[16]菌株被接种于150mL改进型9K液态培养基[7]中,用H2SO4调节体系pH值至2.50,用八层无菌纱布封口后, 将体系置于180r/min往复式振荡器(ZD-85A)中28ºC培养2~3d至体系Fe2+氧化完全.培养液经定性中速滤纸过滤后,将15mL滤液再次接种于135mL改进型9K液态培养基重复上述微生物培养及培养液过滤过程,所得滤液即为本研究后续次生铁矿物合成所需的接种菌液.用双层平板法[17]对体系微生物进行计数,获知接种液中A. ferrooxidans LX5浓度约为107cells/mL.
1.2 改进型无钙9K液体培养基母液及Ca2+母液的制备
改进型无钙9K液体培养基母液制备:将442.4g FeSO4∙7H2O、30g (NH4)2SO4、1.0g KCl、5.0g K2HPO4及5.0g MgSO4∙7H2O依次溶于1L去离子水,配制成浓缩10倍的无钙9K液体培养基母液.Ca2+母液制备:将2.952g Ca(NO3)2∙4H2O溶于1L去离子水,配制成Ca2+浓度为500mg/L 的Ca2+母液.
1.3 Ca2+对酸性硫酸盐体系A. ferrooxidans催化合成次生铁矿物的影响研究
将15mL改进型无钙9K液体培养基母液与15mL A. ferrooxidans LX5接种液分别依次加入15个250mL锥形瓶.锥形瓶平均分为5组,每组分别加入Ca2+母液0、15、30、60 或120mL,并分别补充120、105、90、60 或0mL的去离子水,使得每个体系溶液体积均为150mL,而Ca2+浓度却分别为0、50、100、200和400mg/L,并分别标记为“Ca2+-0mg/L”、“Ca2+-50mg/L”、“Ca2+-100mg/L”、“Ca2+-200mg/L”和“Ca2+-400mg/L”5个处理.将不同处理体系用H2SO4调节初始pH值至2.50,后置于温度与转速分别为28ºC及150r/min的往复式振荡器中振荡培养,培养期间采用称重法定时补加因蒸发而减少的水分.每12h动态监测体系pH值及ORP值,并用移液枪从体系均匀取样1mL,过0.22μm滤膜[18],及时测定滤液Fe2+及总Fe浓度,进而计算不同时刻Fe2+氧化率及总Fe沉淀率的变化情况.培养108h 后将体系产生的矿物沉淀用定性滤纸收集,用酸化后pH为2.0的去离子水洗涤3次,再用去离子水洗涤2次后,在50℃环境中烘干[19].分析次生铁矿物矿相及其形貌.
1.4 测定方法
用PHS-3C型酸度计测定体系pH及ORP值,采用邻菲罗啉比色法测定体系中Fe2+与总Fe浓度[16,20],总Fe与Fe2+浓度差值为Fe3+浓度,某时刻Fe2+氧化率=(初始体系Fe2+浓度-某时刻体系Fe2+浓度/初始体系Fe2+浓度)×100%.总Fe沉淀率可用如下公式计算:(初始溶液体系总Fe浓度-某时刻溶液体系总Fe浓度)/初始溶液体系总Fe浓度×100%[9].矿物矿相用X射线衍射仪(XRD,MiniFles II,日本理学)测定,测试工作条件为:管电压30kV,管电流15mA,扫描区间10~70º(2θ),步长0.02º,Cu靶(弯晶单色器).利用热场发射扫描电子显微镜(SEM,JSM-7001F),在加速电压5.0kV,工作距离(样品表面到物镜的距离)9.7mm的条件下,直接观察体系次生铁矿物的形貌[7].
1.5 数据统计及绘图软件
使用Microsoft Excel (2003) 软件对本文数据进行分析统计,本文图中所有实验数据均用平均值与标准偏差表示.使用Origin 7.5软件制图.
2 结果与讨论
2.1 Ca2+对A. ferrooxidans催化合成次生铁矿物体系pH与ORP变化的影响
生物合成次生铁矿物的过程可分为3个过程:Fe2+在A. ferrooxidans作用下氧化为Fe3+;Fe3+水解生成矿物合成所需的初始晶核;次生铁矿物在晶核表面逐渐长大[21].Fe2+氧化成Fe3+过程会消耗体系中的H+,使得体系pH值上升,而Fe3+水解成矿产生的H+却会使得体系pH值呈下降趋势.体系中H+的相对含量及Fe2+与Fe3+的相互转化对体系pH值与ORP值具有明显影响[22].本研究中,Ca2+浓度对次生铁矿物合成体系中pH值及ORP的影响见图1.

图1 Ca2+对次生铁矿物合成体系pH值与ORP变化的影响Fig.1 Effect of calcium ions on the pH and ORP in secondary iron minerals bio-synthesis systems
由图1a可见,在A. ferrooxidans培养的前24h,5个处理体系pH值变化基本一致,均从初始的2.50上升到2.74.36h时,除“Ca2+-400mg/L”处理的pH保持2.74不变外,其余4个处理pH值均上升至2.80.
36~108 h培养期间,所有处理的pH值均开始下降,而下降速率却不尽相同.整体表现在,Ca2+加入量越大,体系pH下降幅度越大.例如,在108h,“Ca2+-0mg/L”、“Ca2+-50mg/L”、“Ca2+-100mg/L”、“Ca2+-200mg/L”或“Ca2+-400mg/L”的pH值最终分别降低至2.26、2.21、2.16、2.08 或2.02. 另外,刘晓燕等[22]研究表明,A. ferrooxidans 生物合成次生铁矿物体系中pH值和ORP值的变化趋势始终呈相反的变化趋势,这与本实验研究结果相类似.本研究中5个处理的ORP值在0~24h 内均从257mV下降至243mV(图1b).36h 时,除“Ca2+-400mg/L”处理ORP基本保持不变外,其余4个处理ORP均进一步降低至239mV.36~108h培养过程中,Ca2+加入量越大,ORP值上升速率亦越快.可见,在A. ferrooxidans培养前期(0~24h),Ca2+加入并不影响体系pH值及ORP的变化趋势,其显著影响主要作用于A. ferrooxidans培养中后期(24~108h),且随着体系Ca2+加入量增加,体系pH值降低幅度越快,ORP升高速率越明显.
2.2 Ca2+对A. ferrooxidans催化合成次生铁矿物体系Fe2+氧化率及总Fe沉淀率的影响
Fe2+有效氧化是次生铁矿物合成的关键环节,总Fe沉淀率能够间接表征次生铁矿物的合成量.故探究次生铁矿物合成过程中Fe2+氧化率及总Fe沉淀率显得尤为必要.本研究中,Ca2+浓度对生物合成次生铁矿物体系Fe2+氧化率及总Fe沉淀率的影响情况如图2与图3所示.
由图2可见,体系的Fe2+在培养初期就表现出逐渐氧化的趋势.前人研究表明,pH<4.0的体系中,Fe2+难以被O2进行化学氧化[8].本研究体系初始pH值为2.50,故可以证实,体系初期即表现出的Fe2+氧化行为是A. ferrooxidans 生物氧化所致.从图2a可以得出,在0~24h A. ferrooxidans培养期间,5个处理体系Fe2+氧化率变化情况几乎一致,培养至24h,体系Fe2+氧化率均增加至25.0%.24~84h培养过程中,随着Ca2+加入量增加,任意时刻Fe2+氧化率亦相对提高.例如,在60h时,“Ca2+-0mg/L”、“Ca2+-50mg/L”、“Ca2+-100mg/L”、“Ca2+-200mg/L”或“Ca2+-400mg/L”处理体系Fe2+氧化率分别为69.7 %、76.8 %、83.3 %、89.7 % 或96.3 %,即此时“Ca2+-400mg/L”处理体系Fe2+氧化率分别为“Ca2+-0mg/L”、“Ca2+-50mg/L”、“Ca2+-100mg/L”或“Ca2+- 200mg/L”处理体系的1.38、1.25、1.16或1.07倍.“Ca2+-400mg/L”处理体系中的Fe2+在72h完全氧化.其余处理体系中Fe2+实现完全氧化氧化的时间要比“Ca2+-400mg/L”处理体系滞后12h.
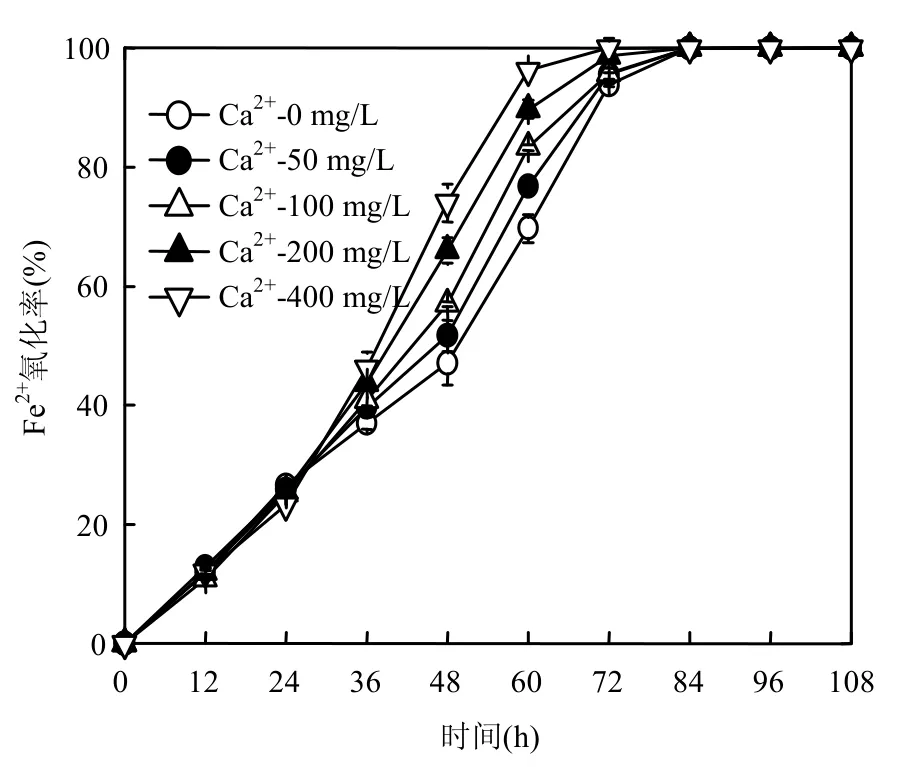
图2 Ca2+对次生铁矿物合成过程Fe2+氧化率的影响Fig.2 Effect of calcium ions on the Fe2+oxidation efficiency in secondary iron minerals biosynthesis systems
由图3可知,0~24h所有处理体系总Fe沉淀均十分缓慢,24h时仅为3%.36h后,各处理体系总Fe沉淀率开始迅速增加,同时,任意时刻总Fe沉淀率均与体系Ca2+加入量有显著的正相关关系.例如,在108h培养结束时,“Ca2+-0mg/L”、“Ca2+-50mg/L”、“Ca2+-100mg/L”、“Ca2+-200mg/L”或“Ca2+-400mg/L”处理体系总Fe沉淀率分别达到了27.0%、29.7%、33.9%、36.9% 或39.1%,即此时“Ca2+-400mg/L”处理体系总Fe沉淀量分别为“Ca2+-0mg/L”、“Ca2+-50mg/L”、“Ca2+-100mg/L”或“Ca2+-200mg/L”处理体系的1.45、1.32、1.15或1.06倍.可见,Ca2+的加入能够显著提高酸性硫酸盐体系中Fe2+氧化率和总Fe的沉淀率.然而从A. ferrooxidans培养前期(0~24h)Fe2+氧化率相关数据可以得出,Ca2+并不能直接提高体系的Fe2+氧化能力.
综合分析图1、图2与图3相关数据可以获知并推断出,“Ca2+-0mg/L”、“Ca2+-50mg/L”、“Ca2+-100mg/L”、“Ca2+-200mg/L”或“Ca2+-400mg/L”各处理体系,在前24h A. ferrooxidans培养过程中,各体系pH值、ORP、Fe2+氧化率和总Fe沉淀率的变化幅度基本一致.在24~108h期间,Ca2+加入量显著改变了次生铁矿物合成体系pH值、ORP、Fe2+氧化率或总Fe沉淀率等指标的变化.
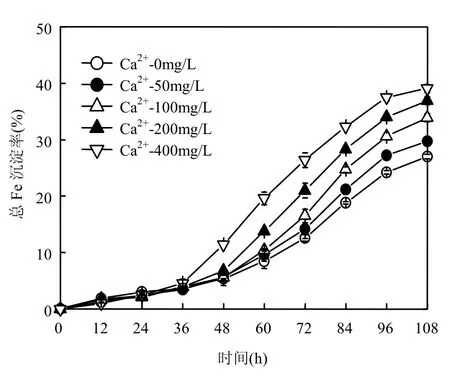
图3 Ca2+对次生铁矿物合成过程总Fe沉淀率的影响Fig.3 Effect of calcium ions on the total Fe precipitation efficiency in secondary iron minerals biosynthesis systems
2.3 Ca2+对A. ferrooxidans催化合成次生铁矿物体系次生铁矿物矿相的影响
伴随总Fe沉淀率的逐渐升高,次生铁矿物在不同体系均有所合成.X射线衍射图谱(XRD)是鉴别矿物矿相的主要手段[11,23].本研究中,不同研究体系合成的次生铁矿物的X衍射图谱如图4所示.由图4可见,5个体系所合成的次生铁矿物X射线衍射图谱中各衍射峰的出峰位置及相对强度近似一致.将本研究不同体系所得矿物出峰特征与JCPDS[24]所提供的晶型黄铁矾类物质(黄钾铁矾:No.22-0827;黄铵铁矾:No.26-1014)与非晶型施氏矿物(No.47-1775)的标准衍射图谱进行比对,可以得出,本研究5个次生铁矿物合成体系所得矿物衍射图谱中均包含黄铁矾的特征尖锐衍射强峰(2θ=17.41°、29.55°、39.37°、45.86° 及49.93°)[25]及相对微弱的施氏矿物特征衍射峰(2θ=35.16°)[26].由此推断,所有体系产生的次生铁矿物均应为黄铁矾与施氏矿物共存的混合物,且这一结果在次生铁矿物SEM照片(以“Ca2+-400mg/L”处理体系所得矿物形貌为例)中可得到较好的证实(图4b).此外,从本研究所获次生铁矿物形貌中可直观看出,黄铁矾类物质为结晶度较好的假立方体“枕状”结构,而嵌套于黄铁矾晶体间絮状无定型物质为结晶度很差的施氏矿物,类似形貌在前人相关研究结果中亦见报道[11,27].可见,0~400mg/L Ca2+的加入不会改变酸性硫酸盐体系合成次生铁矿物的矿相.

图4 不同处理体系所得次生铁矿物X射线衍射图谱及其形貌Fig.4 XRD patterns and SEM of secondary iron minerals harvested from different treatment systems
在研究过程中,在有Ca2+加入的不同处理体系在初始时刻(0h)有不同程度的白色沉淀产生.此类沉淀物应为Ca2+与体系SO42-结合而产生的难溶于水的沉淀.前人研究结果表明,如矿物本身、活性炭、石英砂、硅藻土等物质,均能够通过“晶种”作用刺激促进次生铁矿物的合成[8,28-30].鉴于此,笔者猜想,随着Ca2+的加入,体系产生的沉淀物质均匀分散于A. ferrooxidans培养体系中,能够为次生铁矿物的生物合成提供“晶种”刺激.进而提高了体系总Fe的沉淀效率.为了验证这一猜想,重新配置“Ca2+-400mg/L”处理体系,用定性滤纸对体系初始时刻溶液进行过滤而获得体系初始时刻产生的沉淀物,且用X射线衍射技术对其进行矿相鉴别,相应X射线衍射图谱如图5所示.
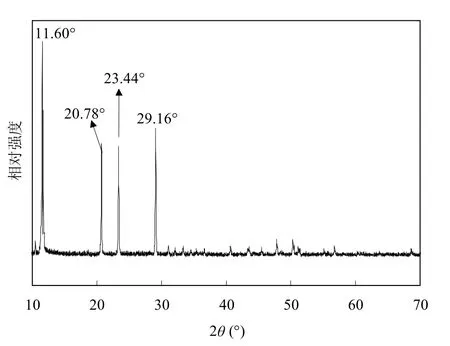
图5 Ca2+加入酸性硫酸盐体系初始时刻沉淀物质的X射线衍射图谱Fig.5 XRD patterns of sediment harvested from sulfate-rich acidic system with Ca2+addition
由图5可见,Ca2+加入酸性硫酸盐体系产生沉淀的X射线衍射图谱在11.60°、20.78°、23.44° 及29.16°处具有明显的衍射强峰,且在11.60°处衍射峰相对强度最大.通过比对JCPDS[24]所提供的矿物标准图谱,可以发现所获沉淀出峰特征与CaSO4∙2H2O标准衍射图谱特征(No.33-0311)相吻合.同时,本研究得到的此衍射图谱与前人通过化学反应过程所制备的CaSO4∙2H2O衍射图谱相一致[31].为了进一步证实CaSO4∙2H2O可在次生铁矿物合成过程中扮演“晶种”角色这一观点,将获得的0.5g CaSO4∙2H2O 沉淀加入本研究相应的无钙改进型9K培养基中,在相同条件下培养72h后,体系Fe2+氧化完全,总Fe去除率高达46%.综上所述,体系0~400mg/L Ca2+的加入虽不能改变酸性硫酸盐体系合成次生铁矿物的矿相,却可以明显影响体系pH值、ORP、Fe2+氧化率或总Fe沉淀率等相关指标的变化.Ca2+加入酸性硫酸盐体系产生CaSO4∙2H2O晶型沉淀物质,其在后期次生铁矿物合成过程中充当“晶种”角色,促进次生铁矿物的合成,进而加速了体系酸化进程.前已述及,Fe2+氧化为Fe3+过程如下:

可见,体系H+浓度增加及Fe3+快速沉淀生成次生铁矿物,均易使得A. ferrooxidans介导下Fe2+氧化过程正反应方向移动,进而在一定程度上促进体系Fe2+氧化.
3 结语
研究结果表明,在酸性硫酸盐体系,Ca2+的存在能够与SO42-结合生成CaSO4∙2H2O.其能够在生物成因次生铁矿物合成过程中充当“晶种”角色,有效促进次生铁矿物合成,进而使得次生铁矿物合成体系酸化速率明显、ORP升高显著、Fe2+氧化加速.由此可以推测,地下(表)水中Ca2+的存在可在一定程度上加速基于此环境形成的酸性矿山废水中总Fe沉淀效率,利于体系次生铁矿物的合成.
[1]Gammons C H, Duaime T E, Parker S R, et al. Geochemistry and stable isotope investigation of acid mine drainage associated with abandoned coal mines in central Montana, USA [J]. Chemical Geology, 2010,269(1):100-112.
[2]Tischler J S, Wiacek C, Janneck E, et al. Bench-scale study of the effect of phosphate on an aerobic iron oxidation plant for mine water treatment [J]. Water Research, 2014,48:345-353.
[3]刘奋武,卜玉山,田国举,等.温度与pH对生物合成施氏矿物在酸性环境中溶解行为及对Cu2+吸附效果的影响 [J]. 环境科学学报, 2013,33(9):2445-2451.
[4]Sobron P, Rull F, Sobron F, et al. Raman spectroscopy of the system iron (III)-sulfuric acid-water: an approach to Tinto River’s (Spain) hydrogeochemistry [J]. Spectrochimica acta. Part A, Molecular and Biomolecular Spectroscopy, 2007,68(4):1386-1425.
[5]Cammack K M, Wright C L, Austin K J, et al. Effects of highsulfur water and clinoptilolite on health and growth performance of steers fed forage-based diets [J]. Journal of Animal Science,2010,88(5):1777-1785.
[6]Hedrich S, Lünsdorf H, Kleeberg R, et al. Schwertmannite formation adjacent to bacterial cells in a mine water treatment plant and in pure cultures of Ferrovum myxofaciens [J]. Environmental Science & Technology, 2011,45(18):7685-7692.
[7]刘奋武,高诗颖,王 敏,等.镁离子对氧化亚铁硫杆菌生物合成次生铁矿物的影响 [J]. 中国环境科学, 2014,34(3):713-719.
[8]Wang M, Zhou L X. Simultaneous oxidation and precipitation of iron using jarosite immobilized Acidithiobacillus ferrooxidans and its relevance to acid mine drainage [J]. Hydrometallurgy,2012,125-126:152-156.
[9]刘奋武,王 敏,卜玉山,等.酸性硫酸盐环境中菌密度对生物成因次生铁矿物形成的影响 [J]. 环境科学学报, 2013,33(11): 3025-3031.
[10]Asta M P, Cama J, Martínez M, et al. Arsenic removal by goethite and jarosite in acidic conditions and its environmental implications [J]. Journal of Hazardous Materials, 2009,171(1-3): 965-972.
[11]Zhu J Y, Gan M, Zhang D, et al. The nature of Schwertmannite and Jarosite mediated by two strains of Acidithiobacillus ferrooxidans with different ferrous oxidation ability [J]. Materials Science and Engineering C, 2013,33(5):2679-2685.
[12]Mondal N C, Singh V P, Singh V S, et al. Determining the interaction between groundwater and saline water through groundwater major ions chemistry [J]. Journal of Hydrology,2010,388(1/2):100-111.
[13]Caraballo M A, Sarmiento A M, Sanchez-Rodas D, et al. Parviainen A. Seasonal variations in the formation of Al and Si rich Fe-stromatolites in the highly polluted acid mine drainage of Agua Agria Creek (Tharsis, SW Spain) [J]. Chemical Geology,2011,284(1/2):97-104.
[14]Huang S, Zhou L X. Fe2+oxidation rate drastically affect the formation and phase of secondary iron hydroxysulfate mineral occurred in acid mine drainage [J]. Materials Science and Engineering C, 2012,32(4):916-921.
[15]Bai S Y, Xu Z H, Wang M, et al. Both initial concentrations of Fe(II) and monovalent cations jointly determine the formation of biogenic iron hydroxysulfate precipitates in acidic sulfate-rich environments [J]. Materials Sciences and Engineering C,2012,32:2323-2329.
[16]Liu F W, Zhou L X, Zhou J, et al. Improvement of sludge dewaterability and removal of sludge-borne metals by bioleaching at optimum pH [J]. Journal of Hazardous Materials,2012,221-222:170-177.
[17]王世梅,周立祥.提高氧化亚铁硫杆菌和氧化硫硫杆菌平板检出率的方法:双层平板法 [J]. 环境科学学报, 2005,25(10):1418-1420.
[18]宋永伟,赵博文,霍敏波,等.温度对嗜酸性硫杆菌活性和生物成因次生铁矿物形成的影响 [J]. 环境科学, 2013,34(8):3264-3271.
[19]李浙英,梁剑茹,柏双友,等.生物成因与化学成因施氏矿物的合成、表征及其对As(Ⅲ)的吸附 [J]. 环境科学学报, 2011,31(3): 460-467.
[20]柏双友,梁剑茹,周立祥.FeSO4-K2SO4-H2O体系中Fe/K摩尔比对生物成因羟基硫酸铁矿物质量的影响及环境意义 [J]. 环境科学学报, 2010,30(8):1601-1607.
[21]王 敏,梁剑茹,周立祥.晶种和钾离子促进生物成因黄铁矾形成的作用机制 [J]. 南京农业大学学报, 2013,36(2):97-102.
[22]刘晓燕,王向东,蒋文举,等.氧化亚铁硫杆菌对亚铁离子的氧化及其动力学研究 [J]. 环境污染与防治, 2005,27(4):244-246.
[23]Katsioti M, Boura P, Agatzini S, et al. Use of jarosite/alunite precipitate as a substitute for gypsum in Portland cement [J]. Cement & Concrete Composites, 2005,27(1):3-9.
[24]JCPDS (Joint Committee on Powder Diffraction Standards). Mineral Powder Diffraction Files [Z]. International Center for Diffraction Data, Swarthmore: Pennsyvania., 2002.
[25]Wang H M, Bigham J M, Tuovinen O H. Formation of schwertmannite and its transformation to jarosite in the presence of acidophilic iron-oxidizing microorganisms [J]. Materials Science and Engineering C, 2006,26(4):588-592.
[26]Eskandarpour A, Onyango M S, Ochieng A, et al. Removal of fluoride ions from aqueous solution at low pH using schwertmannite [J]. Journal of Hazardous Materials, 2008,152(2): 571-519.
[27]Wang H M, Bigham J M, Jones F S, et al. Synthesis and properties of ammoniojarosites prepared with iron-oxidizing acidophilic microorganisms at 22-65oC [J]. Geochimica et Cosmochimica Acta, 2007,71(1):155-164.
[28]王 敏,周立祥.硅藻土、石英砂和钾离子促进微生物转化酸性矿山废水中亚铁成次生矿物的研究 [J]. 岩石矿物学杂志,2011,30(6):1031-1038.
[29]Jensen A B, Webb C. Ferrous sulphate oxidation using thiobacillus ferrooxidans: a review [J]. Process Biochemistry,1995,30(3):225-236.
[30]Song Y W, Wang M, Liang J R, et al. High-rate precipitation of iron as jarosite by using a combination process of electrolytic reduction and biological oxidation [J]. Hydrometallurgy, 2014,143:23-27.
[31]Pan Z Y, Lou Y, Yang G Y, et al. Preparation of calcium sulfate dihydrate and calcium sulfate hemihydrate with controllable crystal morphology by using ethanol additive [J]. Ceramics International, 2013,39(5):5495-5502.
Effect of calcium ions on secondary iron minerals formation in sulfate-rich acidic environment.
LIU Fen-wu1, GAO Shi-ying1, CUI Chun-hong2, Liang Jian-ru2, ZHOU Li-xiang2*(1.Environmental Engineering Laboratory, College of Resource and Environment, Shanxi Agricultural University, Taigu 030801, China;2.Departments of Environmental Engineering, College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China). China Environmental Science, 2015,35(4):1142~1148
Secondary iron minerals were synthesized by A. ferrooxidans in the iron- and sulfate-rich acidic environment through shake flask incubation experiment in this study. The effect of 0, 50, 100, 200, or 400mg/L Ca2+on pH, oxidation reduction potential (ORP), Fe2+oxidation efficiency, total Fe precipitation efficiency, and secondary iron minerals phase in A. ferrooxidans incubation systems were investigated. The results showed that variation of pH, ORP, Fe2+oxidation efficiency, and total Fe precipitation efficiency were similar during 0~24h incubation for all treatments. In the period of 24~108h, the more Ca2+added in systems, the faster Fe2+oxidation rate and the higher total Fe precipitation efficiency. When Ca2+was added at 0, 50, 100, and 200mg/L, Fe2+oxidation efficiency reached 100% at 84h and the corresponding total Fe precipitation efficiency was 27.0%, 29.7%, 33.9%, and 36.9%, respectively. While a complete oxidation was achieved in the presence of 400mg/L Ca2+at 72h and total Fe precipitation efficiency reached up to 39.1 % at 108h. In this study, secondary iron minerals harvested from different systems were the mixture of schwertmannite and jarosite. The data obtained from this study will offer constructive meanings for understanding the secondary iron minerals bio-synthesis mechanism in the iron- and sulfate-rich acidic environment with Ca2+existing.
calcium ions;A.ferrooxidans;secondary iron minerals;Fe precipitation efficiency;mineral phase
X523
A
1000-6923(2015)04-1142-07
刘奋武(1984-),男,山西大同人,副教授,博士,主要从事固体废物处理、处置与资源化,酸性矿山废水治理等方面的研究.发表论文24篇.
2014-08-29
国家自然科学基金项目(41371476,21407102);山西农业大学博士科研启动基金项目(2012YJ06);山西农业大学科技创新基金项目(201301)
*责任作者, 教授, lxzhou@njau.edu.cn

