牡丹江中游底栖动物分布及其与栖境因子的关系
王皓冉,陈永灿,刘昭伟,朱德军,段亚飞 (清华大学,水沙科学与水利水电工程国家重点实验室,北京 100084)
牡丹江中游底栖动物分布及其与栖境因子的关系
王皓冉,陈永灿*,刘昭伟,朱德军,段亚飞 (清华大学,水沙科学与水利水电工程国家重点实验室,北京 100084)
2013年秋季对牡丹江中游的3条河流(牡丹江、蛤蟆河、卧龙溪)150km河段进行大型底栖动物野外采样,共采集到大型底栖动物18种,隶属于3门5纲11目16科,其中昆虫纲(Insecta)、腹足纲(Gastropoda)和寡毛纲(Oligochaeta)物种居多.通过典范对应分析(CCA),研究大型底栖动物群落结构与主要的栖息地环境因子之间的相关关系,并通过香农-威纳(Shannon-Wiener)指数等生物多样性指数分析评价河流等级对物种多样性的影响.研究表明,流速、溶解氧、底质中的砾石含量是牡丹江中游影响大型底栖动物分布的关键栖息地环境因子,河流等级对底栖动物群落结构有一定影响,牡丹江干流底栖动物物种多样性高于支流,平均生物密度低于支流,且河流间等级差距越大,差异越显著.
牡丹江;大型底栖动物;典范对应分析;栖息地环境因子;河流等级
大型底栖动物是生活在水体底部的水生无脊椎动物类群,它们对外界胁迫响应比较敏感,可通过摄食、产卵、掘穴等行为与周围栖息环境相互作用.在河流生态系统中,大型底栖动物处于食物链的中间环节,在物质交换和能量交换中起着重要作用[1-3].底栖动物作为指示物种在河流生态快速评价中有着一定优势,并越来越多的应用于水质监测和河流整体健康评价[4-6].近年来,我国一些学者在不同流域开展了底栖动物的调查研究工作,利用典范对应分析(CCA)等方法,分析论证了环境变量与底栖动物群落结构之间的相关关系[7-10],这些研究工作主要集中于水环境因子(如水化学因子、有机质等)对底栖动物的影响,对水动力条件、底质等其他栖息地环境因子的涉及较少.生态系统具有复杂性,不同流域中底栖生物群落与栖息地环境因子之间并没有普适的对应关系,需要针对研究区域的特征,进行特定的生态采样和栖息地环境因子调查,通过相关分析研究底栖生物群落与栖息环境的关系,为流域生态保护和生态修复提供支撑.
牡丹江是松花江第二大支流,发源于吉林省长白山牡丹岭的寒葱岭,流向由南向北,于依兰镇西入松花江.牡丹江干流全长721km,流域面积37654km2,河床比降大,河道天然落差1007m,平均比降为1.39‰,蕴含丰富的水力资源和渔业资源.牡丹江中游段从镜泊湖到牡丹江市区江段,是牡丹江市及沿岸城镇的生产和生活用水水源,并对松花江中下游水质和水生态有重要影响.因此,开展该江段大型底栖动物的调查,分析其与栖息地环境因子之间的关系,对牡丹江流域生态现状的研究和评价具有重要意义.
1 材料与方法
1.1 研究区域

图1 研究区域及各采样点平面布置Fig.1 Sketch of the study area and sampling sites
2013年10月,分别对牡丹江中游段及其两条支流进行大型底栖动物采样,共布置20个采样点,涵盖150km河段,基本反映牡丹江中段区域大型底栖动物的分布状况.
研究区域分为三部分:(1)牡丹江中游部分段,即从石岩电站下游至海浪河汇流口(牡丹江市)75km河段,结合水流特征和栖息地环境特点设计采样点,以保证样本的代表性,该河段共布置采样点12个,依次为平安、南牡丹、小牡丹、新中、依兰、宁安、长江、温春、共荣、黑山、大莫、海浪口等;(2)牡丹江中游段一级支流蛤蟆河,蛤蟆河为山溪性河流,河面宽度10~40m,选取与牡丹江交汇处上游65km河段,共布置采样点6个,依次为蛤蟆口、明星、新农、明泉、爱林、英山等;(3)牡丹江二级支流,蛤蟆河左岸的一条支流,取名为卧龙溪.卧龙溪河面宽度约2~4m,选取10km河段,布置卧龙和勤劳2个采样点.本研究的牡丹江中游段区域地理位置为44°04'41"N~44°33'20"N,129°15'34"E~129°36'01" E,研究区域及各采样点布置如图1.
1.2 采样方法
研究区域内河流水面较为开阔,水深较浅,选择岸边水流特征较为一致的浅流为采样区域,选用踢网(kick-net,尺寸为1m2)进行大型底栖动物的采集[11].采样面积对底栖动物物种数及多样性有影响,蛤蟆河和卧龙溪各采样点处大型底栖动物密度较大,采样面积选取1m2,牡丹江部分采样点进行多次采样,累积采样面积控制为1m2[12].将采集到的大型底栖动物活体放置于75%的酒精中进行固定,带回实验室进行分类、计数、称重和鉴定.依托体视显微镜,结合大型底栖动物图谱对物种进行鉴定,物种大部分鉴定至科,区分至尽可能低的分类单元[1].
现场记录采样点处的关键栖息地环境因子,如水深、流速、溶解氧、pH值、水温等,同时采集水样和底质样本.水深采用水深测杆进行测量,流速采用LS300便携式流速仪测量,溶解氧和温度采用Pro ODO进行测量, pH值采用CT-6023pH仪测定.为了减小测量误差,每个环境因子现场测量3~5次取平均值.将采集点处的河床底质进行收集,带回实验室进行烘干,按EPA标准将不同粒径的底质进行分离[13],对卵石(64mm~250mm)、粗砾石(16~64mm)、细砾石(2~16mm)、砂(0.06~2mm)等各组分进行称重,计算其质量占比.
1.3 数据分析
1.3.1 优势度及多样性指数 为了描述研究区域各河流的优势物种,引入优势度计算公式.采用香农-威纳(Shannon-Wiener)多样性指数,Margalef丰富度指数,Pielou均匀度指数等生物指标定量评价采样点处的生物多样性.各指数算式如下:
优势物种可用优势度计算公式度量,优势度根据大型底栖动物出现的频率及该物种个体数量进行计算, 优势度指数如下:

式中:Y为物种优势度; ni为采样中某类物种的数量; N为采样中总体物种的数量; fi为采样中某类物种的出现频率.当某类物种优势度Y > 0.02时,该物种即为优势种群[14-15].
香农-威纳(Shannon-Wiener)多样性指数:
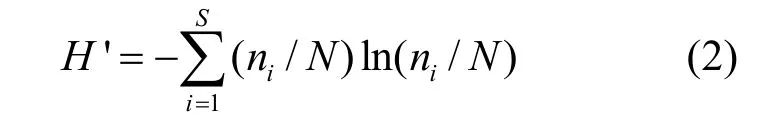
式中:S为采样区域内的底栖动物种类数,ni、N意义同前.香农-威纳指数越大,物种群落结构不确定性越大,物种多样性越高[16].
Margalef物种丰富度指数:

Margalef丰富度指数用于评价生物群落物种的丰富程度[17].
Pielou均匀度指数:
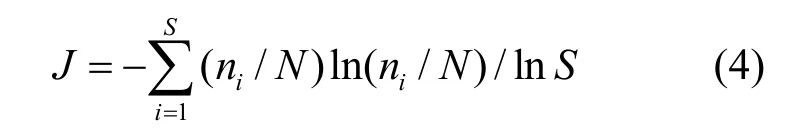
该式基于香农-威纳指数,Pielou均匀度指数可以用来评价一个群落样本中所有物种个体数的分配情况和均匀程度[18].
1.3.2 典范对应分析 典范对应分析(CCA)基于对应分析发展而来,是数量生态学中的一种重要的排序方法.典范对应分析把对应分析和多元回归结合起来,将每一步的计算结果与环境因子进行回归,用以研究物种与栖息地环境因子间的关系[19-21].典范对应分析要求两个数据矩阵,本研究以牡丹江中游段20个采样点处各类大型底栖动物的生物密度作为物种矩阵(20×17),以各采样点处的流速、水深、温度、底质(卵石、粗砾石、细砾石、砂质量占比)、pH值、溶解氧等主要栖息地环境因子作为环境因子矩阵(20×9).分析前,除pH值外,各类数据均进行log10(1+x)标准化处理.采用Canoco 4.5软件对物种数据和环境因子数据进行CCA分析,将分析生成的结果导入CanoDraw软件进行排序图的绘制.
2 结果与分析
2.1 物种群落特征

表1 各采样河段大型底栖动物分布情况Table 1 Species composition of benthic macroinvertebrates in three rivers
2.1.1 物种组成及优势种 研究区域3条河流共采集到大型底栖动物18属,隶属于3门5纲11 目16科,见表1.节肢动物(主要为昆虫纲)7目12 科12属,个数占采集总数的50.7%,环节动物2纲2科3属,占采集总数的30.2%,软体动物2纲2 科3属,占采集总数的19.1%.
在大型底栖动物类群组成上,牡丹江共采集大型底栖动物13科14属,包含了多数的水生昆虫,中游段优势种为霍甫水丝蚓Limnodrilus(Y =0.245),觿螺科Hydrobiidae(Y =0.204).
蛤蟆河各采样点共采集大型底栖动物7科8属,优势种为毛翅目中的纹石蛾科Hydropsychidae(Y=0.405),颤蚓科中的霍甫水丝蚓Limnodrilus(Y=0.262)以及鞘翅目中的长角泥甲科Elmidae(Y=0.056).
卧龙溪采样点共采集大型底栖动物6科6属,物种组成与蛤蟆河相近,其中优势显著的为纹石蛾科Hydropsychidae(Y=0.656),颤蚓科中的霍甫水丝蚓Limnodrilus(Y=0.196)以及扁蛭科中的泽蛭属Helobdella(Y=0.056).
2.1.2 群落结构及多样性 3条河流共采集到大型底栖动物1006个,以纲为标准对其进行分类,可分为昆虫纲(Insecta),寡毛纲(Oligochaeta),蛭纲(Hirudinea),腹足纲(Gastropoda),双壳纲(Bivalvia)五类.采样鉴定结果表明,不同河流间大型底栖动物的群落结构有显著差异,见图2.牡丹江干流各采样点共采集大型底栖动物386个,隶属于5纲,其中腹足纲(Gastropoda)和寡毛纲(Oligochaeta)物种数量最多,分别占总个体数的42%和37%,昆虫纲(Insecta)占18%,在个别采样点,也发现少量双壳纲(Bivalvia)和蛭纲(Hirudinea)物种.蛤蟆河共采集370个动物个体,未发现蛭纲(Hirudinea)和双壳纲(Bivalvia)物种,蛤蟆河水生昆虫丰度和多度较大,昆虫纲(Insecta)物种占绝对优势,数量为总个体数的71%,其余为寡毛纲(Oligochaeta)和腹足纲(Gastropoda)物种,分别占总数的26%和3%.卧龙溪支流共采集大型底栖动物250个,群落结构与蛤蟆河接近,其中,昆虫纲(Insecta)和腹足纲(Gastropoda)物种个数占比与蛤蟆河相当,寡毛纲(Oligochaeta)占20%,另6%为蛭纲(Hirudinea)物种.

图2 牡丹江中游区域大型底栖动物群落结构空间分布Fig.2 Spatial distribution of benthic macroinvertebrates community in three rivers

在群落结构的基础上,对各采样区域的生物多样性进行评价.物种丰度为采样区域内的底栖动物种类数,由于各河流布置的采样点数量不同,采样面积有较大差异,引入物种数-采样面积幂函数回归方程S=26A3(式中,S为丰度,A为采样面积)[12,22],将采样区域的总的物种丰度转化为单位面积等效丰度S.生物密度取多个采样点的平均密度.同时,以河段为研究对象,在统计物种出现频率和总个体数的基础上,计算香农-威纳(Shannon-Wiener)多样性指数,Margalef丰富度指数,Pielou均匀度指数等生物指数,见表2.

表2 各采样位置处的生物多样性指数分析结果Table 2 Biodiversity indices in three rivers
2.2 栖息地环境因子特征
采样河段主要栖息地环境因子见表3.各河段采样点处水深和流速均较小,属于浅流栖境[23],蛤蟆河与卧龙溪各采样点处流速相对较急,溶氧含量较牡丹江高,各处水温差异来自不同采样时段的气温变化.3条河流的河床底质均以卵砾石为主,级配均匀.

表3 各采样河段的主要栖息地环境因子Table 3 Main habitat factors in three rivers
2.3 物种群落与栖息地环境因子关系的CCA分析
根据物种的出现频率,选取其中的17种大型底栖动物与栖息地环境因子进行CCA分析,其中,大型底栖动物名称用缩写的前4个字母表示,采样点用图1中各采样点编号表示,物种-采样点关系见图3.在排序图中,物种与采样点之间的距离代表该采样点处目标物种的相对密度,距离越短密度值越大.
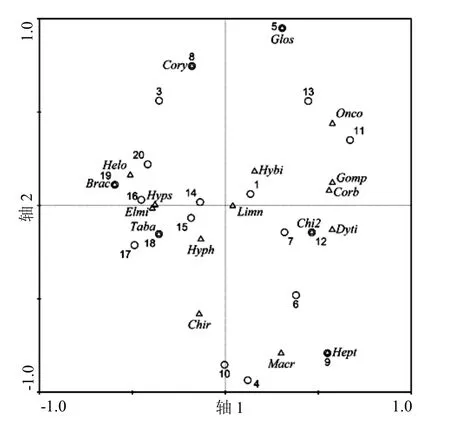
图3 CCA排序中物种-采样点关系Fig.3 Canonical correspondence analysis ordinations of species and sampling sites location
图4为牡丹江中游大型底栖动物种类与栖息地环境因子变量之间的二维排序.第一主轴和第二主轴的特征值分别为0.520、0.338,共解释了物种数据累积方差值的46.4%和物种-栖息地环境关系累积方差值的73.2%,表明两主轴能够有效反映主要栖息地环境因子对牡丹江中游段大型底栖动物的影响程度.栖息地环境因子第一主轴和第二主轴的相关系数为0,物种第一主轴和第二主轴的相关系数小于0.001(0.0008),分析结果可靠[24].根据栖息地环境因子箭头线的长度,得出对牡丹江中游大型底栖动物群落结构和分布有重要影响的栖息地环境因子,包括流速、溶氧、温度以及底质中粗砾石、细砾石的相对含量,其中,第一主轴与溶解氧(-0.8009)、流速(-0.7631)、温度(0.6898)、粗砾石含量(0.6462)呈现较强的相关性,基本反映了这4个栖息地环境因子的梯度变化,第二主轴与粗砾石含量(0.3853)、流速(0.2811)呈现正相关,与细砾石含量(-0.3363)、砂含量(-0.2811)呈现负相关,其他栖息地环境因子与主轴的相关系数较小,影响有限.

图4 牡丹江中游段各采样点主要栖息地环境因子与大型底栖动物的典范对应分析双轴图Fig.4 Canonical correspondence analysis ordinations of site macroinvertebrate community and habitat factors
二维排序图中不同大型底栖动物之间的距离为物种分布的卡方距离,远近代表其亲疏关系.根据卡方距离的长短以及物种与主要栖息地环境因子的相关关系,将采集到的大型底栖动物分为四组.组I包括纹石蛾科(Hydropsychidae)、长角泥甲科(Elmidae)等在内的7个物种,其中6种属于昆虫纲(Insecta),大部分物种与流速、溶解氧、细砂含量呈现正相关;组II主要为霍甫水丝蚓(Limnodrilus)、摇蚊亚科(Chironominae)、钉螺属(Oncomelania)在内的7个物种,这些物种与温度和粗砂含量呈现正相关;组III为鱼蛉科(Corydalidae)和扁蛭科(Glossiphoniidae),其与流速和粗砂含量正相关;组IV为扁蜉科(Heptageniidae)和大蜻科(Macromiidae),其与温度和细沙含量正相关.
3 讨论
3.1 大型底栖动物与关键栖息地环境因子的关系
大型底栖动物群落结构的形成是一系列外部环境因素相互作用的结果,根据研究尺度的不同,栖息地环境因子可归为3个层面:流域层面(例如整条河流);河段层面(例如浅滩和深潭);栖境斑块层面(例如水力参数和底质)[25].在栖境斑块的研究中,流速和水深被认为是水流条件中对底栖动物分布和行为影响最为显著的因素[26-29].采样点处多为浅流,水深一定,流速有一定的变化,CCA排序结果表明流速是影响牡丹江中游段大型底栖动物分布的主导因子,不同物种对流速的适宜性不同,蛤蟆河与卧龙溪支流采样点处水流较急,流速范围在0.45m/s到0.55m/s之间,短石蛾科(Brachycentridae)等优势物种的生物密度与流速之间存在很好的正相关关系,生物密度较大(29~86个/m2).牡丹江采样点处水流普遍较缓,流速范围在0.15m/s到0.36m/s之间,适合偏好缓流或静水的觿螺科(Hydrobiidae)物种栖息.各采样点处水深接近,分析受限.
底质是大型底栖动物成长、繁殖的载体,为底栖动物提供多样的栖息和避难场所.在水流条件相似的情况下,底质是影响河流大型底栖动物群落结构的关键栖息地环境因子[26].一些学者对底质粒径大小的生态影响的观点并不一致[30-31].本研究将卵石、粗砾石、细砾石、砂四类底质的相对含量作为栖息地环境因子与物种数据进行CCA分析,根据对底栖动物分布影响的重要性排序,得出粗砾石(GC)>细砾石(GF)>砂(SA)>卵石(CB),粗砾石含量和细砾石含量是影响这一区域底栖物种分布的关键因子,尽管不同种类的底栖动物可能对这两类底质的偏好不同.可以认为,相比于淤泥、细沙河床,砾石为主的河床稳定性更好,其适中的颗粒间隙也更适宜物种栖息.
水化学因素方面,各采样点处pH值接近,均为弱碱性水质.水温受太阳辐射和采样时段的影响,采样期间水温变化在6~11°C,该温度不适合喜温物种的生存.CCA分析表明,溶解氧是水化学因素中对大型底栖动物分布影响最为关键的因素.蛤蟆河和卧龙溪的溶解氧含量较牡丹江高,与I组的长角泥甲科(Elmidae)、水龟甲科(Hydrophilidae)、短石蛾科(Brachycentridae)、纹石蛾科(Hydropsychidae)等好氧物种生物密度呈现正相关,与II组的摇蚊亚科(Chironominae)、蚬科(Corbiculidae)、箭蜓(Gomphidae)等厌氧或耐低氧物种生物密度呈现负相关.此外,溶解氧含量与流速之间有较强的正相关性(相关系数为0.7656),较急水流带来较强的水流紊动,大大增加了水气交换,使水体中溶解氧含量升高.
研究表明,流速是河流中重要的水动力条件,对物种的群落结构和分布影响较大.砾石底质的稳定性和颗粒间隙有利于物种栖息.水化学因素中的溶解氧含量对多数大型底栖动物分布影响较大.以此为基础,研究底栖动物在一些关键栖息地环境因子变化下的生态响应,将是进一步研究的重点.
3.2 河流等级对底栖动物群落结构的影响
基于中观尺度,进一步探讨河流等级对大型底栖动物群落组成和分布的影响.图2给出牡丹江中游区域大型底栖动物群落结构空间分布,可以看出,不同等级河流间大型底栖动物的群落结构不同,牡丹江采集到的大型底栖动物个数接近80%的为寡毛纲(Oligochaeta)和腹足纲(Gastropoda),而蛤蟆河和卧龙溪71%的个体数为昆虫纲(Insecta).根据生物多样性指数,对三条河流的底栖生物多样性进行评价.物种丰度值可直观的反应生物多样性的大小,牡丹江采样点的等效丰度S(6.643)大于一级支流蛤蟆河(5.257)和二级支流卧龙溪(4.874),香农-威纳(Shannon-Wiener)多样性指数H'和Margalef丰富度指数dM的变化趋势与等效丰度S基本一致,牡丹江相应数值最大(H'=1.717, dM=2.183),二级支流卧龙溪相应数值偏小(H'=1.068, dM=0.906),总的来看,牡丹江底栖生物多样性最优,蛤蟆河次之,卧龙溪的生物多样性较差.河流等级对底栖动物多样性有影响,干流的生物多样性优于支流,这一结果与Covich A P[32], Bronmark C[33]等学者的研究结论基本一致.可以认为,干流能够为底栖物种提供较为丰富的栖息地条件,有利于维系较高的物种多样性,支流所覆盖的流域面积较小,栖息地种类有限,底栖动物群落多样性较低.
比较3条河流大型底栖动物的生物密度,牡丹江采集到的大型底栖动物个体数最少,平均生物密度值仅为32个/m2,约为蛤蟆河该数值(63 个/m2)的50%,接近二级支流卧龙溪平均生物密度(125个/m2)的25%,表明支流中大型底栖动物生物密度较干流高,物种的群落结构更为稳定.除了河流等级的影响,牡丹江水力资源开发程度较高,河流水质受河滨城市的生产生活影响较大,底质受频繁的河床采砂活动扰动,河滨植物覆盖不足等因素,也一定程度上导致了大型底栖动物的生物密度较低.
评价河流等级对底栖动物群落分布的影响,本质上可以认为是通过各关键的环境因子作用于物种的结果.河流大小不同,其水文情势、断面形态以及河床运动演变特性会有所不同,进而造成水流条件、水质、底质等栖息地环境因子的差异.
4 结论
4.1 秋季牡丹江中游共采集大型底栖动物18种,隶属于3门5纲11目16科,绝大多数为昆虫纲(Insecta)、腹足纲(Gastropoda)和寡毛纲(Oligochaeta)动物,其中,纹石蛾科(Hydropsychidae)、霍甫水丝蚓(Limnodrilus)、钉螺(Oncomelania)为牡丹江的优势物种.
4.2 综合考虑水流条件、底质组成、水质等多类环境变量,基于典范对应分析得出,水流速度、溶解氧浓度、砾石含量等是影响牡丹江中游段大型底栖动物群落结构的关键栖息地环境因子.
4.3 牡丹江流域不同等级的三条河流中,大型底栖动物群落组成和分布有所差异.干流的物种丰度最大、生物多样性最好,生物密度最低;而支流的生物密度较高,物种丰度较小,生物多样性较差.河流等级在一定程度上影响大型底栖动物的群落结构特性和物种多样性,且河流等级差别越大,这种差异性越显著.
4.4 不同类型的底栖动物对栖息地环境因子的适应性和响应并不相同,加强河流关键栖息地环境因子对水生生物生态效应的研究,保护栖息地的多样性对维持大型底栖动物生物多样性和河流生态系统整体性都有着重要意义.
[1]段学花,王兆印,徐梦珍.底栖动物与河流生态评价 [M]. 北京.清华大学出版社, 2010.
[2]Blocksom K A, Kurtenbach J P, Klemm D J, et al. Development and evaluation of the lake macroinvertebrate integrity index(LMII) for New Jersey lakes and reservoirs [J]. Environmental Monitoring and Assessment, 2002,77(3):311-333.
[3]廖一波,寿 鹿,曾江宁,等.三门湾大型底栖动物时空分布及其与环境因子的关系 [J]. 应用生态学报, 2011,22(9):2424-2430.
[4]Lenat D R, Barbour M T. Using benthic macroinvertebrate community structure for rapid, cost-effective, water quality monitoring: rapid bioassessment [M]. Biological monitoring of aquatic systems. Boca Raton, Florida: Lewis Publishers, 1994: 187-215.
[5]王伟莉,闫振广,何 丽,等.五种底栖动物对优控污染物的敏感性评价 [J]. 中国环境科学, 2013,33(10):1856-1862.
[6]Wang Z, Lee J H, Cheng D, et al. Benthic invertebrates investigation in the East River and habitat restoration strategies[J]. Journal of Hydro-Environment Research, 2008,2(1):19-27.
[7]汪 星,郑丙辉,刘录三,等.洞庭湖典型断面底栖动物组成及其与环境因子的相关分析 [J]. 中国环境科学, 2013,32(12):2237-2244.
[8]潘保柱,王海军,梁小民,等.长江故道底栖动物群落特征及资源衰退原因分析 [J]. 湖泊科学, 2008,20(6):806-813.
[9]秦春燕,张 勇,于海燕,等.不同类群水生昆虫群落间的一致性以及空间和环境因子的相对作用 [J]. 生物多样性, 2013,21(3): 326-333.
[10]蔡佳亮,苏 玉,文 航,等.滇池流域入湖河流丰水期大型底栖动物群落特征及其与水环境因子的关系 [J]. 环境科学, 2011, 32(4):982-989.
[11]王备新,杨莲芳,胡本进,等.应用底栖动物完整性指数B-IBI评价溪流健康 [J]. 生态学报, 2005,25(6):1481-1490.
[12]段学花,王兆印,程东升.典型河床底质组成中底栖动物群落及多样性 [J]. 生态学报, 2007,27(4):1664-1672.
[13]Kaufmann P R, Levine P, Peck D V, et al. Quantifying physical habitat in wadeable streams [M]. Environmental Monitoring and Assessment Program, National Health and Environmental Effects Research Laboratory, Office of Research and Development, US Environmental Protection Agency, 1999.
[14]陈亚瞿,胡方西.长江口河口锋区浮游动物生态研究I生物量及优势种的平面分布 [J]. 中国水产科学, 1995,2(1):49-58.
[15]郭蔚华,李楠,张智,等.嘉陵江出口段三类水体蓝绿硅藻优势种变化机理 [J]. 生态环境学报, 2009,18(1):51-56.
[16]Siiannon C E, Weaver W. The mathematical theory of communication [M]. Univ. Illinois, 1949.
[17]Margalef D R. Information theory in ecology [M]. Society for General Systems Research, 1958.
[18]Pielou E C. The measurement of diversity in different types of biological collections [J]. Journal of theoretical biology, 1966,13: 131-144.
[19]Ter Braak C J, Verdonschot P F. Canonical correspondence analysis and related multivariate methods in aquatic ecology [J]. Aquatic Sciences. 1995,57(3):255-289.
[20]Ter Braak C J. The analysis of vegetation-environment relationships by canonical correspondence analysis [M]. Theory and models in vegetation science, Springer, 1987:69-77.
[21]Ter Braak C J. Canonical correspondence analysis: a new eigenvector technique for multivariate direct gradient analysis [J]. Ecology, 1986,67(5):1167-1179.
[22]Arrhenius O. Species and area [J]. Journal of Ecology, 1921,9(1): 95-99.
[23]Stewart G, Anderson R, Wohl E. Two-dimensional modelling of habitat suitability as a function of discharge on two Colorado rivers [J]. River Research and Applications, 2005,21(10):1061-1074.
[24]TER Braak C. Atheory of gradient analysis [J]. Advance in Ecological Research, 1988,18:271-317.
[25]Bunn S E, Arthington A H. Basic principles and ecological consequences of altered flow regimes for aquatic biodiversity [J]. Environmental Management, 2002,30(4):492-507.
[26]Beisel J, Usseglio-Polatera P, Thomas S, et al. Stream community structure in relation to spatial variation: the influence of mesohabitat characteristics [J]. Hydrobiologia, 1998,389(1-3): 73-88.
[27]Jowett I G. Hydraulic constraints on habitat suitability for benthic invertebrates in gravel-bed rivers [J]. River Research and Applications, 2003,19(5/6):495-507.
[28]Jowett I G, Richardson J. Microhabitat preferences of benthic invertebrates in a New Zealand river and the development of in-stream flow-habitat models for Deleatidium spp [J]. New Zealand Journal of Marine and Freshwater Research, 1990,24(1): 19-30.
[29]Mérigoux S, Dolédec S. Hydraulic requirements of stream communities: a case study on invertebrates [J]. Freshwater Biology, 2004,49(5):600-613.
[30]Heino J. Lentic macroinvertebrate assemblage structure along gradients in spatial heterogeneity, habitat size and water chemistry [J]. Hydrobiologia, 2000,418(1):229-242.
[31]Erman D C, Erman N A. The response of stream macroinvertebrates to substrate size and heterogeneity [J]. Hydrobiologia, 1984,108(1):75-82.
[32]Covich A P. Geographical and historical comparisons of neotropical streams: biotic diversity and detrital processing in highly variable habitats [J]. Journal of the North American Benthological Society, 1988,7(4):361-386.
[33]Brönmark C, Herrmann J, Malmqvist B, et al. Animal community structure as a function of stream size [J]. Hydrobiologia, 1984, 112(1):73-79.
Correlation analysis of macroinvertebrate community and habitat factors in the middle reaches of Mudan River.
WANG Hao-ran, CHEN Yong-can*, LIU Zhao-wei, ZHU De-jun, DUAN Ya-fei (State Key Laboratory of Hydroscience and Engineering, Tsinghua University, Beijing 100084, China). China Environmental Science, 2015,35(4):1197~1204
In October 2013, a field investigation was done in 3rivers (Mudan River, Hama River and Wolong stream) in the middle reaches of Mudan River Basin. A total of 18benthic macroinvertebrates species were collected from 20samping sites, which belonged to 3phyla, 5classes, 11orders, 16families and were dominated by Insecta, Gastropoda, Oligochaeta. Canonical correspondence analysis (CCA) was further applied to reveal relationship between macroinvertebrate community and the main habitat factors in the sampling sites. Multiple biodiversity indices including Shannon-Wiener index were applied to assess the impact of river orders on the biodiversity. The study demonstrated that flow velocity,dissolved oxygen, gravel substrates were the most important habitat factors influencing the composition and distribution of macroinvertebrates across the sites, and river orders could also affect the macroinvertebrate community. The biodiversity of macroinvertebrates in Mudan River was higher than that in its tributaries, while the average density was lower than its tributaries. The significance of this principle was increased along with the river orders.
Mudan River;macroinvertebrate communities;canonical correspondence analysis;habitat factors;river orders
X524,X171
A
1000-6923(2015)04-1197-08
王皓冉(1988-),男,河南南阳人,博士研究生,主要研究方向为环境水力学、生态水力学.发表论文5篇.
2014-09-05
国家自然科学基金项目(51039002,51279078);国家水体污染控制与治理科技重大专项(2012ZX07201002);清华大学自主科研计划(20121088082)
* 责任作者, 教授, chenyc@mail.tsinghua.edu.cn

