常压干燥制备疏水性SiO2-玻璃纤维复合气凝胶及表征
余煜玺,吴晓云,伞海生
(1厦门大学 材料学院 材料科学与工程系 福建省特种先进材料重点实验室,福建 厦门361005;2厦门大学萨本栋微米纳米技术研究院,福建 厦门361005)
SiO2气凝胶是以SiO2粒子为基本单元,骨架和孔洞均可控的三维网络结构纳米多孔材料,其密度低至0.003g/cm3,孔隙率高达80%~99.8%,比表面积为800~1200m2/g[1,2]。特殊的结构使气凝胶广泛应用于催化、环保、药物释放、石油化工、节能建筑、航空航天等领域[3-5],但多孔结构也导致纯SiO2气凝胶的机械强度低、脆性大。实际应用中可通过复合纤维[6,7]、碳颗粒或碳纳米管[8,9]、环氧树脂[10]、聚乙烯颗粒[11]、硅酸钙石[12]等增强体来提高气凝胶的力学强度,其中玻璃纤维因具有强度高、韧性好、热稳定性优异及耐高温的性能,成为良好的增强体。
复合气凝胶的制备常采用超临界干燥工艺[13],该方法能防止湿凝胶的收缩,但对设备要求高,生成成本高且具有一定危险性。因此操作简单、安全性高的常压干燥工艺[14]日益受到关注。常压干燥时表面张力引起的毛细管力较大,易导致气凝胶结构的破裂,可通过增强湿凝胶的骨架结构,减小气液界面张力及增加疏水基团等方法改善,操作方法为延长老化时间,用表面张力小的液体进行溶剂置换,表面改性减少—OH的数量等。其中,共前驱体法[15]通过引入带有疏水基团的前驱体与反应物共同反应,形成疏水基团均匀分布的湿凝胶,有效减少了亲水—OH的数量,使气凝胶具有稳定的疏水性。
本工作以正硅酸乙酯(TEOS)和甲基三乙氧基硅烷(MTES)为复合硅源,玻璃纤维为增强体,采用常压干燥工艺,通过老化、溶剂置换以及表面改性等步骤,成功制备出具有机械强度的块状疏水性SiO2-玻璃纤维复合气凝胶。利用N2吸附脱附、扫描电镜、高分辨透射电镜、红外光谱、接触角、热重-差热分析及力学测试等手段表征复合气凝胶发现,该SiO2-玻璃纤维复合气凝胶具有良好的力学性能和优异的疏水性能。
1 实验
1.1 原料
正硅酸乙酯(TEOS),甲基三乙氧基硅烷(MTES),三甲基氯硅烷(TMCS),正己烷,乙醇(EtOH),浓盐酸和浓氨水均来自国药集团化学试剂有限公司,为分析纯试剂。玻璃纤维来自泰安白峪玻璃纤维制品有限公司,短切长度为6mm,单丝直径为11μm,容易分散。
1.2 SiO2-玻璃纤维复合气凝胶的制备
实验所用玻璃纤维先进行预处理,具体操作为:玻璃纤维浸泡在稀盐酸溶液中一段时间,取出后除去纤维表面的残留溶液,在110℃干燥24h,烘干备用。
取0.1g预处理后的玻璃纤维添加到含无水乙醇的塑料容器中搅拌分散。按TEOS∶MTES∶EtOH∶H2O(摩尔比)为1∶0.4∶10∶4加入原料,继续搅拌一段时间后,加入稀盐酸溶液并控制pH值在2~3之间。持续搅拌8~10h使硅源完全水解后,缓慢滴加氨水溶液,调节pH值到8左右。继续搅拌10min,倒入模具密封,室温下形成复合湿凝胶。将湿凝胶浸没在乙醇溶液中,在55℃老化2d增强湿凝胶的骨架强度。然后用一定体积配比的三甲基氯硅烷(TMCS)/EtOH/正己烷(n-Hexane)混合溶液,对湿凝胶进行疏水改性。当改性液下层出现淡黄色液体时,表示改性完成。取出凝胶,用正己烷清洗表面残留的有机物,放入程序控温箱中进行常压干燥。为防止凝胶开裂,操作时湿凝胶需完全浸没在正己烷中并密闭,并用分段升温的方法缓慢加热去除湿凝胶中的液体,得到SiO2-玻璃纤维复合气凝胶。升温程序:55℃保温3h,80℃保温4h,110℃保温5h,130℃保温2h,升温速率为1℃/min。
1.2 性能测试与表征
SiO2-玻璃纤维复合气凝胶的表观密度(ρ=m/V)通过质量除体积获得。样品在300℃下热处理3h后,用N2吸附脱附仪(BET,TRISTAR 3000)采集吸脱附曲线数据,获得比表面积,孔体积和孔径分布;用场发射扫描电子显微镜(SEM,LEO 1530)和高分辨透射电子显微镜(HRTEM,JEM 2100)表征气凝胶的微观形貌和孔隙结构;用傅里叶转换红外光谱仪(FT-IR,Avatar 360)测试气凝胶的化学基团,波数范围为400~4000cm-1;用接触角测量仪(Water contact angle,JC2000A)表征样品的宏观疏水性能。用热分析仪(TGDTA)对气凝胶进行热重-差热分析,测试条件为空气气氛,升温速率为10℃/min,由室温到700℃;用万能试验机(WDW-100)进行抗压测试,测试时样品尺寸为10mm×10mm×10mm,加载速率为1.5mm/min。
抗压强度:

弹性模量:

式中:σ0.1ε为抗压强度(本工作取10%应变);F为 压力;S为截面面积;E为弹性模量;σ为正向应力;ε为正向应变。
2 结果与讨论
2.1 玻璃纤维预处理条件对复合气凝胶密度的影响
预处理玻璃纤维时,盐酸浓度及浸泡时间对气凝胶的密度均有影响(图1,2)。控制浸泡时间为0.5h,从图1中可以看出,随着盐酸浓度的增大,复合气凝胶的密度逐渐下降,当盐酸浓度为2.5mol/L时,密度最低,为0.12g/cm3。因为盐酸与玻璃纤维表面的碱金属氧化物会发生反应生成可溶的碱金属盐,使得玻璃纤维表面出现大量的孔穴,同时形成Si-OH基团。溶胶形成后,链段将与Si-OH基团结合,增加玻璃纤维与SiO2溶胶的界面结合力。盐酸浓度较小时,反应形成的Si-OH基团少,纤维与凝胶的结合力较弱,干燥时容易发生结构收缩和坍塌,造成复合气凝胶的密度较大。随着盐酸浓度的增加,表面形成的Si-OH基团逐渐增多,两者的结合力逐渐增强,玻璃纤维对凝胶骨架的支撑作用能有效阻止凝胶的收缩,从而制备得到密度较小的复合气凝胶。但实验发现,当盐酸浓度大于2.5mol/L时,玻璃纤维结构将被破坏,强度降低,反而不利于发挥支撑作用。

图1 盐酸浓度对SiO2-玻璃纤维复合气凝胶密度的影响Fig.1 The effect of acid concentration on the density of SiO2-glass fibers aerogels
选取2.5mol/L的盐酸,如图2所示,随着浸泡时间的延长,复合气凝胶的密度呈上升趋势。时间越长,玻璃纤维结构被破坏越严重,支撑作用越差,干燥过程中凝胶收缩严重,密度越大。但时间过短时反应不完全,结合力弱,密度较大,因此实验中浸泡时间为0.5h效果最佳。

图2 浸泡时间对SiO2-玻璃纤维复合气凝胶密度的影响Fig.2 The effect of soaking time on the density of SiO2-glass fibers aerogels
2.2 N2吸附脱附等温线特征
图3是SiO2-玻璃纤维复合气凝胶与纯SiO2气凝胶的N2吸附脱附等温线图。可以看出,玻璃纤维的加入并未改变吸附脱附等温线的形状。根据国际纯粹与应用化学联合会(IUPAC)提出的物理吸附等温线分类,表现为典型的IV类介孔吸附脱附等温线,其等温线的吸附分支与等温线的脱附分支不一致,可以观察到迟滞回线,有明显的H2滞后环[16]。该类型的吸脱附曲线表明,复合气凝胶结构中含有明显的介孔结构,大部分孔道为两端开口的管状毛细孔结构。进一步研究两条曲线发现,SiO2-玻璃纤维复合气凝胶较纯SiO2气凝胶的N2相对吸附体积大,孔径范围也更大。这是由于玻璃纤维对凝胶骨架起到了支撑作用,凝胶收缩少,孔隙率增加,吸附体积也随之增大。

图3 纯SiO2气凝胶和SiO2-玻璃纤维复合气凝胶的N2吸附脱附等温线Fig.3 Nitrogen adsorption/desorption isotherms of SiO2aerogels and SiO2-glass fibers aerogels
图4是通过BJH方法计算得到的SiO2-玻璃纤维复合气凝胶与纯SiO2气凝胶的孔径分布图。可知,玻璃纤维的加入并未改变气凝胶的孔径分布,复合气凝胶的孔径主要分布在2~50nm,整体相较纯气凝胶的孔径和孔体积大。

图4 纯SiO2气凝胶和SiO2-玻璃纤维复合气凝胶的孔径分布Fig.4 Pore size distributions of SiO2aerogels and SiO2-glass fibers aerogels
2.3 表面形貌和微观结构
图5是SiO2-玻璃纤维复合气凝胶的扫描电镜图。SiO2气凝胶填充在纤维空隙中,并且紧紧附在纤维表面。由右上角的放大照片发现,SiO2气凝胶呈纳米多孔的三维网络状结构,骨架为SiO2颗粒,骨架之间充满孔隙。SiO2气凝胶的粒径主要分布在5~15nm,颗粒之间有团聚现象。孔径大小主要分布在2~50nm,与BET结果一致。图6是SiO2-玻璃纤维复合气凝胶的透射电镜照片。可知,玻璃纤维表面附有气凝胶,高倍放大(右下角图)观察发现,纤维表面的气凝胶结构相互交联,并扩展到整个机体中,形成三维网络结构,这与扫描电镜结果相符。

图5 SiO2-玻璃纤维复合气凝胶的扫描电镜图Fig.5 SEM images of SiO2-glass fibers aerogels

图6 SiO2-玻璃纤维复合气凝胶的透射电镜图Fig.6 HRTEM images of SiO2-glass fibers aerogels
2.4 红外分析及其疏水性能
图7是SiO2-玻璃纤维复合气凝胶的红外光谱图。在4000~400cm-1波数范围内,FTIR图谱显示了疏水气凝胶的相应基团。反应物经过水解和缩聚反应生成Si-O-Si键,硅原子通过Si-O-Si的形式形成开阔的三维网络结构,构成了气凝胶的骨架结构,表现为在1075,799,452cm-1处出现Si-O-Si的反对称伸缩振动峰、对称伸缩振动和摇摆振动特征峰。在3463,953cm-1处的吸收峰分别为-OH的反对称伸缩振动和Si-OH的摇摆振动特征峰,表明气凝胶中还含有未反应的-OH基团,而1628cm-1附近HOH的弯曲振动峰则是由于吸附水的存在。2963,2898cm-1和847cm-1处对应C-H的对称伸缩振动,不对称伸缩振动和弯曲振动峰。在1276cm-1处存在Si—CH3基团振动引起的吸收峰[17],1255,867cm-1和754cm-1处存在由Si—(CH3)3基团振动引起的吸收峰,疏水基团的存在从本质上解释了气凝胶优异的疏水性[18]。用静态座滴法测试气凝胶的疏水角度(图8),测出水滴的接触角为142°。表明常压干燥制备的复合气凝胶表面具有很好的疏水性,与FTIR图谱中—CH3疏水基团的存在相符合。

图7 纯SiO2气凝胶和SiO2-玻璃纤维复合气凝胶的红外光谱图Fig.7 FTIR spectra of SiO2aerogels and SiO2-glass fibers aerogels

图8 SiO2-玻璃纤维复合气凝胶的疏水角度Fig.8 Water contact angle of SiO2-glass fibers aerogels
2.5 热稳定性
图9为SiO2-玻璃纤维复合气凝胶的TG-DTA曲线。可知,230℃之前,气凝胶的失重很小,主要是水和乙醇等物质的挥发,而在230~600℃之间存在约12%的质量损失,对应此温度段的DTA曲线发现有四个明显的放热峰,原因在于气凝胶中的有机基团高温下发生氧化反应。275℃附近放热峰是由TEOS中未完全反应的—OC2H5基团被氧化引起的,其氧化形成的Si-OH可缩水反应形成Si-O-Si骨架。390℃附近对应放热峰是由于残留在孔洞结构中的极少量无水乙醇被氧化放出的热量。330℃的放热峰是由于Si—(CH3)3基团的氧化,而500℃的放热峰则是由Si-CH3基团的氧化。造成氧化峰位不同是因为Si基上带有的—CH3基团数量不同,也有文献研究表明可能与基团在气凝胶中的结构有关[19-21]。因此,SiO2-玻璃纤维复合气凝胶具有较高的耐热温度。

图9 SiO2-玻璃纤维复合气凝胶的TG-DTA曲线Fig.9 TG-DTA curves of SiO2-glass fibers aerogels
2.6 力学性能
图10为SiO2-玻璃纤维复合气凝胶的压应力-应变曲线图。该复合气凝胶为加入0.1g玻璃纤维(2.5mol/L盐酸,0.5h)制备得到的,其密度为0.12g/cm3。气凝胶的压缩过程分为三个阶段:第1阶段的应变在0~0.1mm/mm,此时的应力较小,应力随应变呈线性变化,该阶段的气凝胶在复合材料中所占体积大,起到主要的承载作用,且骨架发生弹性形变。第2阶段的应变大于0.1mm/mm,随应变的增大应力迅速上升,曲线斜率增大,这一阶段的气凝胶与玻璃纤维共同起到承载作用,气凝胶逐渐被压碎,纤维与气凝胶被不断压实。第3阶段的气凝胶多孔结构彻底坍塌,应力急速下降。通过计算得到复合气凝胶的抗压强度(取10%应变)约为0.05MPa,弹性模量为0.5MPa,其力学性能明显高于纯SiO2气凝胶的力学性能(抗压强度约为0.018MPa)[22]。
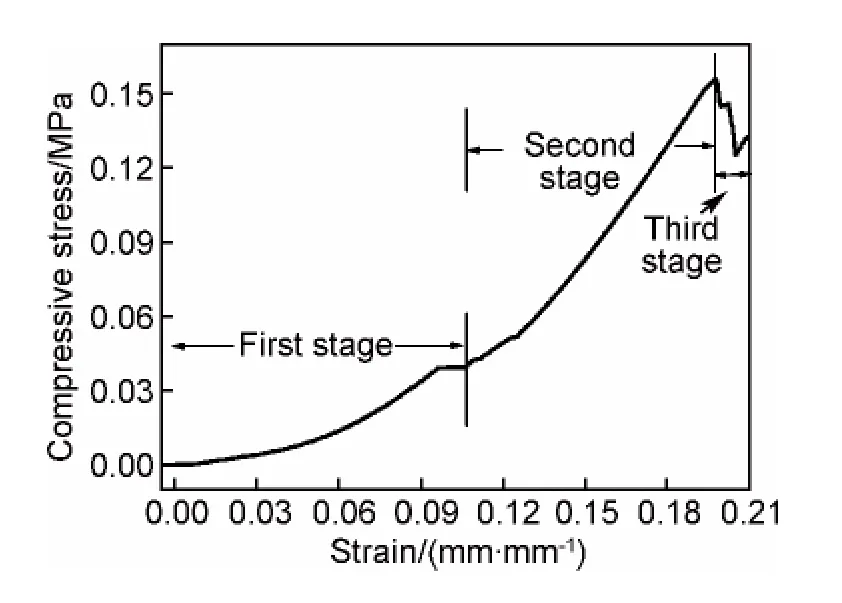
图10 SiO2-玻璃纤维复合气凝胶的压应力-应变曲线Fig.10 Compressive stress-strain curve of SiO2-glass fibers aerogels
3 结论
(1)正硅酸乙酯(TEOS)和甲基三乙氧基硅烷(MTES)为复合硅源,引入疏水基团—CH3,玻璃纤维为增强体,采用溶胶-凝胶法,常压干燥工艺成功制备出疏水SiO2-玻璃纤维复合气凝胶,其疏水角为142°,热稳定性高达500℃。
(2)用2.5mol/L 盐酸浸泡玻璃纤维0.5h后,制备得到的复合气凝胶表观密度最低,为0.12g/cm3,具有三维连续网络独特结构,孔径主要分布在2~50nm,比纯SiO2气凝胶的孔径大。玻璃纤维增强体使复合气凝胶的力学性能提高,测得样品的抗压强度为0.05MPa,弹性模量为0.5MPa。
[1]HUSING N,SCHUBERT U.Aerogels-airy materials:chemistry,structure,and properties[J].Angewandte Chemie International Edition,1998,37(1-2):22-45.
[2]SOLEIMAN D A,ABBASI M H.Silica aerogel;synthesis,properties and characterization[J].Journal of Materials Processing Technology,2008,199(1-3):10-26.
[3]FRICKE J,EMMERLING A.Aerogels-recent progress in production techniques and novel applications[J].Journal of Sol-Gel Science and Technology,1998,13(1-3):299-303.
[4]PAJONK G M.Some applications of silica aerogels[J].Colloid and Polymer Science,2003,281(7):637-651.
[5]SCHMIDT M,SCHWERTFEGER F.Applications for silica aerogel products[J].Journal of Non-Crystalline Solids,1998,225:364-368.
[6]KIM C Y,LEE J K,KIM B I.Synthesis and pore analysis of aerogel-glass fiber composites by ambient drying method [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2008,313:179-182.
[7]高庆福,冯坚,张长瑞,等.陶瓷纤维增强氧化硅气凝胶隔热复合材料的力学性能[J].硅酸盐学报,2009,37(1):40-44.GAO Q F,FENG J,ZHANG C R,et al.Mechanical properties of ceramic fiber-reinforced silica aerogel insulation composites[J].Journal of the Chinese Ceramic Society,2009,37(1):40-44.
[8]MONER G M,MARTINEZ E,ESTEVE J,et al.Micromechanical properties of carbon-silica aerogel composites[J].Applied Physics A,2002,74(1):119-122.
[9]张贺新,赫晓东,李垚.碳纳米管掺杂SiO2气凝胶隔热材料的制备与性能表征[J].稀有金属材料与工程,2007,36(增刊1):567-569.ZHANG H X,HE X D,LI Y.Synthesis and characterization of SiO2thermal insulation aerogel doped CNTs[J].Rare Metal Materials and Engineering,2007,36(Suppl 1):567-569.
[10]GUPTA N,RICCI W.Processing and compressive properties of aerogel/epoxy composites[J].Journal of Materials Processing Technology,2008,198(1):178-182.
[11]KIM G S,HYUN S H.Effect of mixing on thermal and mechanical properties of aerogel-PVB composites[J].Journal of Materials Science,2003,38(9):1961-1966.
[12]杨海龙,倪文,孙陈诚,等.硅酸钙复合纳米孔超级绝热板材的研制[J].宇航材料工艺,2006,36(2):18-22.YANG H L,NI W,SUN C C,et al.Development of xonotlitesilica aerogel nanoporous super insulation sheets[J].Aerospace Materials & Technology,2006,36(2):18-22.
[13]冯坚,高庆福,冯军宗,等.纤维增强SiO2气凝胶隔热复合材料的制备及其性能[J].国防科技大学学报,2010,32(1):40-44.FENG J,GAO Q F,FENG J Z,et al.Preparation and properties of fiber reinforced SiO2aerogel insulation composites[J].Journal of National University of Defense Technology,2010,32(1):40-44.
[14]吕鹏鹏,赵海雷,刘欣,等.常压干燥制备SiO2气凝胶的研究[J].材料工程,2012,(4):22-26.LU P P,ZHAO H L,LIU X,et al.Preparation of silica aerogel via ambient pressure drying[J].Journal of Materials Engineering,2012,(4):22-26.
[15]RAO A V,KALESH R R.Organic surface modification of TEOS based silica aerogels synthesized by co-precursor and derivatization methods[J].Journal of Sol-Gel Science and Technology,2004,30(3):141-147.
[16]YASUKI K,KAZUKI N,AKIRA M,et al.Synthesis of monolithic hierarchically porous iron-based xerogels from iron(III)salts via an epoxide-mediated sol-gel process[J].Chemistry of Materials,2012,24(11):2071-2077.
[17]VENKATESWARA R A,KULKAMI M M,AMALNERKAR D P,et al.Superhydrophobic silica aerogels based on methyltrimethoxysilane precursor[J].Journal of Non-Crystalline Solids,2003,330(1):187-195.
[18]JEONG A Y,KOO S M,KIM D P.Characterization of hydrophobic SiO2powders prepared by surface modification on wet gel[J].Journal of Sol-Gel Science and Technology,2000,19(1-3):483-487.
[19]LEE C J,KIM G S,HYUN S H.Synthesis of silica aerogels from waterglass via new modified ambient drying[J].Journal of Materials Science,2002,37(11):2237-2241.
[20]RAO A P,RAO A V,BANGI U K H.Low thermalconductive,transparent and hydrophobic ambient pressure dried silica aerogels with various preparation conditions using sodium silicate solutions[J].Journal of Sol-Gel Science and Technology,2008,47(1):85-94.
[21]RAO A V,KALESH R R.Organic surface modification of TEOS based silica aerogels synthesized by co-precursor and derivatization methods[J].Journal of Sol-Gel Science and Technology,2004,30(3):141-147.
[22]DENG Z S,WANG J,WU A M,et al.High strength SiO2aerogel insulation[J].J Non-Cryst Solids,1998,255:101-104.

