HPV16相关宫颈癌细胞系和组织中E7和DRR1蛋白的表达*
王 虹,李 娜,付琳琳,吴 余,田明振,李 航,冯思佳,杨 璐,赵二趁,千新来
新乡医学院病理学教研室新乡453003
宫颈癌是女性常见的恶性肿瘤之一,约80%是鳞状细胞癌[1]。世界范围内每年有50 万新增宫颈癌病例,死亡27.4 万例[2]。人乳头瘤病毒(human papilloma viruses,HPVs)感染是引起宫颈癌和癌前病变的主要原因[3],在15个高危HPVs 中,HPV16是目前最主要的类型[4]。早起基因E7 编码的E7蛋白持续表达是高危HPVs 致癌的关键,其可通过结合并降解pRb 蛋白等,导致细胞异常增殖[5]。人肾细胞癌下调基因1(down-regulated in renal cell carcinoma 1,DRR1)定位于染色体的3p21.1,其蛋白产物广泛表达于正常组织,但在许多癌细胞系和原发性肿瘤组织中表达明显降低,如肾细胞癌、宫颈癌、卵巢癌、胃癌、非小细胞肺癌等[6]。DRR1 作为肿瘤抑制基因可能在细胞癌变过程中发挥重要作用[7]。该研究从细胞和组织水平检测DRR1 表达与E7 表达的关系,试图为HPV16 相关宫颈癌的治疗提供新的线索。
1 材料与方法
1.1 材料
1.1.1 细胞系及培养条件 HPV16 阳性的宫颈癌CaSki 细胞和SiHa 细胞,以及HPV16 阴性的宫颈癌C-33A 细胞均购自中科院上海细胞库。培养条件:高糖DMEM 培养基(美国Invitrogen 公司),内含体积分数10%胎牛血清、100 U/mL 青霉素和100 mg/L 链霉素,于37℃、体积分数5%CO2孵箱中培养。
1.1.2 宫颈癌标本的收集与处理 从新乡市第一人民医院和新乡医学院第三附属医院收集宫颈鳞状细胞癌组织标本,共184例,每例标本常规制备石蜡切片3 张,1 张用于HE 染色以进一步确诊,其余2张用于HPV16 E7 和DRR1 蛋白的检测。
1.1.3 主要试剂及仪器 鼠抗人β-actin 单克隆抗体、鼠抗人HPV16 E7 单克隆抗体、ECL 试剂盒和辣根酶标记的兔抗鼠二抗购自美国Santa Cruz 公司,鼠抗人DRR1 单克隆抗体为武汉博士德生物工程有限公司产品。通用型PV9000 二步法免疫组化检测试剂盒购自美国Zymed 公司。超净工作台(SW-CJ-1F)购自苏州净化设备有限公司,倒置显微镜(TE2000-U)购自日本Nikon 公司,半干转膜仪(TE-70)购自美国Amersham Biosciences 公司,微波炉购自广东格兰仕公司。
1.2 宫颈癌细胞中HPV16 E7 和DRR1 蛋白的检测 采用Western blot 方法检测。收集CaSki、SiHa和C-33A 细胞,提取细胞总蛋白,按Bradford 方法进行定量,变性处理后进行SDS-PAGE 和转膜,50 g/L脱脂牛奶室温封闭2 h,一抗室温摇育2 h,二抗室温摇育2 h,按照ECL 试剂盒操作步骤进行显色、曝光,最后显影、定影、扫描。以β-actin 为内参照。蛋白上样量均为150 μg,鼠抗人β-actin 单克隆抗体、鼠抗人HPV16 E7 单克隆抗体、鼠抗人DRR1 单克隆抗体、辣根酶标记的兔抗鼠二抗的稀释倍数分别为1 000、300、500 和5 000。采用Bandscan 5.0 软件分析,以目的条带与内参条带灰度值的比值表示目的蛋白的表达水平。
1.3 宫颈鳞状细胞癌组织中HPV16 E7 和DRR1蛋白的检测 采用免疫组化染色法检测。石蜡切片用二甲苯脱蜡,梯度乙醇水化后,于微波炉中进行抗原修复。体积分数3%H2O2中室温封闭20 min,山羊血清室温封闭20 min。滴加稀释好的一抗(HPV16 E7 和DRR1 一抗稀释倍数均为50),4℃孵育过夜。滴加通用型IgG 抗体-辣根过氧化物酶多聚体,室温孵育30 min。DAB 显色,苏木素复染,脱水、透明、封片。以PBS 代替一抗作为阴性对照。HPV16 E7 和DRR1 蛋白主要定位于细胞核,阳性信号呈棕黄色颗粒样着色。高倍镜下选取5个视野进行观察:①按阳性细胞百分比计分,<30%、30%~70%及>70%各记为1、2 和3 分。②按切片中细胞着色深浅评分,无着色和浅黄色、棕黄色、棕褐色着色各记为0 分和1、2、3 分。取两项评分之和作为总积分,总积分0~1 分为阴性,≥2 分为阳性。
1.4 统计学处理 使用SPSS 16.0 进行分析。3种细胞中DRR1 蛋白表达的比较采用单因素方差分析及LSD-t 检验;宫颈鳞状细胞癌组织中DRR1 和HPV16 E7 蛋白表达的分析采用χ2检验;检验水准α=0.05。
2 结果
2.1 宫颈癌细胞中HPV16 E7 和DRR1 蛋白的表达 见图1、表1。C-33A 细胞中未见HPV16 E7 蛋白表达,CaSki 和SiHa 细胞中可见HPV16 E7 蛋白表达。C-33A 细胞中DRR1 蛋白表达显著高于CaSki和SiHa 细胞,CaSki 细胞和SiHa 细胞中DRR1 蛋白的表达差异无统计学意义。

图1 宫颈癌细胞中HPV16 E7(上)和DRR1(下)蛋白的表达

表1 宫颈癌细胞中DRR1 蛋白的表达
2.2 宫颈鳞状细胞癌组织中HPV16 E7 和DRR1蛋白的表达 宫颈鳞状细胞癌组织184例,其中HPV16 E7 阳性141例,阴性43例(图2)。HPV16 E7 阳性宫颈鳞状细胞癌组织中DRR1 蛋白的表达显著低于HPV16 E7 阴性组织,见图2、表2。
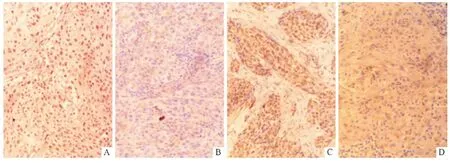
图2 宫颈鳞状细胞癌组织中HPV16 E7 和DRR1 蛋白的表达(SP,×400)

表2 宫颈鳞状细胞癌组织中HPV16 E7 和DRR1 蛋白的表达例
3 讨论
高危型HPVs 感染是宫颈癌的主要病因,全球超过一半的病例由HPV16 感染引起[8]。高危型HPVs 的早起基因E7 表达的E7 蛋白可直接使pRb失活,因此,E7 是强有力的细胞增殖诱导者,其可显著降低基因组的稳定性,使宿主细胞倾向于向肿瘤发展,E7 被认为是宫颈癌诊断和治疗的靶点[9]。目前尚没有可用于HPVs 相关疾病治疗的有效方法[10],宫颈癌治疗多采用综合治疗方案。因此,深入研究HPV16 的致癌机制对探索HPV16 相关肿瘤新的治疗方法具有重要意义。
人DRR1 基因最初由Yamato 等克隆得到,用突变型DRR1 转染肾细胞癌和其他肿瘤细胞系可以抑制细胞增殖。DRR1 的再表达可抑制癌细胞的生长并诱导细胞凋亡[11]。转染该基因到DRR1 阴性的癌细胞系中可观察到明显的细胞生长阻滞[12]。因此,DRR1 作为肿瘤抑制基因可能在癌变过程中发挥重要作用。
该研究中,Western blot 结果显示:C-33A 细胞不表达HPV16 E7 蛋白,其DRR1 的表达显著高于CaSki 细胞和SiHa 细胞;CaSki 细胞和SiHa 细胞表达HPV16 E7 蛋白,二者DRR1 蛋白的表达差异无统计学意义。免疫组化结果显示:HPV16 E7 蛋白阳性的宫颈鳞状细胞癌组织中DRR1 蛋白的表达显著低于HPV16 E7 阴性组织。上述结果说明无论是宫颈癌细胞系还是宫颈癌组织,E7 与DRR1 的表达均呈负相关。据此初步推测,在宫颈癌发生发展过程中,HPV16 E7 可能通过直接或间接抑制DRR1 的表达而发挥其致癌作用,关于E7 与DRR1 具体的相互作用机制还有待进一步研究。
综上所述,DRR1 可能是HPV16 E7 作用的潜在靶基因,在宫颈癌的发生发展中起重要作用,在HPVs 相关肿瘤的治疗上可能有广泛的应用前景。
[1]Oh EK,Kim YW,Kim IW,et al.Differential DNA copy number aberrations in the progression of cervical lesions to invasive cervical carcinoma[J].Int J Oncol,2012,41(6):2038
[2]Haedicke J,Iftner T.Human papillomaviruses and cancer[J].Radiother Oncol,2013,108(3):397
[3]Han KT,Sin JI.DNA vaccines targeting human papillomavirus-associated diseases:progresses in animal and clinical studies[J].Clin Exp Vaccine Res,2013,2(2):106
[4]Shukla S,Mahata S,Shishodia G,et al.Functional regulatory role of STAT3 in HPV16-mediated cervical carcinogenesis[J].PLoS One,2013,8(7):e67849
[5]Pang CL,Thierry F.Human papillomavirus proteins as prospective therapeutic targets[J].Microb Pathog,2013,58:55
[6]Zhao XY,Li HX,Liang SF,et al.Soluble expression of human DRR1(down-regulated in renal cell carcinoma 1)in Escherichia coli and preparation of its polyclonal antibodies[J].Biotechnol Appl Biochem,2008,49(Pt1):17
[7]Asano Y,Kishida S,Mu P,et al.DRR1 is expressed in the developing nervous system and downregulated during neuroblastoma carcinogenesis[J].Biochem Biophys Res Commun,2010,394(3):829
[8]Xu B,Chotewutmontri S,Wolf S,et al.Multiplex identification of human papillomavirus 16 DNA integration sites in cervical carcinomas[J].PLoS One,2013,8(6):e66693
[9]Dipaolo JA,Alvarez-Salas LM.Advances in the development of therapeutic nucleic acids against cervical cancer[J].Expert Opin Biol Ther,2004,4(8):1251
[10]Asiaf A,Ahmad ST,Mohammad SO,et al.Review of the current knowledge on the epidemiology,pathogenesis,and prevention of human papillomavirus infection[J].Eur J Cancer Prev,2014,23(3):206
[11]Nakajima H,Ishigaki Y,Xia QS,et al.Induction of HITS,a newly identified family with sequence similarity 107 protein (FAM107B),in cancer cells by heat shock stimulation[J].Int J Oncol,2010,37(3):583
[12]Wang L,Darling J,Zhang JS,et al.Loss of expression of the DRR 1 gene at chromosomal segment 3p21.1 in renal cell carcinoma[J].Genes Chromosomes Cancer,2000,27(1):1

