早产大鼠宫内感染肺损伤时支气管肺泡灌洗液及肺组织中脂肪型脂肪酸结合蛋白的表达*
王 伟,蔡丽霞,崔志瑞,罗向阳
郑州大学第三附属医院儿科郑州450052
△女,1973年10月生,博士,副教授,研究方向:新生儿及儿童遗传代谢内分泌,E-mail:weiwang169@126.com
新型支气管肺发育不良(bronchopulmonary dysplasia,BPD)是常见于早产儿的一种呼吸系统疾病,近年来其发病率呈逐渐上升的趋势。宫内感染引起肺微血管发育障碍,肺泡合成受阻可能是其发生发展的重要原因[1-2],但其发病机制目前不清。血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是目前已知最有效的调控肺微血管生成和发育的血管生成素蛋白[3]。课题组前期研究[4-5]发现宫内炎性暴露可引起肺组织VEGF 及其受体表达减少,肺组织细胞增殖受抑制,发生类似BPD 的病理改变。新近研究[6]发现脂肪型脂肪酸结合蛋白(fatty acid binding protein 4,FABP4)是调节肺巨噬细胞活性的重要因子,同时又为VEGF 基因下游因子,其表达受VEGF 调控。该实验对孕15 d SD 大鼠进行脂多糖(LPS)羊膜腔内注射,观察宫内感染肺损伤时支气管肺泡灌洗液(BALF)及肺组织中FABP4 的表达,探讨炎症对肺微血管发育及重塑的影响及与BPD 发生发展的关系。
1 材料与方法
1.1 主要材料 健康SD 大鼠由河南省实验动物中心提供。LPS 购于美国Sigma 公司。FABP4 ELISA 检测试剂盒购自美国R&D 公司,总RNA 提取试剂(商品名Trizol)购于美国Gibco 公司。小鼠抗FABP4 单克隆抗体购于美国Santa Cruz 公司。随机引物、M-MLV 逆转录酶、RNA 酶抑制剂及Taq DNA 聚合酶购于美国Promega 公司。FABP4 引物(表1)由上海英骏公司合成。
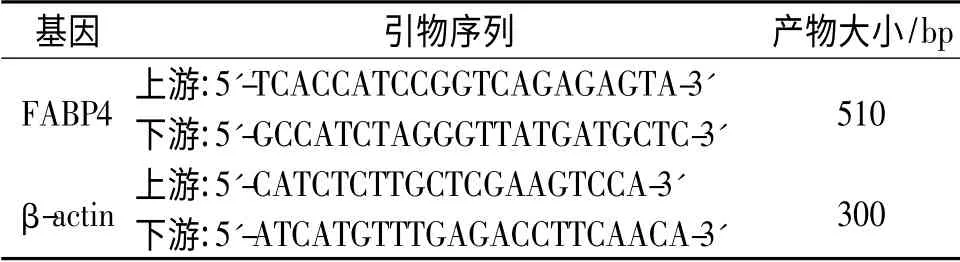
表1 PCR 引物序列及扩增产物大小
1.2 动物模型的制备及分组 参照课题组前期实验方法[4-5]。选择定期受孕的SD 大鼠,采用随机数字表法分成2组:LPS组和对照组,于孕15 d 打开孕鼠腹腔,用微量加样器将LPS(40 g/L)注射于羊膜腔内,每个孕囊5 μL。对照组注入等体积生理盐水。早产鼠于孕21 d(预产期为22 d)剖宫娩出,由当日分娩的母鼠作其代母鼠。2组大鼠均于不同时间点即:出生后第1天(P1)、第4天(P4)及第7天(P7)各取8只,以质量分数为20%乌拉坦0.5 mL腹腔麻醉,气管插管保持肺充气状态,开胸放血,右支气管结扎,迅速切取右肺,用4℃无菌生理盐水对左肺行肺泡灌洗(2.5 mL×3次),回收率>85%,将BALF 在4℃条件下以4 000 r/min 离心10 min,取上清,保存在-80℃冰箱中待测。
1.3 BALF 中FABP4 含量测定 采用ELISA 法检测BALF 中FABP4 含量,严格按说明书进行操作。
1.4 免疫组化法检测肺组织中FABP4 蛋白的表达采用SP 法。石蜡切片常规脱蜡至水,抗原修复,体积分数为3% H2O2阻断内源性过氧化物酶,正常山羊血清封闭,滴加一抗,4℃过夜,0.01 mol/L PBS充分洗涤后加入生物素标记的羊抗兔IgG,37℃孵育30 min,加入辣根过氧化物酶标记的链霉卵白素(37℃30 min),DAB 显色,复染封片,镜下观察。结果判定以细胞质内有棕黄色颗粒沉着为阳性细胞。阴性对照为0.01 mol/L PBS 代替一抗。FABP4抗体稀释度均为1 ∶100。每张切片于光镜下(×200)选取5个视野,固定窗口面积,利用HMIAS-2000 高清晰度彩色医学图文分析系统测定吸光度(A)值,以表示FABP4 蛋白的相对表达量。
1.5 RT-PCR 检测肺组织中FABP4 mRNA 的表达 采用Trizol 试剂提取总RNA,逆转录为cDNA,以此为模板行PCR 扩增。PCR 反应条件:94.0℃预变性5 min;94.0℃变性45 s,72.0℃延伸1 min,53.6℃退火45 s,反应32个循环;最后72.0℃延伸7 min。然后用15 g/L 琼脂糖凝胶电泳30 min。采用MUVB220 凝胶分析系统(美国Ultralum 公司)对扩增产物进行分析,分别测定各条带A 值,以目的基因条带与内参β-actin 条带A 值的比值作为FABP4 mRNA 的相对表达量。
1.6 统计学处理 采用SPSS 17.0 进行数据分析,2组BALF 中FABP4 含量、肺组织中FABP4 蛋白及mRNA 相对表达量的比较采用2 ×3 析因设计的方差分析,检验水准α=0.05。
2 结果
2.1 2组早产大鼠BALF 中FABP4 含量的变化结果见表2。

表2 2组早产大鼠BALF中FABP4 含量的变化(n=8) ng/L
2.2 2组早产大鼠肺组织中FABP4 蛋白的表达FABP4 主要表达在肺巨噬细胞、支气管上皮细胞和血管内皮细胞。结果见图1、表3。

图1 不同时间点2组早产大鼠肺组织中FABP4 蛋白的表达(SP,×400)

表3 2组早产大鼠肺组织中FABP4 蛋白的相对表达量(n=8)
2.3 2组早产大鼠肺组织中FABP4 mRNA 的表达结果见图2、表4。
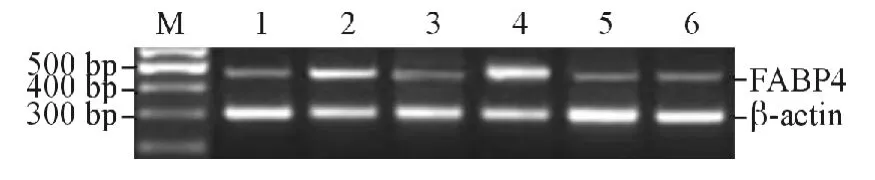
图2 2组早产大鼠肺组织中FABP4 mRNA 的表达

表4 2组早产大鼠肺组织中FABP4 mRNA 的相对表达量(n=8)
3 讨论
新近研究[6-10]认为宫内感染是引起新型BPD发生的重要因素。FABP4 是调控肺部炎症反应的重要因子,又是肺微血管生成重要调控因子VEGF及其受体2 的下游因子,其与VEGF 互为调控。FABP4 基因敲除小鼠受到炎症刺激时巨噬细胞不能分泌IL-1β、TNF-α 等促炎因子;受外源性VEGF干预后,支气管微血管内皮细胞增殖受阻,支气管毛细血管网生成密度降低,支气管发育障碍[11-12]。
该研究发现宫内感染肺损伤早期肺组织中FABP4 表达增加,随着肺损伤修复及发育,FABP4表达减少,逐渐恢复到正常对照水平。课题组前期研究[4-5]发现宫内感染肺损伤时VEGF 及其受体2的表达时相与该研究中FABP4 的表达时相正好相反。其可能机制为:①由于肺微血管的发育包括支气管微血管的发育和肺泡微血管的发育。VEGF 主要由肺泡上皮细胞合成,通过旁分泌途径作用于肺泡微血管。而FABP4 则主要由肺泡巨噬细胞及支气管血管内皮细胞合成,作用于支气管微血管。因此,宫内感染肺损伤时,二者反应可不同[6,13]。②宫内感染肺损伤早期由于肺巨噬细胞大量流入、聚集,导致FABP4 表达增加。大量分泌的FABP4 促进支气管微血管大量生成的同时,又抑制VEGF 及其受体2 表达,使肺泡微血管生成受阻[11]。③随着肺损伤的修复,肺巨噬细胞聚集减少,FABP4 表达减少,通过调控使VEGF 及其受体2 表达增加,肺泡微血管大量生成,但新合成的肺泡毛细血管呈不连续性,通透性差,为病理性重塑[14]。
该研究还发现宫内感染肺损伤时,随着肺发育,BALF 中FABP4 含量逐渐增加,与肺组织中的FABP4 表达时相并不完全一致。这可能是因为宫内感染肺损伤早期,炎性因子损伤肺泡和毛细血管基底膜,使肺血管通透性增加,FABP4 外渗,而以后虽然肺组织开始修复,但由于肺微血管为病理性重塑,FABP4 仍然能通过毛细血管基底膜外渗,引起BALF 中FABP4 表达持续增加[15]。
综上所述,宫内感染肺损伤早期,FABP4 表达增加,而随着肺损伤修复,FABP4 表达逐渐减少。FABP4 与肺组织VEGF 及其受体表达时相正好相反,从而导致肺微血管合成障碍,发生病理性重塑,肺泡化过程受阻,进而导致新型BPD 的发生。
[1]Hadchouel A,Delacourt C.Premature infants bronchopulmonary dysplasia:past and present[J].Rev Pneumol Clin,2013,69(4):207
[2]Madurga A,Mizikova I,Ruiz-Camp J,et al.Recent advances in late lung development and the pathogenesis of bronchopulmonary dysplasia[J].Am J Physiol Lung Cell Mol Physiol,2013,305(12):L893
[3]Talwar T,Srivastava MV.Role of vascular endothelial growth factor and other growth factors in post-stroke recovery[J].Ann Indian Acad Neurol,2014,17(1):1
[4]王伟,韦伟,宁琴,等.宫内炎性预敏及生后高氧暴露对早产大鼠肺血管内皮生长因子及其受体表达的影响[J].中华儿科杂志,2007,11(7):533
[5]王伟,余肖,宁琴,等.宫内炎性暴露对胎鼠及早产大鼠肺组织细胞增殖和p53 基因表达的影响[J].实用儿科临床杂志,2009,24(2):92
[6]Ghelfi E,Yu CW,Elmasri H,et al.Fatty acid binding protein 4 regulates VEGF-induced airway angiogenesis and inflammation in a transgenic mouse model:implications for asthma[J].Am J Pathol,2013,182(4):1425
[7]Kunzmann S,Collins JJ,Kuypers E,et al.Effects of antenatal inflammation on the developing lung[J].Z Geburtshilfe Neonatol,2012,216(4):177
[8]Hadchouel A,Franco-Montoya ML,Delacourt C.Altered lung development in bronchopulmonary dysplasia[J].Birth Defects Res A Clin Mol Teratol,2014,100(3):158
[9]Hoo RL,Lee IP,Zhou M,et al.Pharmacological inhibition of adipocyte fatty acid binding protein alleviates both acute liver injury and non-alcoholic steatohepatitis in mice[J].J Hepatol,2013,58(2):358
[10]Saint-Geniez M,Ghelfi E,Liang XL,et al.Fatty acid binding protein 4 deficiency protects against oxygen-induced retinopathy in mice[J].PLoS One,2014,9(5):343
[11]Sun HX,Choo-Wing R,Fan J,et al.Small molecular modulation of macrophage migration inhibitory factor in the hyperoxia-induced mouse model of bronchopulmonary dysplasia[J].Respir Res,2013,14(28):14
[12]He H,Chen F,Ni WS,et al.Theophylline improves lipopolysaccharide-induced alveolarization arrest through inflammatory regulation[J].Mol Med Rep,2014,10(1):269
[13]Levesque BM,Kalish LA,Winston AB,et al.Low urine vascular endothelial growth factor levels are associated withmechanical ventilation,bronchopulmonary dysplasia and retinopathy of prematurity[J].Neonatology,2013,104(1):56
[14]Esquibies AE,Karihaloo A,Quaggin SE,et al.Heparin binding VEGF isoforms attenuate hyperoxic embryonic lung growth retardation via a FLK1-neuropilin-1-PKC dependent pathway[J].Respir Res,2014,15(6):32
[15]Ghelfi E,Karaaslan C,Berkelhamer S,et al.Fatty acidbinding proteins and peribronchial angiogenesis in bronchopulmonary dysplasia[J].Am J Respir Cell Mol Biol,2011,45(3):550

