谷红注射液对脑缺血再灌注损伤大鼠运动功能障碍的影响①
张蕊,范思远,梁珍,纪超,杨楠,刘雁勇,崔丽英,左萍萍
谷红注射液对脑缺血再灌注损伤大鼠运动功能障碍的影响①
张蕊1,范思远2,梁珍1,纪超1,杨楠1,刘雁勇1,崔丽英2,左萍萍1
目的观察谷红注射液对脑缺血再灌注损伤模型大鼠运动功能障碍的影响。方法Sprague-Dawley大鼠90只分为假手术组、模型组、乙酰谷酰胺组、红花注射液组和谷红注射液组,采用大脑中动脉闭塞(MCAO)建立脑缺血2 h再灌注损伤模型。术后24 h给药治疗,连续给药14 d。采用Bederson神经缺损症状评分平衡杆测试观察各组运动功能。酪氨酸羟化酶(TH)免疫组化染色观察各组大鼠黑质神经元细胞存活率。结果模型组大鼠的过杆总时间比假手术组明显增加(P<0.01),红花注射液与谷红注射液组过杆总时间较模型组降低(P<0.05)。模型组大鼠缺血侧黑质TH神经元细胞存活率较健侧显著减少(P<0.001),红花注射液和谷红注射液组TH神经元的细胞存活率较模型组明显升高(P<0.01)。结论谷红注射液能显著改善脑缺血再灌注大鼠的运动功能障碍,其保护作用可能与抑制黑质神经元的继发性损伤有关。
脑缺血再灌注;谷红注射液;运动功能;黑质;酪氨酸羟化酶
[本文著录格式]张蕊,范思远,梁珍,等.谷红注射液对脑缺血再灌注损伤大鼠运动功能障碍的影响[J].中国康复理论与实践,2015,21(1):12-16.
CITED AS:Zhang R,Fan SY,Liang Z,et al.Effects of Guhong Injection on motor dysfunction in cerebral ischemia-reperfusion rats[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(1):12-16.
脑卒中是严重危害人类健康的脑血管疾病,致残致死率极高[1],其中约80%为缺血性脑卒中[2]。目前临床上治疗脑缺血主要采用梗死发生后的极早期进行溶解血栓、恢复血流,但是由于溶栓药组织型纤溶酶原激活物(tPA)的治疗时间窗很窄,限制了其应用。
脑缺血损伤是一个可引起一系列复杂反应的过程,迫切需要多种作用机制的治疗药物[3]。已有的研究发现,大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)引起黑质远隔区继发性损伤可能是脑梗死后神经功能恢复不理想的重要原因[4]。而酪氨酸羟化酶(tyrosine hydroxylase,TH)是黑质合成多巴胺的标志酶。
谷红注射液为中西药复方制剂,为乙酰谷酰胺和中药红花提取物制成的灭菌水溶液,其治疗急性缺血性脑卒中的有效性得到大量临床试验证实[5-14]。本实验采用线栓法建立大鼠MCAO模型,从整体水平上观察
谷红注射液对神经功能障碍的影响,并探讨其作用机制是否与保护远隔区黑质神经元继发性损伤相关。
1 材料与方法
1.1 药品与试剂
谷红注射液(批号S201212111)、红花注射液(批号S201212112)、乙酰谷酰胺注射液(批号S201212113):通化谷红制药有限公司。生理盐水:石家庄四药有限公司。尼龙栓线:北京沙东生物技术有限公司,货号2634-100。兔抗TH多克隆抗体:MILLIPORE公司,货号AB152。辣根酶标记山羊抗兔二抗检测试剂盒:北京中杉金桥生物技术有限公司,货号PV-9001。
1.2 实验动物
Sprague-Dawley大鼠90只,雄性,体质量(180± 20)g,由军事医学科学院实验动物中心提供。SPF级环境饲养,12 h周期明暗,自由进食与进水。室温保持20~25℃。
1.3 模型制备
参照Longa法复制MCAO模型[15],并加以改进。大鼠适应环境7 d后进行手术。按实验动物的3R原则给予人道关怀。术前12 h禁食不禁水。大鼠1%戊巴比妥钠50 mg/kg腹腔注射麻醉,仰卧固定于平板上,碘伏消毒。颈正中行长约2 cm切口。钝性分离肌肉,充分暴露右侧颈总动脉和迷走神经。分离血管与神经。用手术线结扎颈外动脉和颈总动脉主干近心端,彻底阻断其血流。用微动脉夹暂时关闭颈总动脉分叉处近端,在颈总动脉近分叉处预先放置好一根手术线,然后用眼科剪在颈总动脉近分叉处剪一切口(切口与分叉处距离4~5 mm),从切口处插入钓鱼线。鱼线在血管中前进约18~20 mm后固定。2 h后再麻醉大鼠,拔出鱼线。
假手术组只分离血管不插鱼线。
1.4 分组及给药
采用随机数表法将大鼠随机分为以下5组:A组(假手术组)、B组(模型组)、C组(乙酰谷酰胺注射液治疗组)、D组(红花注射液治疗组)、E组(谷红注射液治疗组)。各组死亡大鼠不予补充。
术后24 h开始药物干预。A组和B组腹腔注射生理盐水1 ml/100 g,C组腹腔注射30 mg/ml乙酰谷酰胺1 ml/100 g,D组腹腔注射0.5 g/ml红花注射液1 ml/100 g,E组腹腔注射谷红注射液(红花0.5 g/ml,乙酰谷酰胺30 mg/ml)1 ml/100 g。每天1次,连续14 d。定期测量大鼠体重并根据体重调整注射剂量。
1.5 神经缺损症状评分
术后1 d、7 d和14 d(处死前)行Bederson神经缺损症状评分。提鼠尾使大鼠离开地面约30 cm,观察双侧前肢情况;将大鼠置于水平地面,从两侧推动其双肩,观察两侧抵抗力有无差异;大鼠置于地面,观察其自由行走情况。0分,无神经缺损症;1分,轻度神经缺损症状(提尾时瘫侧前肢内收,不能全伸直);2分,中度神经缺损症状(行走时向瘫侧倾倒);3分,重度神经缺损症状(向瘫侧旋转)。
1.6 平衡杆测试
给药14 d后开始测试。平衡杆为长105 cm,宽4 cm,厚3 cm的木杆。木杆离地80 cm,两端由木架支撑。木杆一端为起始区,长20 cm,另一端为终点区,终点区后接一个大鼠笼。平衡杆正下方放置约厚10 cm木屑垫料,以防大鼠跌伤。测试时,大鼠放在起始区,面对鼠笼,开始计时。记录大鼠四肢均通过起始区(过杆潜伏期)和整个平衡杆(过杆总时间)的时间。潜伏期最大允许时间为1 min,过杆总时间为2 min[16]。测试前所有大鼠每天训练1次,共训练2 d,于第3天正式测试。
1.7 TH免疫组化染色
行为学评价后,每组取3只大鼠戊巴比妥钠50 mg/kg麻醉,剪开胸腔,充分暴露心脏,从左心尖处插入灌流针,剪开右心耳。先用PBS进行灌流,待血液冲洗干净后改用4%多聚甲醛继续灌流约15 min。断头取脑,置于4%多聚甲醛中4℃过夜固定。固定1周后,转入15%、20%和30%蔗糖溶液中梯度脱水,4℃放存。冰冻切片机切取冠状脑片,片厚30 μm,收集于冻存液中,-20℃保存。挑取黑质部位的脑片进行TH免疫组化染色。染色严格按照SP试剂盒说明进行。一抗为兔抗大鼠多克隆TH抗体(1∶800),DAB染色、干燥封片,20×显微镜下观察,每只大鼠取3张脑片,分别计数左(正常侧)、右(缺血侧)两侧大脑黑质区各3个视野存活TH阳性细胞数,计算存活率。

1.8 统计学分析
采用SPSS 19.0统计软件进行统计检验。计量资料以(±s)表示。Shapiro-Wilk法行正态性检验,Levene法行方差齐性检验。满足正态性或方差齐性,采用单因素方差分析;若不满足正态性或方差齐性,则使用非参数Kruskal-Wallis H检验。单因素方差分析存
在显著性差异时,使用最小显著差法(Least Significance Difference,LSD)进行Post hoc检验。Kruskal-Wallis H检验存在显著性差异时,使用Mann-Whitney U检验进行Post hoc检验。显著性水平α=0.05。
根据实验目的,将各组拆分成两种不同组合,分别进行统计检验。组合1:A组和B组,验证是否造模成功。组合2:B组、C组、D组和E组,比较不同药物干预的效果是否有差异。若组合2有显著性差异,再进行Post hoc检验。
2 结果
2.1 神经功能缺损评分
Kruskal-Wallis H检验显示,术后1 d、7 d、14 d,组合1神经功能缺损评分有非常高度显著性差异(P<0.001),组合2无显著性差异(P>0.05)。见表1。
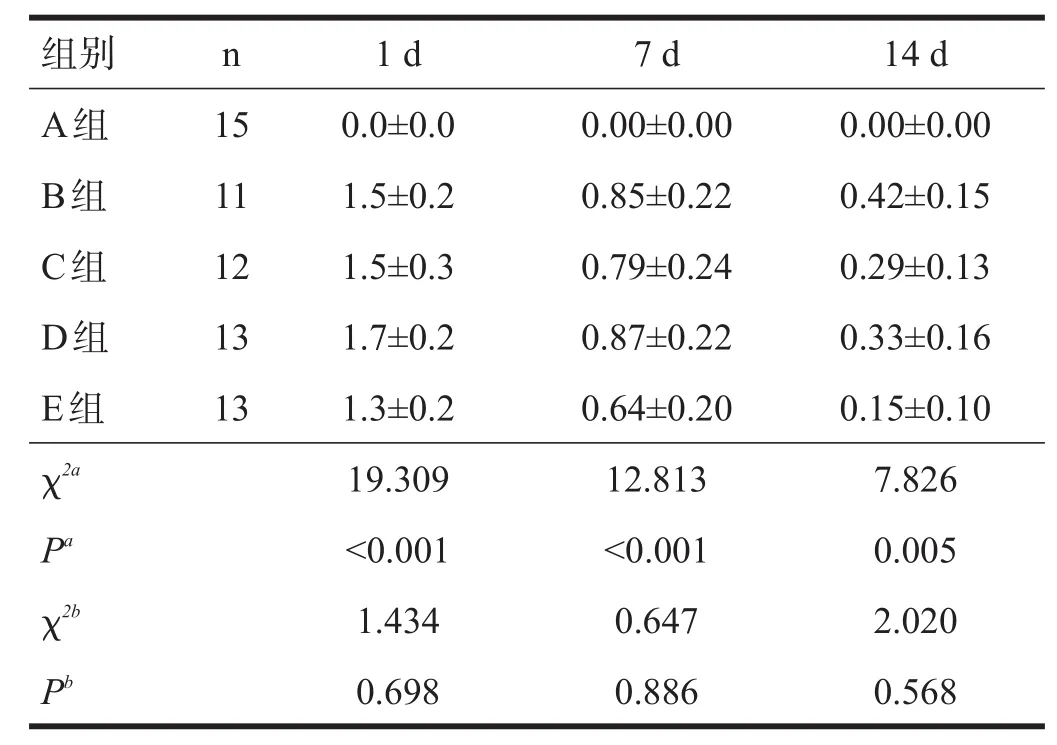
表1 各组神经功能缺损评分比较
2.2 平衡杆测试
Kruskal-Wallis H检验显示,组合1过杆总时间有高度显著性差异(P<0.01),组合2有高度显著性差异(P<0.01),其中,B组、D组与E组间有高度显著性差异(χ2=10.786,P=0.005)。Post hoc检验显示,D组(U= 10.500,P=0.003)、E组(U=11.500,P=0.010)与B组间有显著性差异。见表2。过杆潜伏期无显著性差异。
2.3 黑质区TH免疫组化染色
单因素方差分析显示,组合1细胞存活率有非常高度显著性差异(F=15.648,P<0.001)。组合2有高度显著性差异(P<0.01)。与B组比较,D组和E组存活率均增加(P<0.05)。见图1、图2。
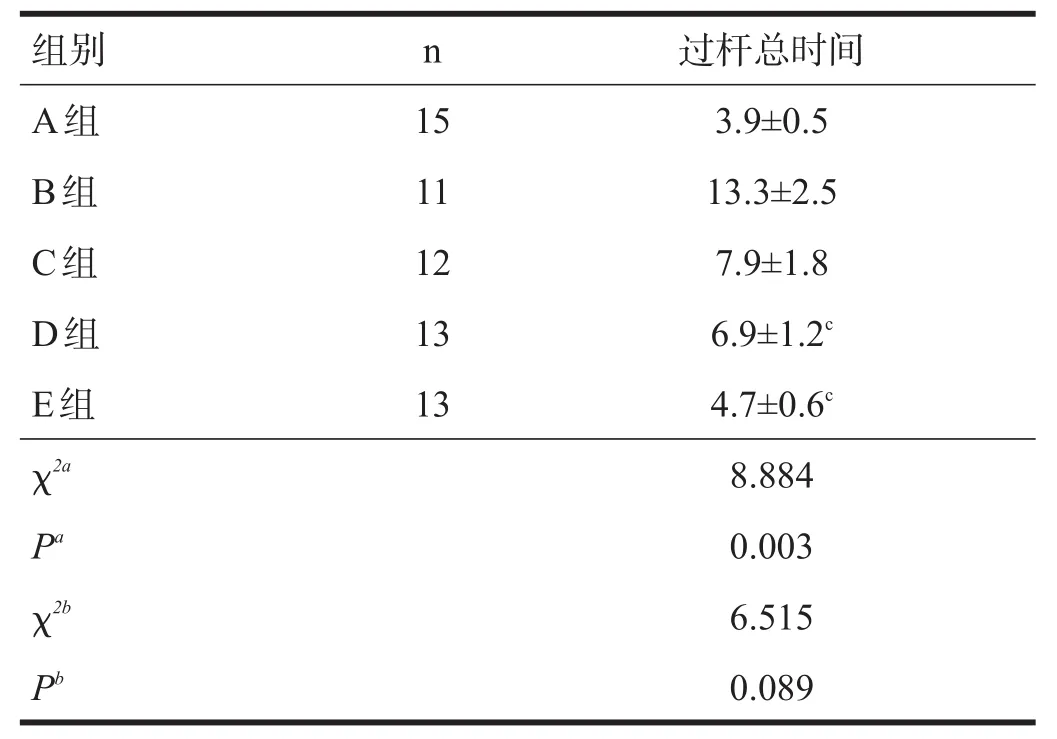
表2 各组平衡杆测试过杆总时间比较(s)

图1 各组黑质部位TH阳性细胞存活率
3 讨论
当前,缺血性脑血管疾病发病率逐年增高,病死率达60%~80%;即使存活,也留有严重后遗症。脑梗死患者会出现偏瘫、共济失调等肢体运动功能障碍,给患者的生活带来严重困扰[17]。改善脑缺血损伤导致的运动功能障碍对于脑卒中患者的预后和功能恢复至关重要。
在临床实践中,红花的安全性基本得到认可。乙酰谷酰胺是一种神经肽,可以透过血脑屏障,加强细胞内谷光甘肽合成,具有潜在的抗氧化损伤功能[18]。谷红是红花和乙酰谷酰胺的混合物,根据这两种成分的特性,我们推测谷红可能具有提高脑组织抵抗脑缺血的能力。本研究显示,谷红注射液治疗可改善平衡杆测试的运动功能。
已有的报道显示,采用大鼠MCAO模型不仅造成损伤侧大脑皮质、尾壳核和豆状核缺血梗死,而且远离梗死灶,但与之有大量纤维联系的黑质区域也相继发生退行性改变,与最终运动功能障碍密切相关[19-20]。随着神经影像技术的广泛运用,临床上也观察到患者中动脉梗阻或苍白球受损都会导致同侧黑质区神经元发生继发性病变[21-23]。减少黑质区神经元迟发性损伤在脑缺血治疗中具有重要意义。
我们在前期实验中观察到,经谷红注射液治疗后,大鼠脑组织Caspase-3表达明显下降,推测其抗急性脑缺血的作用可能与抗凋亡有关[18]。本研究观察到,谷红注射液对脑缺血后远隔区黑质继发性损害有保护作用。黑质-纹状体通路是调控肢体运动的重要中枢,谷红注射液改善大鼠运动功能障碍可能与保护黑质神经元有关。需要说明的是,由于我们给药时间较长,过程中缺血侧纹状体出现了液化坏死,故未能对其进行切片染色。
随着我国人口老龄化进程的加速,脑血管病已成为危害人类健康和生命的主要疾患。抗脑缺血药物研究已经成为神经科学关注的研究热点。临床显示谷红注射液作为有效的抗脑缺血药物,安全性较高,通过对其作用机制的深入探讨,将会开辟出谷红注射液更广泛的临床应用前景。
[1]Ouyang YB,Stary CM,Yang GY,et al.microRNAs:innovative targets for cerebral ischemia and stroke[J].Curr Drug Targets,2013,14(1):90-101.
[2]Go AS,Mozaffarian D,Roger VL,et al.Heart disease and stroke statistics-2014 update:a report from the American HeartAssociation[J].Circulation,2014,129(3):e28-e292.
[3]Vosler PS,Chen J.Potential molecular targets for translational stroke research[J].Stroke,2009,40(3 Suppl):S119-S120.
[4]Saji M,Reis DJ.Delayed transneuronal death of substantia nigra neurons prevented by gamma-aminobutyric acid agonist[J]. Science,1987,235(4784):66-69.
[5]贺天伟.谷红注射液治疗急性脑梗死临床疗效观察[J].现代中西医结合杂志,2006,15(19):2654.
[6]王秋爽.谷红注射液治疗脑梗死疗效观察[J].中国保健营养(下旬刊),2013,(9):5313.
[7]王洪涛,董媛.谷红注射液治疗急性脑梗死的临床疗效观察[J].实用心脑肺血管病杂志,2006,14(8):641-642.
[8]梁辉,李万英.谷红注射液治疗急性脑梗死的临床观察[J].医学美学美容,2013,(12):8-9.
[9]沈洁.谷红注射液治疗急性脑梗死的临床效果评估[J].中国保健营养(中旬刊),2013,(10):459.
[10]贺光辉,韩爱强.谷红注射液治疗急性脑梗死的临床观察[J].医药前沿,2012,(24):161-162.
[11]孙胜花,云武,宋钦华.金特佳治疗急性脑梗死的疗效观察[J].中国神经免疫学和神经病学杂志,2006,13(5):317.
[12]李昕,王建平,刘春岭,等.谷红注射液治疗急性脑梗死60例疗效观察[J].中国实用神经疾病杂志,2007,10(2):19-21.
[13]刘宏.谷红注射液治疗急性脑梗死临床疗效观察[J].海南医学,2007,18(11):78.
[14]张茁.谷红注射液治疗急性脑梗死有效性和安全性的多中心、随机、开放性临床观察[J].现代预防医学,2010,37(22): 4382-4383,4385.
[15]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[16]Allbutt HN,Henderson JM.Use of the narrow beam test in the rat,6-hydroxydopamine model of Parkinson's disease[J].J Neurosic Methods,2007,159(2):195-202.
[17]陈玉敏,陈涛平,冯浩楼.脑缺血再灌注损伤机制与治疗现状[J].医学研究与教育,2012,6(29):47-54.
[18]徐蔚海,崔丽英,左萍萍,等.谷红对抵抗大鼠脑缺血能力影响的研究[J].中国实用内科杂志,2006,26(20):1627-1629.
[19]Volpe BT,Blau AD,Wessel TC,et al.Delayed histopathological neuronal damage in the substantia nigra compacta(nucleus A9)after transient forebrain ischaemia[J].Neurobiol Dis, 1995,2(2):119-127.
[20]DeGiorgio LA,Dibinis C,Milner TA,et al.Histological and temporal characteristics of nigral transneuronal degeneration after striatal injury[J].Brain Res,1998,795(1-2):1-9.
[21]Ogawa T,Okudera T,Inugami A,et al.Degeneration of the ipsilateral substantia nigra after striatal infarction:evaluation with MR imaging[J].Radiology,1997,204(3):847-851.
[22]Nakajima M,Hirano T,Terasaki T,et al.Signal change of the substantia nigra on diffusion-weighted imaging following striatal infarction[J].Intern Med,2010,49(1):65-68.
[23]Lou M,Jing CH,Selim MH,et al.Delayed substantia nigra damage and leukoencephalopathy after hypoxic-ischemic injury[J].J Neurol Sci,2009,277(1-2):147-149.
Effects of Guhong Injection on Motor Dysfunction in Cerebral Ischemia-reperfusion Rats
ZHANG Rui,FAN Si-yuan,LIANG Zhen, JI Chao,YANG Nan,LIU Yan-yong,CUI Li-ying,ZUO Ping-ping.Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences,Beijing 100005,China
Objective To evaluate the effects of Guhong Injection on motor dysfunction in rats after cerebral ischemia-reperfusion. Methods The middle cerebral arteries were occluded for 2 hours and re-perfused in Sprague-Dawley rats.They were divided in sham group, model group,Aceglutamide group,Safflowere group and Guhong group,which were intravenously administrated with normal saline,Aceglutamide,Safflower or Guhong 24 hours after operation,and continued for 14 days.They were tested with the beam-walking test after treatment.Tyrosine hydroxylase(TH)immunohistochemical staining was used to investigate the viability of neurons in the substantia nigra.Results The model group spent more time in the beam-walking test than that in the sham group(P<0.01),and it decreased in the Safflower group and Guhong group compared with that in the model group(P<0.05).The TH-positive neurons decreased in the model rat compared with that in the sham group(P<0.001),and increased in both Safflower and Guhong groups compared with that in the model group(P<0.01).Conclusion Guhong administration could significantly improve the motor dysfunction in rats after cerebral ischemia-reperfusion, which might be related to provent the neurons from injury in the substantia nigra.
cerebral ischemia-reperfusion;Guhong Injection;motor dysfunction;substantia nigra;tyrosine hydroxylase
10.3969/j.issn.1006-9771.2015.01.004
R743.3
A
1006-9771(2015)01-0012-05
2014-11-24
2015-01-05)
1.国家自然科学基金项目(No.81100801);2.菏泽步长制药有限公司项目。
1.中国医学科学院基础医学研究所药理室,北京市100005;2.中国医学科学院协和医院,北京市100005。作者简介:张蕊(1986-),女,陕西渭南市人,博士研究生,主要研究方向:脑血管病与神经药理学。通讯作者:左萍萍。E-mail:pingping_zuo@126.com。

