甜菜nii基因编码氨基酸偏好及与菠菜nii编码蛋白序列的比较
石晓艳
(1.珠海市斗门生态农业园管理委员会农业科技推广中心,珠海519100;2.东北农业大学农学院,哈尔滨150030)
甜菜nii基因编码氨基酸偏好及与菠菜nii编码蛋白序列的比较
石晓艳1,2
(1.珠海市斗门生态农业园管理委员会农业科技推广中心,珠海519100;2.东北农业大学农学院,哈尔滨150030)
采用RT-PCR方法从二倍体甜菜Ty7中获得与亚硝酸还原反应相关的cDNA基因片段,运用RACE技术获得了基因全长序列,并命名为nii基因。该基因全长2014 bp,ORF长度1800 bp,编码599个氨基酸。该基因编码氨基酸残基具有亮氨酸和缬氨酸偏好,编码蛋白结构域与菠菜的高度同源。该基因的获得可为下一步基因的表达与调控研究奠定基础。
甜菜;nii基因;氨基酸偏好;序列比较
铵态氮和硝态氮是植物生长所必需的氮源,甜菜的主要氮源为铵盐和硝酸盐。无机氮素以铵的形态参与代谢,非铵态的氮源被植物吸收后大都是先由植物将其转化成NH4+,才可被甜菜直接利用合成氨基酸。甜菜根系吸收的硝酸盐,必须在体内经过还原才能合成有机含氮化合物。硝酸盐还原为NH4+,一般分两步,先由硝酸还原酶(NR)还原成亚硝酸盐,再由亚硝酸还原酶(NiR)还原为NH4+。
甜菜亚硝酸还原酶(NiR)由nii基因编码,截至目前,至少已在拟南芥(Arabidopsis thaliana)[1-2]、烟草(Nicotiana tabacum L.)[3-4]、玉米(Zeamays L.)[5-6]、菠菜(Spinacia oleracea L.)[7-8]、水稻(Oryza sativa L.)[9]、豌豆(Pisum sativum L.)[10]、白菜(Brassica campestris L.)[11]等高等植物中克隆获得了nii基因全长序列。本研究以二倍体甜菜Ty7为试材,克隆获得甜菜nii基因,为后续的基因表达与调控研究奠定了基础。
1 材料和方法
供试品种:甜菜品种为二倍体纯系品种甜研7号(Ty7),种子由哈尔滨工业大学甜菜糖业研究所提供。
将甜菜种子在室温下浸种过夜,置于培养皿中25℃恒温催芽至少24h,然后移至营养钵中室内培养,光照约1800 lx,温度约为25℃。待幼苗长到2~4对真叶时就可用于试验。用前4h,向营养钵中浇灌30mmol/L的KNO3溶液,进行氮光共同诱导培养,然后用于分子生物学操作。
根据GenBank上已知的甜菜nii的DNA部分序列(AF173663)与已知同属藜科的菠菜nii mRNA(X07568)序列进行比对后,使用Primer Premier 5.0软件设计引物,在保守区设计上游及下游引物,进行两端未知区域的扩增。引物由上海生工公司和Invitrogen公司完成。设计的引物如表1。
RNA的提取参照Trizol(Invitrogen)的说明书进行。取1μLRNA样品与5μL 6×Loading Buffer混合后,于1%的琼脂糖凝胶上电泳,检测RNA的完整性。用DNaseⅠ消化RNA,去除残存DNA。参照Reverse Transcriptase M-MLV(RNase H-)反转录酶(TaKaRa)的使用说明书反转录合成cDNA,首先进行中间序列的克隆,然后根据3'-RACE试剂盒(TaKaRa)和5'-RACE试剂盒(TaKaRa)使用说明书,进行3'端和5'端的基因片段克隆,进行序列拼接分析,得到拼接序列全长。
2 结果与分析
2.1nii基因编码蛋白结构域
根据以上方法,经反转录和PCR扩增,获得了423bp的中间序列,采用RACE技术克隆获得了5'端序列489bp,3'端序列1600bp。采用序列拼接软件将获得的序列进行拼接,得到了甜菜nii基因cDNA全序列2081bp,包括281 bp的3'非翻译区(UTR,untranslated region)和31bp的5'非翻译区;32bp处有启始密码子ATG,1832bp处有终止密码子TAG,2003bp处是PolyA尾。
将克隆得到的nii基因序列,进行ORF分析,发现编码区全长为1800bp,共编码599个氨基酸。图1是甜菜nii基因编码蛋白结构域。所编码的氨基酸序列具有完整NiR结构,含血红素蛋白β-化合物区域(hemoprotein beta-component,ferrodoxin-like,Domain:133~203 aa,392~461 aa),4Fe-4S区域(4Fe-4S region, Domain:211~371aa,517~580aa)。

图1 nii基因编码蛋白结构域
2.2nii基因编码氨基酸偏好
在nii cDNA编码蛋白的氨基酸序列中,Leu(亮氨酸)和Val(缬氨酸)含量最多,比率分别为8.51%,然后是Glu(谷氨酸)占7.85%,位列第三的是Gly(甘氨酸)7.68%,Trp(色氨酸)和Tyr(酪氨酸)含量最少分别为1.34%(见表2)。编码蛋白的氨基酸序列中含有13个Cys(半胱氨酸),说明编码产物中可能含有二硫键。通过ExPASy的ProtParam工具分析,酸性氨基酸残基总数(Asp+Glu)共78个,碱性氨基酸残基总数(Arg+Lys)78个。
运用在线分析软件http://au.expasy.org/prosite/进行活性位点分析,得出甜菜nii基因编码蛋白序列的517~533区域的TGCpnsCgqvqvaDIGF为还原反应的活性位点(见图2)。

表2 nii编码蛋白的氨基酸组成
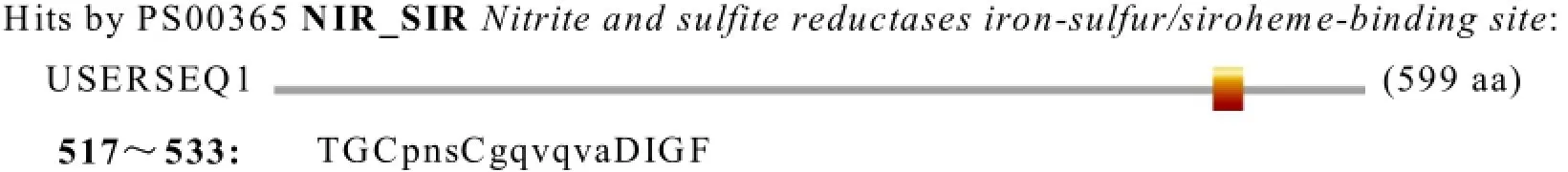
图2 甜菜nii基因编码蛋白的活性位点分析

图3 甜菜与菠菜的nii基因编码蛋白序列比较
2.3与菠菜编码蛋白结构域的比较分析
为了分析比较甜菜(sugarbeet)与菠菜(spinach)nii基因的编码蛋白,采用BioEdit分析软件,对氨基酸序列进行了比对,详见图3,从第13~55氨基酸,两者出现了较大差异;分别在120~121aa;453~454aa;567~568aa三处有两个氨基酸不同,但都不在功能区域内;有1个氨基酸差异的分别位于第109、114、116、125、159、249、256、294、360、363、371、379、386、401、415、422、429、466、581、585的氨基酸位置。其中249、256、294、360、363、371处于4Fe-4S结构域内。
总体来看,甜菜nii基因编码产物与同属藜科菠菜的nii基因编码的蛋白具有高度的同源性,两基因编码蛋白除了在各功能区域具有较高一致性外,在其它区域也有较大的相似性。这为进一步分析甜菜nii基因的光养调控元件和NO3-调节的关键区提供了可能。
3 结论与讨论
本研究采用RT-PCR技术和RACE技术,从二倍体甜菜甜研7号中克隆获得甜菜nii基因,基因全长为1800bp,共编码599个氨基酸。该基因具有亮氨酸和缬氨酸偏好,酸碱性氨基酸残基总数基本相同。与菠菜nii基因的编码蛋白具有高度同源性。
以往的研究结果证明,nii基因的硝化调节表达中,位于-230和-200区域之间30bp的基因是具有决定性的。根据文献,菠菜nii的TATA盒位于5'上游的-25,CAAT盒位于-80,在-200/+131是光、氮协同调控的基本元件,在-300/-200和-1450/-1730为两个增强子区。在-230~220之间的30bp是菠菜nii基因NO3-调节的关键区。
菠菜叶片中Fd-NiR氨基酸的R375、R556、K436三个位点分别由Lys-5,磷酸吡啶醛(pyridoxal-5,-phosphate)和Arg-萘乙二醛(phenylglyoxal)修饰,以往的研究表明,这3个氨基酸或直接参与Fd结合,并将电子传给NiR。当植株处于氮饥饿时,甚至在NADPH/NADP的比率非常高的情况下,6-磷酸葡萄糖脱氢酶(G6PDH)也能作为NiR的电子供体使铁氧还原酶(Fd)还原。关于甜菜nii基因的表达与调控的基本原件需要进一步通过研究进行分析和验证。
Kato等(2004)[3]的研究结果表明,烟草(tobacco)具有4个nii基因:nii-1,nii-2,nii-3,nii-4。通过定量竞争性RT-PCR揭示了烟草中该基因家族的差异性表达:在叶片及根中这4个基因各自的mRNA有些许区别。nii-1和nii-3的mRNA的稳定状态水平几乎是相同的,这样的结果也同样表现在根中nii-2和nii-4的转录体中[3]。
关于甜菜的nii基因拷贝数是多少,其在不同部位的表达是否存在差异,需要进一步开展研究探明。
[1]Hara,K.,Komaba,S.,Takahashi,M.,Goshima,N.and Morikawa,H.Arabidopsis thaliana nitrite reductasemRNA Published Only in Database[DB/OL].1997
[2]Lin,X.,Kaul,S.,Rounsley,S.,etal.Sequence and analysis of chromosome 2 of the plant Arabidopsis thaliana[J].Nature,1999,402 (6763):761-768
[3]Kato,C.,Takahashi,M.,Sakamoto,A.and Morikawa,H.Differential expression of the nitrite reductase gene family in tobacco as revealed by quantitative competitive RT-PCR[J].J.Exp.Bot.,2004,55(403):1761-1763
[4]Kronenberger,J.,Lepingle,A.,Caboche,M.and Vaucheret,H.Cloning and expression of distinctnitrite reductases in tobacco leaves and roots[J].Mol.Gen.Genet.,1993,236(2-3):203-208
[5]Margaret G,Redinbaugh,Wilbur H,Campbell.Glutamate synthasesand ferredoxin-dependent glutamate synthase expression in the maize(Zeamays)root primary response to nitrate[J].Plant physiol.,1993,101:1249-1255
[6]Lahners K,Kramer V,Back E,etal.Molecular cloning of complementary DNA encodingmaize nitrite reductase[J].Plant Physiol, 1988,88:741-746
[7]Back,E.,Burkhart,W.,Moyer,M.,Privalle,L.and Rothstein,S.Isolation of cDNA clones coding for spinach nitrite reductase: complete sequence and nitrate induction[J].Mol.Gen.Genet.,1988,212(1):20-26
[8]Back,E.,Dunne,W.,Schneiderbauer,A.,de Framond,A.,Rastogi,R.and Rothstein,S.J.Isolation of the spinach nitrite reductase gene promoterwhich confersnitrate inducibility on GUSgene expression in transgenic tobacco[J].PlantMol.Biol.,1991,17(1):9-18
[9]Dose M M,Hirasawa M,Kleis-SanFrancisco S,et al.The ferre-doxin-binding site of ferredoxin nitrite oxidoreductase differential chemicalmodification of the free enzyme and its comlex with ferredoxin[J].Plant Physiol,1997,114(3):1047-1053
[10]PolcynW,LucinskiR.Effectof N oxyanions on anaerobic induction of nitrite reductase in subcellular fraction of Bradyrhizobium sp.(Lupinus)[J].Antonie van Leeuwenhoek,2009,95:159-164.
[11]孙菲菲,蒋芳玲,侯喜林,李英,杨学东.白菜亚硝酸还原酶基因BcNiR的克隆及表达分析[J].园艺学报,2009,36(10):1511-1518
Abstrct:In this study,a cDNA clone putatively associated with nitrite reduction was isolated from Ty7,a diploid cultivar of sugar beet(Beta vulgaris L.)using RT-PCR cloning technique.A novel full-length cDNA(GenBank accession number HQ224499),termed Bvnii,was obtained using rapid amplification of cDNA ends(RACE).Bvnii full length is 2014 bp.The open reading frame of this gene is 1800 bp in length,which encodes 599 amino acids. There are leucine,and valine preferences of amino acid residues encoded by Bvnii.The protein sequence of nii in sugar beet is highly homologous with that of spinach.This resultmay play a role in the further research on Bvnii gene expression and regulation.
Sugarbeet(Beta vulgaris L.)Nii Gene:Am ino Acid Preferences and Com parison with That of Spinach(Spinacia oleracea)
SHIXiao-yan1,2
(1.The Agricultural Technology Extension Center of Doumen Ecology-agriculture Zone Management Committee,Zhuhai519100; 2.College of Agronomy,Northeast Agricultural University,Harbin 150030)
sugarbeet;nii gene;amino acid preference;sequence comparison
S566.3;Q78
A
1007-2624(2015)04-0001-03
10.13570/j.cnki.scc.2015.04.001
2015-03-19
石晓艳,女,博士,珠海市斗门生态农业园管理委员会农业科技推广中心职员,Email:317098196@qq.com

