氯化钠胁迫下甜菜叶片ATPase活性动态变化
孙学伟,耿贵,於丽华,赵慧杰,付盈盈,刘治婷,刘慧
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院甜菜研究所,哈尔滨150080;3.黑龙江大学生命科学学院,哈尔滨150080)
氯化钠胁迫下甜菜叶片ATPase活性动态变化
孙学伟3,耿贵1,2*,於丽华1,2,赵慧杰3,付盈盈3,刘治婷3,刘慧3
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院甜菜研究所,哈尔滨150080;3.黑龙江大学生命科学学院,哈尔滨150080)
采用营养液室内培养法,研究了不同盐浓度胁迫对甜莱叶片的影响,以及盐胁迫后,(Na+-K+)-ATPase、Ca2+-ATPase和M g2+-ATPase活性随时间的动态变化。结果表明,与对照组相比,70mmo l/LNaC l处理组甜菜叶片(Na+-K+)-ATPase、Ca2+-ATPase和Mg2+-ATPase活性均略有增加,但增加幅度较小。其余3个盐处理组活性均有不同程度增加,且浓度越高,增加幅度越大。各处理组甜菜叶片(Na+-K+)-ATPase、Ca2+-ATPase和Mg2+-ATPase活性随处理时间增加呈现不同的波动性变化。
甜菜;盐胁迫;ATP酶活性;动态变化
土壤盐渍化是目前世界农业面临的主要环境问题之一。全球盐渍化土壤大约9.55×108hm2,次生盐渍化土壤约0.77×108hm2,而且还在不断增加[1]。土壤盐渍化不仅会引起农业生产减产,同时也会对生态环境造成很大影响[2]。因此,对如何降低盐胁迫下植物所受的伤害的研究以及合理利用土地已刻不容缓。甜菜是我国重要的糖料作物[3],其耐盐性较强,在高达300mmol/LNaCl胁迫下也能生长[4]。ATPase在离子转运过程中起着重要的调控作用[5],在一定盐浓度胁迫下,植物ATPase活性会随之升高[6]。另据陈亚华发现在短期低温胁迫环境下水稻ATPase活性也呈上升趋势,胁迫环境下植物适应能力与ATPase活性密切相关[7]。本研究用不同浓度NaCl溶液模拟盐胁迫,探讨甜菜在盐胁迫条件下ATPase活性的变化情况以及对甜菜生长的影响,揭示甜菜适应盐胁迫的生理机制,为甜菜耐盐栽培和育种提供理论依据。
1 材料与方法
本试验于2013年5—6月在光照培养室内进行。供试甜菜品种为ST13092,为单胚包衣种子。将种子播种于基质(蛭石)中,培育室光照强度为350μmol/(m2·s),每日连续光照14h,昼夜温度分别为25℃和20℃,相对湿度保持在60%~70%。在蛭石内培养6d后选取大小均匀的甜菜幼苗移入含20L营养液的玻璃槽中,NaCl浓度分别是3、70、140、210和280mmol/L,每个处理3个重复,每个重复36株,3mmol/LNaCl浓度为对照组。盐后处理第一天、第二天、第三天、第四天、第六天、第八天和第十天,分别取不同盐浓度的甜菜叶测定ATPase活性。ATPase样品提取方法参照郑翠冰的试验提取方法[8],ATPase活性测定采用南京建成生物研究所生产的ATPase试剂盒测定。
2 结果与分析
2.1NaCl胁迫下叶片中(Na+-K+)-ATPase活性的动态变化
试验结果(表1)表明,随着氯化钠浓度的提高,(Na+-K+)-ATPase活性不断提高。NaCl浓度从3提高到70、140、210和280mmol/L,胁迫4d(Na+-K+)-ATPase活性分别提高了34.60%、74.24%、156.34%和191.15%;胁迫6d(Na+-K+)-ATPase活性分别提高了40.96%、74.24%、171.27%和204.50%;胁迫8d(Na+-K+)-ATPase活性分别提高了49.02%、69.85%、167.73%和247.44%;胁迫10d(Na+-K+)-ATPase活性分别提高了24.54%、51.05%、141.54%和221.69%。从胁迫4~10d每增加70mmol/L氯化钠所引起的酶活性增幅来看,210 mmol/L处理(Na+-K+)-ATPase活性提高的幅度较大,较140mmol/L处理平均提高了91.87%,280 mmol/L处理的次之,较上一处理提高了63.72%,70和140mmol/L处理(Na+-K+)-ATPase活性提高的较少,分别提高了37.28%和30.06%。由此可见,虽然(Na+-K+)-ATPase活性随着氯化钠浓度提高而增强,但是氯化钠每增加70mmol/L所引起的酶活性提高的幅度并不相同。
随着氯化钠胁迫时间的延长,同一处理(Na+-K+)-ATPase活性不断提高。氯化钠3mmol/L正常处理后1、2、3、4、6、8、10d,(Na+-K+)-ATPase活性分别为3.072、3.047、3.996、4.329、4.623、4.843、5.647μmol Pi/(mgprot·h);每日提高率分别为-0.81%、31.15%、8.33%、3.40%、2.38%、8.30%。氯化钠70mmol/L低盐度处理后1、2、3、4、6、8、10d,(Na+-K+)-ATPase活性分别为3.209、3.561、4.823、5.827、6.517、7.217、7.033μmol Pi/(mg prot·h);每日提高率分别为10.97%、35.44%、20.82%、5.94%、5.37%、-1.27%;氯化钠140mmol/L盐度处理后2、3、4、6、8、10d的,(Na+-K+)-ATPase活性分别为4.524、6.907、7.543、8.055、8.226、8.530μmol Pi/(mg prot· h);每日提高率分别为52.67%、9.21%、3.39%、1.06%、1.85%。氯化钠210mmol/L盐度处理后3、4、6、8、10d的,(Na+-K+)-ATPase活性分别为8.302、11.097、12.541、12.966、13.640μmol Pi/(mg prot·h);每日提高率分别为33.67%、6.51%、1.69%、2.60%。氯化钠280mmol/L盐度处理后4、6、8、10d的,(Na+-K+)-ATPase活性分别为12.604、14.077、18.134、18.166μmol Pi/(mg prot·h);每日提高率分别为5.84%、14.41%、0.09%。从以上的数据可以看出,虽然每个处理都是随着时间的延长(Na+-K+)-ATPase活性在不断提高,但日提高的幅度不同,各处理前4天提高的幅度比较大,其中,3、70、140mmol/L处理酶活性日提高量最大出现在第三天,分别达到了31.15%、35.44%和52.67%,210mmol/L处理酶活性日最大提高量(33.67%)出现在第四天,280mmol/L处理的出现在第八天。
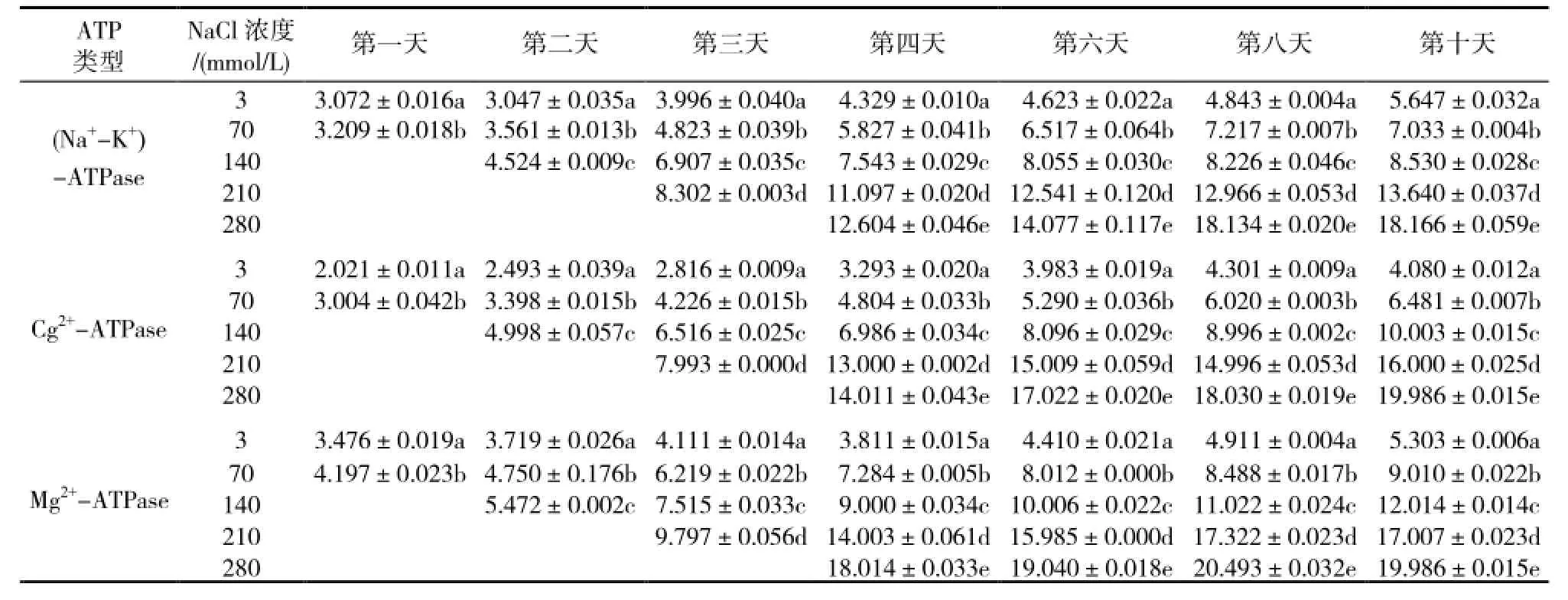
表1 盐胁迫下甜菜叶片ATPase活性随时间的动态变化
2.2NaCl胁迫下叶片中Ca2+-ATPase活性的动态变化
随着氯化钠浓度的提高,Ca2+-ATPase活性不断提高。NaCl浓度从3提高到70、140、210和280mmol/L,胁迫4天Ca2+-ATPase活性分别提高了45.89%、112.15%、294.78%和325.48%;胁迫6天Ca2+-ATPase活性分别提高了32.81%、103.26%、276.83%和327.37%;胁迫8天Ca2+-ATPase活性分别提高了39.97%、109.16%、248.66%和319.20%;胁迫10天Ca2+-ATPase活性分别提高了58.85%、145.17%、292.16%和389.85%。从胁迫4~10d每增加70mmol/L氯化钠所引起的酶活性增幅来看,210mmol/L处理Ca2+-ATPase活性提高的幅度较大,较前一处理平均提高了160.67%,140 mmol/L处理的次之,较前一处理提高了73.05%,70和280mmol/L处理Ca2+-ATPase活性分别提高了44.38%和62.37%。说明至210mmol/L处理时,Ca2+-ATPase活性增幅最大。
随着氯化钠胁迫时间的延长,同一处理Ca2+-ATPase活性不断提高。氯化钠3mmol/L正常处理1、2、3、4、6、8、10d的,Ca2+-ATPase活性分别为2.021、2.943、2.816、3.293、3.983、4.301、4.080μmol Pi/(mg prot·h);每日提高率分别为23.35%、12.96%、16.94%、10.48%、3.99%、-2.57%。氯化钠70mmol/L低盐度处理后1、2、3、4、6、8、10d的,Ca2+-ATPase活性分别为3.004、3.398、4.226、4.804、5.290、6.020、6.481μmol Pi/(mg prot·h);每日提高率分别为13.12%、24.37%、13.68%、5.06%、6.90%、3.83%。氯化钠140mmol/L盐度处理后2、3、4、6、8、10d的,Ca2+-ATPase活性分别为4.998、6.516、6.986、8.096、8.996、10.003μmol Pi/(mg prot·h);每日提高率分别为30.37%、7.21%、7.94%、5.56%、5.60%。氯化钠210mmol/L盐度处理后3、4、6、8、10d的,Ca2+-ATPase活性分别为7.993、13.000、15.009、14.996、16.000μmol Pi/(mg prot·h);每日提高率分别为62.64%、7.73%、-0.04%、3.35%。氯化钠280mmol/L盐度处理后4、6、8、10d的,Ca2+-ATPase活性分别为14.011、17.022、18.030、19.986μmol Pi/(mg prot·h);每日提高率分别为10.75%、2.96%、5.42%。从以上的数据可以看出,每个处理都是随着时间的延长Ca2+-ATPase活性在不断提高,各处理Ca2+-ATPase活性日最大提高率都是出现在达到试验设定浓度的后一天,其后随着时间的延长酶活性的日提高率有所降低,前4d酶活性日提高的幅度较大,多数都在10%以上,而后6d的日提高幅度有所降低,多数都低于10%。
2.3NaCl胁迫下叶片中M g2+-ATPase活性的动态变化
随着氯化钠浓度的提高,Mg2+-ATPase活性不断提高。NaCl浓度从3提高到70、140、210和280mmol/L,胁迫4天Mg2+-ATPase活性分别提高了91.13%、136.16%、267.44%和372.68%;胁迫6天Mg2+-ATPase活性分别提高了81.68%、126.89%、262.47%和331.75%;胁迫8天Mg2+-ATPase活性分别提高了72.84%、124.43%、252.72%和317.29%;胁迫10天Mg2+-ATPase活性分别提高了69.90%、126.55%、220.71%和276.88%。从胁迫4~10d每增加70mmol/L氯化钠所引起的酶活性的增幅来看,210mmol/L处理Mg2+-ATPase活性提高的幅度较大,较140 mmol/L处理平均提高了122.32%,70和280mmol/L处理的增幅相近,分别提高了78.89%和73.82%,140mmol/L处理Ca2+-ATPase活性提高的幅度最小,为49.62%。
随着氯化钠胁迫时间的延长,同一处理Mg2+-ATPase活性不断提高。氯化钠3mmol/L正常处理1、2、3、4、6、8、10d的,Mg2+-ATPase活性分别为3.476、3.719、4.111、3.811、4.410、4.911、5.303μmol Pi/(mg prot·h);每日提高率分别为6.99%、10.54%、-7.30%、7.86%、5.68%、3.99%。氯化钠70mmol/L低盐度处理后1、2、3、4、6、8、10d的,Mg2+-ATPase活性分别为4.197、4.75、6.219、7.284、8.012、8.488、9.010μmol Pi/(mg prot·h);每日提高率分别为13.18%、30.93%、17.12%、5.00%、2.97%、3.07%。氯化钠140mmol/L盐度处理后2、3、4、6、8、10d的,Mg2+-ATPase活性分别为5.472、7.515、9.000、10.006、11.022、12.014μmol Pi/(mg prot·h);每日提高率分别为37.34%、19.76%、5.59%、5.08%、4.50%。氯化钠210mmol/L盐度处理后3、4、6、8、10d的,Mg2+-ATPase活性分别为9.797、14.003、15.985、17.322、17.007μmol Pi/(mg prot·h);每日提高率分别为42.93%、7.08%、4.18%、-0.91%。氯化钠280mmol/L盐度处理后4、6、8、10d的,Mg2+-ATPase活性分别为18.014、19.040、20.493、19.986μmol Pi/(mg prot·h);每日提高率分别为2.85%、3.82%、-1.24%。从以上的数据可以看出,虽然每个处理都是随着时间的延长Mg2+-ATPase活性在不断提高,但各处理Mg2+-ATPase活性日提高幅度是随着时间的延长而降低的,3、280mmol/L盐度处理酶活性随着时间的延长没有大幅度的变化,日提高率绝大多数都在10%以下,而其余3个处理在前4d日提高幅度较大(13.18%~42.93%),其中210mmol/L盐度处理日提高率最大(42.93%),其后6d日提高幅度日益降低。
3 结论与讨论
盐胁迫导致植物离子含量失衡,有害离子如Na+、Cl-含量过度积累会对植物造成离子毒害,影响植物正常生长[9-10]。为了避免或减轻高浓度的盐害,植物或者将盐离子泵出细胞外,或者将盐离子区域化到液泡中,在此过程中ATPase起着非常重要的作用[11]。ATPase是一种广泛存在于生物体细胞内的代谢酶类[12-16],ATPase的活性在一定程度上可以反映出细胞的生活状态,这已被广泛用于植物逆境生理及发育调控研究中[17-18]。类囊体膜蛋白的结构维持和合成需要一定浓度的K+和低的Na+/K+,过量Na+抑制膜蛋白质合成[19]。这就需要ATPase调节Na+、K+等离子的含量。叶绿体偶联ATPase存在于叶绿体类囊体膜上,在膜内外质子梯度的推动下ATP为光合作用提供能量。依据其依赖的离子类型有(Na+-K+)-ATPase、Ca2+-ATPase和Mg2+-ATPase[8]。通过ATPase的运输调节作用,平衡膜内外离子含量[20]。研究发现NaCl处理导致这种酶的活性明显升高[21]。Ca2+-ATPase在逆境条件下可以将胞质Ca2+往质外体或细胞Ca2+库中运输,有利于保持胞质Ca2+稳态[22]。研究表明盐胁迫下,烟草悬浮细胞中耐盐品种的Ca2+-ATPase水平和Ca2+-ATPase基因表达均增加[23]。
本试验发现,盐胁迫下甜菜(Na+-K+)-ATPase、Ca2+-ATPase和Mg2+-ATPase活性均呈上升趋势,这说明ATPase在缓解盐离子胁迫对甜菜伤害的过程中扮演着非常重要的角色。植物为抵抗盐胁迫所带来的伤害,消耗了本可用于植物生长的物质和能量,影响了植株正常的生理代谢过程而阻碍了植株的生长。有研究表明向日葵在低浓度的盐胁迫后,ATPase活性显著升高,但在较高的盐浓度下ATPase活性降低[24]。章文华等人的试验表明,耐盐性较强的大麦品种,在NaCl l50~200mmol/L处理后ATPase活性增强[25]。通过以上几种作物的耐盐性比较证明了甜菜是耐盐性较强的作物。本试验中在70mmol/L处理中甜菜ATPase活性与对照组比较相近,在低盐环境下甜菜生长受盐害影响较低。但当盐浓度升至210mmol/L以上后甜菜ATPase活性上升显著,在高盐环境下甜菜显著提升ATPase活性以维持内稳态,抵御离子伤害以维持生长。结合以上结论表明:甜菜与其他作物相比可以在含盐量较大的土壤中良好生长,种植甜菜可以在很大程度上提高盐渍土壤的利用率,但是在高于210mmol/L以上的高盐环境中甜菜受影响较大,这为甜菜种植及耐盐品种筛选提供一定的理论依据。
[1]张飞,塔西甫拉提·特依拜,丁建丽,等.基于对应分析的土壤盐渍化现状特征及其与光谱关系研究[J].土壤学报,2009,46(3):513-519.
[2]张瑞军,韩旭,康艾.土壤盐渍化调查研究[J].西部资源,2014(1):186-187.
[3]卢秉福,韩卫平,祁勇.比较视角下的甜菜种植效益[J].中国农业资源与区划,2010,31(4):72-75.
[4]陈业婷,李彩凤,赵丽影,等.甜菜耐盐性筛选及其幼苗对盐胁迫的响应[J].植物生理学通讯,2010,46(11):1121-1128.
[5]宋立新,王瑞秀.离子转运ATPase的结构和功能[J].生理科学进展,1989(4):334-338.
[6]ZhangWenhua;Chen qin;Liu Youliang.Relationship Between H+-ATPase Activity and Fluidity of Tonoplast in Barley Roots Under NaCl Stress[J].Acta botanica sinica,2002,44(3):292-296.
[7]陈亚华,沈振国,刘友良.低温、高pH胁迫对水稻幼苗根系质膜、液泡膜ATP酶活性的影响[J].植物生理学报,2000,26(5):
407-412.
[8]郑翠兵.盐胁迫下甜菜碱对甜菜光合作用及抗氧化能力的影响[D].哈尔滨:黑龙江大学,2011.
[9]杨秀艳,张华新,张丽,等.NaCl胁迫对唐古特白刺幼苗生长及离子吸收、运输与分配的影响[J].林业科学,2013,49(9):165-171.
[10]耿贵,周建朝,孙立英,董殿文.不同盐度对甜菜生长和养分吸收的影响[J].中国甜菜糖业,2000(1):12-14.
[11]Mimura,Tetsur.Homeostasis and transportof inorganic Phosphate in Plants[J].Palnt Cell Physiol,1995,36(l):l-7.
[12]王启军,赵世民.代谢调控的新发现[J].科学通报,2010,55(21):2063-2067.
[13]杨蕊,关雪莲,张睿鹂,等.低温胁迫下北海道黄杨叶肉细胞Ca2+和Ca2+-ATPase的变化[J].园艺学报,2013,40(6):1139-1152.
[14]罗以筛.盐胁迫下植物质膜和液泡膜H+-ATPase活性的研究进展[J].安徽农业科学,2012,40(3):1263-1265+1280.
[15]陈雄伟,马艳萍,徐呈祥,徐锡增.多胺及其代谢抑制剂对盐胁迫下枣树叶绿体离子稳态和类囊体膜H+-ATPase活性的影响[J].中南林业科技大学学报,2012,32(10):1-8.
[16]胡锋,黄俊丽,秦峰,等.植物叶绿体类囊体膜及膜蛋白研究进展[J].生命科学,2011,23(3):291-298.
[17]刘友良,汪良驹.植物对盐胁迫的响应及其耐盐性[A].余叔文,汤章城.植物生理学与分子生物学[C].北京:科学出版社,1998:752-769.
[18]ZhangWH;Yu BJ;Chen Q;Liu YL.Tonoplast H+-ATPase activity in barley roots is regulated by ATPand pyrophosphate contents under NaCl stress[J].Journal of plant physiology andmolecular biology,2004,30(1):45-52.
[19]Ball,M C,Anderson JM.Sensitivity of photosystem II to NaCl in relation to salinity tolerance:Cooperative studieswith thylakoids of the salt-tolerantmangrove Avicenniasativum[J].Australia Journal of Plant Physiology,1986,13:689-693.
[20]Robinson SP,Downton W JS.Potassium,sodium and chloride ion concentrations in leaves and isolated chloroplasts of the halophyte Suaedaaustralis R.Br[J].Austrlian Journal of Plant Physiology,1985,12:471-479.
[21]史庆华,朱祝军,KhalidAl-aghabary,等.等渗盐胁迫对番茄抗氧化酶和ATPase及焦磷酸酶活性的影响[J].植物生理与分子生物学学报,2004,30(3):311-316.
[22]Douglas SB.Regulation of Cytosolic Calcium in Plants[J].J.Plant Physiol,1993,103:7-13.
[23]Perez PE,Narasimhan M L,Binze lM,et al.Induction of a putative Ca2+-ATPasemRNA in NaCladapted cells[J].J.Plant Physiol, 1992,100:1471-1478.
[24]Ballesteros E,DonaierJP,Belver A.Eeffct of salt stress on H+-ATPase and H+-ATPase aetivities of tonop lastenriehed vesicles isolated from sunflower roots[J].Physiol Plant,1996,97:259-268.
[25]ZhangWH,Chen Q,Liu YL.Relationship Between Tonoplast H+-ATPase Activity,Ion Uptake and Calcium in Barley Roots Under NaCl Stress[J].Acta botanica sinica,2002,44(3):292-296.
Dynam ic Changes in ATPase Activities in Sugarbeet Leaves under NaCl Stress
SUN Xue-wei3,GENG Gui1,2*,YU Li-hua1,2,ZHAO Hui-jie3,FU Ying-ying3,Liu Zhi-ting3,LIU Hui3
(1.Key Laboratory of SugarbeetGenetic Breeding,Colleges and Universities of Heilongjiang Province,Harbin 150080; 2.Sugarbeet Research Institute of Chinese Academy of Agricultural Sciences,Harbin 150080; 3.College of Life Science of Heilongjiang University,Harbin 150080)
Sugarbeet plants were cultivated in the hydroponics to investigate the stressful effects of different NaCl concentrations on sugarbeet leaves and dynamic changes on activities of(Na+-K+)-ATPase,Ca2+-ATPase and Mg2+-ATPase under saline stress.The results showed that:in comparison with the control group,the activities of(Na+-K+)-ATPase,Ca2+-ATPase and Mg2+-ATPase in leaves under the 70 mmol/L NaCl treatment was increased slightly.The ATPase activities of sugarbeet in the rest of treatment groups were increased significantly following the increase of NaCl concentrations.The activities of(Na+-K+)-ATPase,Ca2+-ATPase and Mg2+-ATPase of sugarbeet leaves fluctuate with prolonged time in each of the same treatment group.
sugarbeet;NaCl stress;ATPase activity;dynamic change
S566.3
A
1007-2624(2015)04-0024-04
10.13570/j.cnki.scc.2015.04.008
2014-12-30
国家自然科学基金项目(31271779);国家农产品质量安全风险评估专项经费(GJFP2015011)。
孙学伟(1990-),男,黑龙江省哈尔滨市人,硕士在读,主要研究方向:修复生态学,Email:910495880@qq.com
耿贵(1963-),男,黑龙江省安宁市人,博士,主要从事土壤与栽培研究,Email:genggui01@163.com

