特定序列寡核苷酸MT01对牙龈卟啉单胞菌感染的成骨细胞的增殖、细胞周期及凋亡的影响
于海蛟 申玉芹 刘引 高涵 周岳 胡天琦 林崇韬
吉林大学口腔医院牙周病科,长春 130021
牙周炎是牙周组织的一种慢性感染性疾病,菌斑微生物是其始动因子[1]。牙龈卟啉单胞菌是目前公认的牙周致病菌,其毒力因子可直接参与牙周支持组织的破坏以及间接引起宿主的免疫炎症反应[2],抑制成骨细胞分化及骨形成,从而导致牙槽骨吸收,造成牙齿丧失[3]。
特定序列寡核苷酸MT01是一类根据人线粒体DNA序列设计不含CG基序的单链寡脱氧核苷酸(oligodeoxynucleotides,ODN),为抑制性ODN,能够抑制由Toll样受体9(Toll-like receptors 9,TLR9)激活引起的机体固有免疫应答反应,维持机体的免疫平衡状态,防止组织细胞受损[4]。本课题组前期研究[5-6]表明,MT01具有促成骨细胞分化的功能,能够抑制实验性大鼠牙周炎导致的牙槽骨吸收。由此推测,MT01作为一种免疫抑制剂,可能会对牙周炎炎症免疫应答具有干预和调控作用。本实验采用牙龈卟啉单胞菌感染人成骨细胞MG63,研究MT01对感染状态下MG63细胞增殖、周期及凋亡等生物学特性的影响,旨在为进一步探讨MT01对牙周炎的调控作用奠定实验基础。
1 材料和方法
1.1 主要试剂
MT01及CpG ODN(吉林大学基础医学院分子生物学教研室设计,大连TaKaLa公司合成),甲硝唑氯化钠注射液(辽宁民康制药有限公司),硫酸庆大霉素注射液(济南利民制药有限责任公司);牙龈卟啉单胞菌W83菌株(首都医科大学口腔医学院口腔医学研究所惠赠);人成骨细胞MG63(吉林大学口腔医院口腔生物医学工程重点实验室提供)。HG-DMEM培养基(Hyclone公司,美国),胎牛血清(PAA公司,奥地利),胰酶(Hyclone公司,美国),脑心浸液琼脂(brain heart infusion,BHI)培养基(Gibco公司,美国);4,5-二甲基噻唑-2(4,5-dimethylthiazol-2-yl,MTT)试剂(Sigma公司,美国)。细胞周期检测试剂盒和Annexin-Ⅴ-FITC细胞凋亡试剂盒(上海七海复泰生物科技有限公司)。
1.2 牙龈卟啉单胞菌的培养
选择牙龈卟啉单胞菌W83作为实验菌株,将其接种于新鲜配制的BHI固态培养基(含5%无菌脱纤维羊血,5 μg·mL-1氯化血红素,1 μg·mL-1维生素K1),在37 ℃厌氧(80%N2,10%CO2,10%H2)条件下培养5~7 d,挑单克隆菌落接种于BHI液体培养基中培养48 h,在波长600 nm的紫外分光光度计下测定细菌密度,调制备用。
1.3 培养人成骨细胞MG63
选择MG63细胞作为实验细胞,复苏细胞于高糖DMEM培养基中(含10%胎牛血清),在CO2恒温细胞培养箱中37 ℃条件下培养。隔日换液,观察细胞生长状态,待细胞铺满底面积约80%时,按1∶3的比例传代培养。
1.4 合成特定序列MT01及CpG ODN
由大连TaKaLa公司合成特定序列的MT01以及CpG ODN,PBS溶解后-20 ℃保存备用。MT01序列:5'-ACCCCCTCTACCCCCTCTACCCCCTCT-3',CpG ODN序列:5'-TCGGGGACGATCGTCGGGGGG-3'。
1.5 MTT法检测细胞增殖
取对数生长期MG63细胞,胰酶消化,以每孔5×104个细胞的密度接种至96孔板,PBS边缘封闭。待细胞完全贴壁以后换无血清DMEM饥饿24 h,弃培养液,分别加入MT01(1 μg·mL-1)、CpG ODN(1 μg·mL-1)、甲硝唑(0.1 g·L-1)、庆大霉素(0.5 g·L-1),共孵育3 h后,各孔内以感染复数(multiplicity ofinfction,MOI)为100∶1的比例加入牙龈卟啉单胞菌,设立PBS作为空白对照,共分为6个组:空白对照组(PBS)、阴性对照组(仅加牙龈卟啉单胞菌)、实验组(MT01+牙龈卟啉单胞菌)、阳性对照A组(CpG ODN+牙龈卟啉单胞菌)、阳性对照B组(甲硝唑+牙龈卟啉单胞菌)、阳性对照C组(庆大霉素+牙龈卟啉单胞菌),每组4复孔。MTT法测定培养24 h和48 h细胞OD492值。
1.6 流式细胞仪检测细胞周期
取对数生长期MG63细胞,胰酶消化,以每孔1×105个细胞的密度接种至6孔板。待细胞完全贴壁后换无血清DMEM饥饿24 h,分组及加药方法同上。孵育24、48 h后,吸弃原培养液,收集细胞,预冷PBS洗涤1次,预冷70%乙醇4 ℃固定2 h,每孔加0.5 mL碘化丙啶(propidium iodide,PI)染色液染色,37 ℃避光温浴30 min,流式细胞仪检测细胞周期。实验重复3次。
1.7 流式细胞仪检测细胞凋亡率
取对数生长期MG63细胞,胰酶消化,以每孔1×105个细胞的密度接种至6孔板。待细胞完全贴壁后换无血清DMEM饥饿24 h,分组及加药方法同上。孵育24、48 h后,收集原孔板培养液终止消化细胞,PBS洗涤1次,Buffer洗涤2次,每孔5 μlAnnexin-Ⅴ-FITC避光室温孵育15 min,每孔10 μlPI染液避光冰浴5 min,流式细胞仪检测细胞凋亡率。实验重复3次。
1.8 统计学分析
用SPSS 17.0统计软件进行统计学分析,组间配对行t检验,检验水准为双侧α=0.05。
2 结果
2.1 MT01对感染状态下MG63增殖的影响
MT01对感染状态下MG63增殖的影响见图1。与空白对照组比较,阴性对照组、实验组以及阳性对照A组的细胞增殖明显升高(P<0.05),其中阴性对照组和实验组在48 h增殖显著升高(P<0.01),而阳性对照B组和C组在24 h和48 h增殖活性均低于空白对照组(P<0.05)。

图1 牙龈卟啉单胞菌感染MG63细胞24 h及48 h后各组MTT增殖结果Fig 1 MTT results of MG63 cells proliferation after cocultured with Porphyromonas gingivalis for 24 h and 48 h in various groups
2.2 MT01对感染状态下MG63细胞周期的影响
与空白对照组比较,各组培养24 h的G1期细胞百分比均增加(P<0.05);但与阴性对照组比较,实验组和阳性对照A组的G1期细胞百分比明显降低,S期细胞百分比明显升高(P<0.05)(图2)。培养48 h时,阴性对照组S期细胞百分比明显低于空白对照组,而其他各组G1期细胞百分比均低于阴性对照组,而S期细胞百分比均增高(P<0.05)(图3)。
2.3 MT01对感染状态下MG63细胞凋亡的影响
各组细胞培养24 h和48 h的凋亡检测结果和凋亡率见图4、5和表1。

图2 牙龈卟啉单胞菌感染MG63细胞24 h后各组细胞的细胞周期Fig 2 The results of MG63 cell cycles after cocultured with Porphyromonas gingivalis for 24 h in various groups

图3 牙龈卟啉单胞菌感染MG63细胞48 h后各组细胞的细胞周期Fig 3 The results of MG63 cell cycles after cocultured with Porphyromonas gingivalis for 48 h in various groups

图4 牙龈卟啉单胞菌感染MG63细胞24 h后各组细胞凋亡的检测结果Fig 4 The results of MG63 cells apoptosis after cocultured with Porphyromonas gingivalis for 24 h in various groups
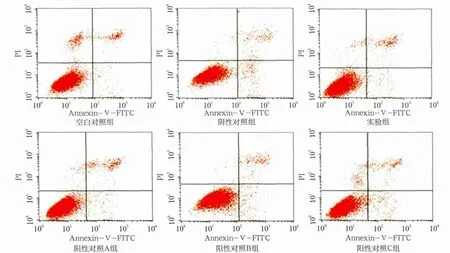
图5 牙龈卟啉单胞菌感染MG63细胞48 h后各组细胞凋亡的检测结果Fig 5 The results of MG63 cells apoptosis after cocultured with Porphyromonas gingivalis for 48 h in various groups
表1 牙龈卟啉单胞菌感染MG63细胞24 h及48 h后各组细胞的凋亡率Tab 1 Apoptotic rates of MG63 cells after cocultured with Porphyromonas gingivalis for 24 h and 48 h in various groups %,±s
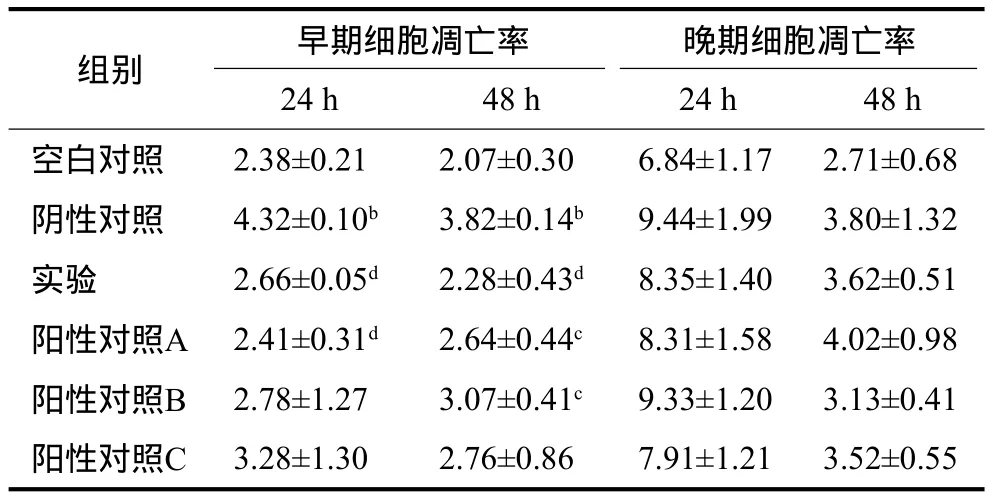
表1 牙龈卟啉单胞菌感染MG63细胞24 h及48 h后各组细胞的凋亡率Tab 1 Apoptotic rates of MG63 cells after cocultured with Porphyromonas gingivalis for 24 h and 48 h in various groups %,±s
注:b与空白对照组比较,P<0.01;c与阴性对照组比较,P<0.05;d与阴性对照组比较,P<0.01。
组别 早期细胞凋亡率 晚期细胞凋亡率24 h 48 h 24 h 48 h空白对照 2.38±0.21 2.07±0.30 6.84±1.17 2.71±0.68阴性对照 4.32±0.10b 3.82±0.14b 9.44±1.99 3.80±1.32实验 2.66±0.05d 2.28±0.43d 8.35±1.40 3.62±0.51阳性对照A 2.41±0.31d 2.64±0.44c 8.31±1.58 4.02±0.98阳性对照B 2.78±1.27 3.07±0.41c 9.33±1.20 3.13±0.41阳性对照C 3.28±1.30 2.76±0.86 7.91±1.21 3.52±0.55
细胞培养24 h,阴性对照组细胞的早期凋亡率明显升高,高于空白对照组(P<0.01),而实验组、阳性对照A组细胞早期凋亡率明显低于阴性对照组(P<0.05)。培养48 h,阴性对照组的细胞早期凋亡率仍然较高,高于空白对照组(P<0.01),除阳性对照C组,其余各组细胞的早期凋亡率均低于阴性对照组(P<0.05)。
3 讨论
研究表明,在慢性牙周炎局部牙周组织中,牙龈卟啉单胞菌可入侵牙槽骨内成骨细胞,通过调控成骨细胞内核激活因子κB受体配体(receptor activator of nuclear kappa B ligand,RANKL)、骨保护素(osteoprotegerin,OPG)、核心结合因子-1 (core binding factor-1,Cbfa-1)和成骨细胞特异性转录因子osterix表达水平,抑制成骨细胞的成熟及矿化,影响牙槽骨形成,导致牙槽骨吸收[7-10]。本课题组前期工作证实,MT01经由上调成骨细胞MG63细胞内OPG与RANKL比值来促进成骨细胞的增殖和分化[11],具有抑制实验性大鼠牙周炎牙槽骨吸收的作用[6]。目前,MT01对牙龈卟啉单胞菌感染状态下的成骨细胞是否具有影响作用尚不清晰,因此本研究分别选取刺激性ODN(一种富含未甲基化CG基序的ODN,称为CpG ODN)[12]以及临床用于治疗慢性牙周炎的硝基咪唑类药物(甲硝唑)和用于治疗细菌感染的氨基糖苷类抗生素(庆大霉素)作为抑制性ODN MT01的阳性对照[13],选取单纯牙龈卟啉单胞菌感染作为阴性对照,评价MT01对感染状态的成骨细胞增殖、周期及凋亡等生物学特性的影响,进一步探讨MT01用于治疗牙周炎的可行性。
本实验发现,MT01可以促进牙龈卟啉单胞菌感染的MG63增殖,降低感染的MG63于Gl期阻滞的现象,并促进细胞进入S期,其作用与CpG ODN相近,远优于甲硝唑及庆大霉素。已有研究[14-15]证实,MT01能够促进成骨细胞活化,促使成骨细胞进入S期,提高其细胞增殖活性。本研究结果进一步提示,在正常或感染状态下,MT01对成骨细胞具有较稳定的促增殖作用,此作用可能与其细胞进入S期和DNA复制合成相关。成骨细胞的凋亡可导致骨动态平衡中骨形成不足,造成骨吸收[16],而成骨细胞凋亡的改变在不同程度上参与了牙周炎的发生、发展过程[17]。本实验结果表明,MT01可抑制牙龈卟啉单胞菌感染的MG63早期凋亡,证实MT01对于感染状态下的成骨细胞凋亡有一定的抑制作用。
分析MT01对MG63增殖、周期及凋亡影响的检测结果可以发现,MT01对感染及非感染状态的成骨细胞生物学性能均具有调控作用,可能与已证实的MT01促进成骨细胞分化相关联。今后将继续进行相关研究,进一步验证MT01对牙周致病菌导致的牙槽骨吸收的影响和调控。
[1]Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation[J]. Nat Rev Immunol, 2015,15(1):30-44.
[2]Darout IA. Oral bacterial interactions in periodontal health and disease[J]. J Dent Oral Hyg, 2014, 6(5):51-57.
[3]Kato H, Taguchi Y, Tominaga K, et al.Porphyromonas gingivalisLPS inhibits osteoblastic differentiation and promotes pro-inflammatory cytokine production in human periodontal ligament stem cells[J]. Arch Oral Biol, 2014, 59(2):167-175.
[4]Yang G, Wan M, Zhang Y, et al. Inhibition of a C-rich oligodeoxynucleotide on activation ofimmune cellsin vitroand enhancement of antibody response in mice[J]. Immunology, 2010, 131(4):501-512.
[5]Hou X, Shen Y, Zhang C, et al. A specific oligodeoxynucleotide promotes the differentiation of osteoblasts via ERK and p38 MAPK pathways[J]. Int J Mol Sci, 2012, 13(7):7902-7914.
[6]Shen Y, Feng Z, Lin C, et al. An oligodeoxynucleotide that induces differentiation of bone marrow mesenchymal stem cells to osteoblastsin vitroand reduces alveolar bone loss in rats with periodontitis[J]. Int J Mol Sci, 2012, 13(3):2877-2892.
[7]Zhang W, Swearingen EB, Ju J, et al.Porphyromonas gingivalisinvades osteoblasts and inhibits bone formation[J].Microbes Infect, 2010, 12(11):838-845.
[8]Zhang W, Ju J, Rigney T, et al.Porphyromonas gingivalisinfection increases osteoclastic bone resorption and osteoblastic bone formation in a periodontitis mouse model[J].BMC Oral Health, 2014, 14:89.
[9]Dittmann C, Doueiri S, Kluge R, et al.Porphyromonas gingivalissuppresses differentiation and increases apoptosis of osteoblasts from New Zealand obese mice[J]. J Periodontol, 2015, 86(9):1095-1102.
[10]Hienz SA, Paliwal S, Ivanovski S. Mechanisms of bone resorption in periodontitis[J]. J Immunol Res, 2015:615486.
[11]Feng Z, Shen Y, Wang L, et al. An oligodeoxynucleotide with promising modulation activity for the proliferation and activation of osteoblast[J]. Int J Mol Sci, 2011, 12(4):2543-2555.
[12]Wang X, Bao M, Wan M, et al. A CpG oligodeoxynucleotide acts as a potent adjuvant for inactivated rabies virus vaccine[J]. Vaccine, 2008, 26(15):1893-1901.
[13]Pischon N, Röhner E, Hocke A, et al. Effects ofPorphyromonas gingivalison cell cycle progression and apoptosis of primary human chondrocytes[J]. Ann Rheum Dis, 2009,68(12):1902-1907.
[14]张丽茹. 寡核苷酸 MT01 对成骨细胞 TLR-9, IL-1 及 TNF-α mRNA表达的影响[D]. 长春: 吉林大学, 2013:19.
[15]冯志远. 寡核苷酸 (ODN) 促成骨细胞增殖活化的作用及机制研究[D]. 长春: 吉林大学, 2011:51-54.
[16]Marchini AM, Gonçalves LL, Salgado MC, et al. Alcoholic and isocaloric diet, but not ovariectomy, influence the apoptosis of bone cells within the alveolar bone crest of rats[J].Arch Oral Biol, 2014, 59(4):424-433.
[17]Intini G, Katsuragi Y, Kirkwood KL, et al. Alveolar bone loss: mechanisms, potential therapeutic targets, and interventions[J]. Adv Dent Res, 2014, 26(1):38-46.

