钙调神经磷酸酶-T细胞核因子信号通路在应力诱导成肌细胞凋亡中的作用
丁弦 夏晨蕾 贺苗 孙文娜 王芳 姜文心张彩霞 王爽玉 张强 姚如永 袁晓
1.青岛大学医学院附属青岛市立医院口腔医学中心,青岛 266075;2.青岛大学医学院附属医院中心实验室,青岛 266003
颌面部肌肉组织在错 畸形的发生、发展、矫治和疗效维持中发挥重要作用。临床上,正畸医生通过调控矫形力来牵张咀嚼肌,影响牙齿、颌骨及颞下颌关节的改建,进而使软硬组织发生适应性变化,重建新的功能平衡,达到预防错 畸形及调控生长的目的[1-2]。在此过程中,成肌细胞作为适应性改建的主要体现者,明确其力学信号转导机制对于阐明功能矫形时面颌部肌肉组织的适应性改建机制有重要意义[3]。本课题前期研究已证实,周期性张应力可诱导成肌细胞凋亡,在凋亡过程中Ca2+作为细胞内信号转导分子之一,具有重要的作用[4]。研究发现,钙调神经磷酸酶(calcineurin,CaN)作为现阶段发现的唯一受Ca2+/钙调素(calmodulin,CaM)调节的磷蛋白磷酸酶,其介导的信号通路与细胞凋亡关系密切,在细胞信号传递过程中直接受Ca2+的调节,通过其重要底物活化T细胞核因子(nuclear factor of activated T cells,NFAT)去磷酸化和核内转位发挥功能调节作用。CaN-NFAT信号通路是内质网应激的一条重要通路,本研究拟在周期性张应力作用下明确CaN-NFAT信号通路在成肌细胞凋亡中的作用,进一步探明应力作用下成肌细胞适应性改建的分子机制,为功能矫形提供理论支持。
1 材料和方法
1.1 材料和仪器
大鼠L6成肌细胞株,购自中国科学院上海生科院细胞资源中心。胎牛血清、胰蛋白酶(Hyclone公司,美国),Annexin V-FITC/PI细胞凋亡试剂盒(北京嘉美诺斯生物科技有限公司),RT-PCR试剂盒、Trizol提取试剂盒(Takara公司,日本),半胱天冬氨酸蛋白酶9兔抗大鼠抗体(Abcam公司,英国),BioFlex弹性细胞培养板(Flexcell公司,美国)。
1.2 细胞培养
将成肌细胞按1×107·L-1的浓度接种于培养瓶中,加入含体积分数10%的胎牛血清、双抗,配成最终浓度为100 UI·mL-1的高糖DMEM培养液,在CO2孵箱中37 ℃、5%CO2、95%空气、饱和湿度下培养。48 h换液一次,并通过倒置相差显微镜观察成肌细胞生长状况及变化。待细胞生长至培养瓶底80%以上时进行传代。
1.3 成肌细胞体外培养—力学刺激模型的构建
选择对数生长期传至第3代左右的成肌细胞胰酶消化后,进行细胞计数,将接种密度调整到3×105·mL-1后接种至BioFlex培养板,放置于37 ℃、5%CO2培养箱内培养1~2 d,当细胞融合达80%以上时,用低血清浓度(含体积分数为3%胎牛血清的DMEM)的培养液继续培养24 h。
将成肌细胞分为加力组和对照组,利用多通道应力加载系统对加力组细胞分别施加1、2、6、12、24 h频率为10 cycles·min-1、15%细胞形变的张应力,每一循环包括3 s拉伸和3 s松弛;对照组放在同一培养箱内不加力(即加力0 h)。应力结束后,于倒置相差显微镜下观察成肌细胞生长状况以及形态变化。
1.4 Hoechst 33258染色法检测成肌细胞凋亡
2组细胞加入固定液固定10 min,冲洗完后向培养板中加入Hoechst 33258染色液,染色5 min,于荧光显微镜(激发波长350 nm,发射波长460 nm)下观察细胞凋亡情况。将CaN的特异性抑制剂环孢素(cyclosporin A,CsA)加入24 h(加抑制剂组)后,观察细胞凋亡情况。每组重复3次。
1.5 流式细胞术检测成肌细胞凋亡
2组细胞弃旧培养液,PBS洗两遍,用不含EDTA的胰酶消化后收集细胞至离心管中,再按照Annexin V-FITC/PI试剂盒说明书进行标记,在室温下避光染色15 min后用流式细胞仪检测细胞凋亡。在加力24 h的成肌细胞中加入CsA(加抑制剂组)后,再次检测细胞凋亡。每组重复3次。
1.6 实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)检测CaN和NFAT mRNA的表达情况
收集2组细胞,按照Gibco BRL公司的说明书提取细胞总RNA,分光光度计测量RNA的浓度和纯度,利用反转录试剂盒将RNA反转录为cDNA,将得到的反应液加入到real-time PCR的反应体系中,再对上海生工生物技术有限公司合成的引物进行PCR扩增反应,检测CaN和NFAT mRNA的表达情况。2组细胞中加入CsA后,再次检测CaN和NFAT mRNA的表达情况。各因子的引物见表1。

表1 real-time PCR各因子引物Tab 1 Primers of genes used in real-time PCR
1.7 蛋白质印迹法(western blot)检测NFAT3的蛋白含量
收集2组细胞,使用裂解液提取总蛋白,采用BCA蛋白浓度测定试剂盒测定蛋白浓度,各组取等量蛋白上样,电泳分离后转移至PVDF膜上,封闭后将一抗与一抗稀释液按比例混匀后与PVDF膜4 ℃过夜,PBST冲洗3遍;再将配好的二抗稀释液和膜在摇床上摇动孵育1 h,用PBST冲洗3遍。加显影液后放入计算机显影系统内,将蛋白的表达量拍照,并保存记录。2组细胞中加入CsA后,再重复上述步骤。对图像进行分析并计算灰度值。
1.8 统计学分析
采用SPSS 17.0软件进行分析,对数据进行方差分析和配对t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 成肌细胞体外培养力学刺激模型的构建
倒置相差显微镜下观察可见,对照组成肌细胞贴壁良好,但排列方向杂乱无章;加力组细胞贴壁良好且生长状态佳,无明显变性、脱落;随着加力时间的延长,成肌细胞逐渐顺应力场方向排列,且呈时间依赖性(图1)。成肌细胞体外培养—力学刺激模型构建成功。

图1 各组成肌细胞的形态 倒置相差显微镜 × 400Fig 1 Myoblasts morphology of every group inverted phase contrast microscope × 400
2.2 Hoechst 33258染色检测成肌细胞凋亡
对照组成肌细胞的胞核清晰且呈卵圆形,染色质分布均匀,发出淡蓝色荧光;加力组出现凋亡细胞,胞核发生固缩,发出致密浓染的亮蓝色荧光,个别颜色发白,随加力时间的延长,凋亡现象越发明显;加抑制剂组凋亡细胞明显比加力24 h组减少,说明CsA能有效抑制细胞凋亡(图2)。

图2 各组成肌细胞的形态 Hoechst 33258染色 × 400Fig 2 Myoblasts morphology of every group Hoechst 33258 staining × 400
2.3 流式细胞术检测成肌细胞凋亡
流式细胞术检测发现,对照组细胞的凋亡率为(4.47±0.93)%,加力1、2、6、12、24 h组的细胞凋亡率分别为(5.83±0.26)%、(6.56±0.34)%、(6.93±0.52)%、(7.75±0.15)%、(8.17±0.28)%,加抑制剂组的细胞凋亡率为(2.17±0.13)%。统计分析表明,加力组与对照组之间的细胞凋亡率有统计学差异(P<0.05)。随加力时间的延长,细胞凋亡率及死细胞比率逐渐升高,24 h达到高峰。与单纯加力24 h组相比,加抑制剂组的细胞凋亡率和死细胞比率均下降,而活细胞比率有所上升(图3)。
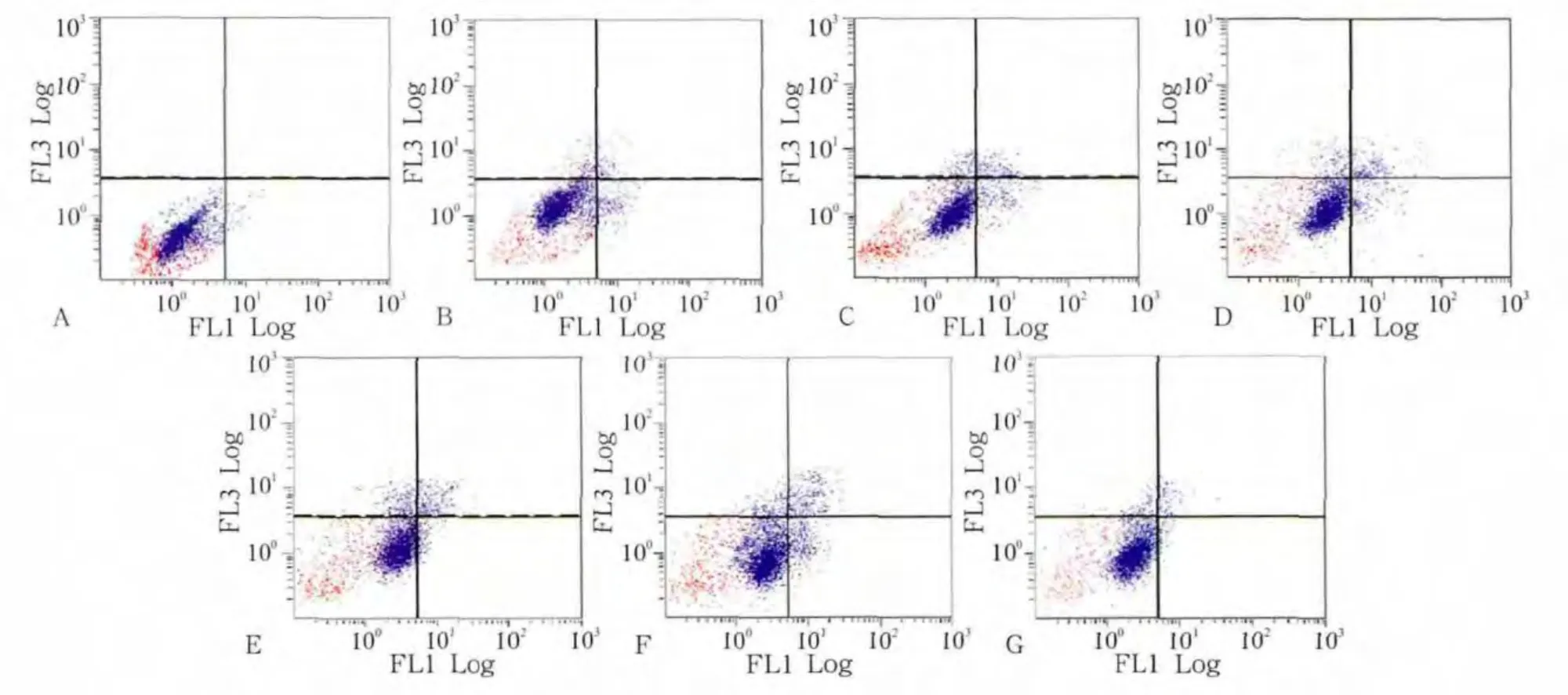
图3 各组成肌细胞流式细胞仪检测结果Fig 3 Flow cytometry analysis in myoblasts of every group
2.4 real-time PCR检测CaN和NFAT的mRNA表达
real-time PCR检测结果表明,随着加力时间的延长,CaN亚基CnA、CnB及NFAT3的mRNA表达量逐渐升高,24 h达到峰值,与对照组相比有统计学差异(P<0.05);而NFAT4的mRNA表达无统计学差异。在相同加力时间情况下,加入抑制剂后,CnA、NFAT3的mRNA表达比不加抑制剂减少,有统计学差异(P<0.05),CnB的mRNA仅在加力24 h时比不加抑制剂减少,具有统计学差异(P<0.05),NFAT4的mRNA表达2组间无统计学差异(图4)。

图4 各组成肌细胞CaN和NFAT的mRNA表达变化的比较Fig 4 Comparison of expression of CaN and NFAT mRNA in myoblasts of every group
2.5 蛋白质印迹法检测NFAT3的蛋白含量
蛋白质印迹法检测结果表明,随着加力时间的延长,NFAT3蛋白含量逐渐升高,24 h达到峰值,在12、24 h时与对照组相比具有统计学差异(P<0.05);加入抑制剂后,NFAT3的蛋白含量明显受到抑制,与相同加力时间的对应组之间均有统计学差异(P<0.05)(图5)。

图5 各组成肌细胞NFAT3蛋白量的相对灰度值Fig 5 Relative gray value of NFAT3 protein in myoblasts of every group
3 讨论
临床上正畸医生通过功能矫形治疗对生长发育期儿童施加生物力来引起肌肉形态和功能的变化,但其具体的作用机制尚不明确。本课题前期研究发现,内质网应激介导的细胞凋亡参与了面颌部肌肉组织的适应性改建,在此过程中Ca2+起到了十分重要的作用[5]。内质网是细胞内重要的Ca2+处理器,可以调控细胞内Ca2+的摄取、存储和释放。研究发现,当细胞受到某些刺激时,胞内游离的Ca2+浓度会迅速升高,从而因Ca2+超载引发内质网应激,进而发生核酸内切酶的活化、DNA断裂等,导致细胞凋亡;反之,当细胞外的Ca2+缺乏或者细胞内的Ca2+螫合时,可以抑制内质网应激的发生,进而减少细胞凋亡。
CaN是一种保守蛋白,由一个相对分子质量为61×103的催化亚基CnA和一个相对分子质量为19×103的调节亚基CnB紧密结合而成,是目前所发现的唯一的一种受Ca2+/钙调素调节的磷蛋白磷酸酶[6]。CaN介导的信号通路与细胞凋亡关系密切。通过对心肌细胞、神经元、癌细胞及淋巴细胞系的研究[7-10]发现,CaN被激活后具有促凋亡和抗凋亡的双重作用。因此,在细胞类型、刺激种类或强度不同的情况下,CaN所产生的细胞生物学效应也可能不同。
NFAT是介导细胞内信号转导的一种能够快速诱导的核因子,可以调节大量基因的表达[11-14]。目前已知的NFAT家族有5个成员,其中NFAT1、NFAT2、NFAT4主要存在于免疫组织中,NFAT3主要存在于其他组织细胞(如心脏)中[15]。NFAT的活化可以调节许多细胞因子的信号转导,从而干预某些疾病的发生、发展。
本研究应用Hoechst 33258染色及流式细胞术检测周期性张应力下成肌细胞凋亡情况,发现成肌细胞凋亡率随应力加载时间的延长而升高,说明周期性张应力可诱导细胞凋亡。real-time PCR及蛋白质印迹法研究结果发现,随着加力时间的延长,CnA、CnB及NFAT3的mRNA表达量及NFAT3的蛋白含量逐渐升高,24 h达峰值(P<0.05),而NFAT4的mRNA表达量无明显变化,这一结果可能与NFAT4主要存在于免疫组织而在其他组织中较少表达有关。加入CaN特异性抑制剂CsA后,CnA、NFAT3的mRNA表达量及NFAT3的蛋白含量明显受到抑制,与各自对应对照组相比有统计学差异,CnB的mRNA仅在加力24 h组差异具有统计学意义,而NFAT4的mRNA表达量无明显变化,说明CsA可以抑制CaN催化亚基CnA的表达,但对CaN调节亚基CnB的表达仅在其浓度较高时有部分抑制作用。由此可以看出,CaN与NFAT3在应力介导的成肌细胞凋亡过程中发挥了一定作用, CaN-NFAT3信号通路可能参与了应力介导的成肌细胞凋亡,但其确切机制尚需进一步深入研究。
[1]Lee DH, Yu HS. Masseter muscle changes following orthognathic surgery: a long-term three-dimensional computed tomography follow-up[J]. Angle Orthod, 2012, 82(5):792-798.
[2]Yagci A, Uysal T, Kara S, et al. The effects of myofunctional appliance treatment on the perioral and masticatory muscles in ClassⅡ, Division 1 patients[J]. World J Orthod,2010, 11(2):117-122.
[3]Sanchez-Esteban J, Wang Y, Cicchiello LA, et al. Cyclic mechanical stretch inhibits cell proliferation and induces apoptosis in fetal rat lung fibroblasts[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 282(3):L448-L456.
[4]温葭, 陈士林, 徐宏喜, 等. 葛根素对细胞凋亡影响的研究[J]. 现代中药研究与实践, 2006, 20(1):61-64.
[5]张强, 王洪玲, 丁弦, 等. 成肌细胞体外培养-力学刺激模型与周期性张应力的影响[J]. 中国组织工程研究, 2014,18(5):669-674.
[6]张荣成, 王萌萌, 王建春. 钙调神经磷酸酶信号通路在心肌肥厚中的作用[J]. 心血管病学进展, 2007, 28(2):321-324.
[7]Bueno OF, Lips DJ, Kaiser RA, et al. Calcineurin Abeta gene targeting predisposes the myocardium to acute ischemiainduced apoptosis and dysfunction[J]. Circ Res, 2004, 94(1):91-99.
[8]Jayaraman T, Marks AR. Calcineurin is downstream of the inositol 1,4,5-trisphosphate receptor in the apoptotic and cell growth pathways[J]. J Biol Chem, 2000, 275(9):6417-6420.
[9]Tombal B, Weeraratna AT, Denmeade SR, et al. Thapsigargin induces a calmodulin/calcineurin-dependent apoptotic cascade responsible for the death of prostatic cancer cells[J]. Prostate, 2000, 43(4):303-317.
[10]De Windt LJ, Lim HW, Taigen T, et al. Calcineurin-mediated hypertrophy protects cardiomyocytes from apoptosisin vitroandin vivo: an apoptosis-independent model of dilated heart failure[J]. Circ Res, 2000, 86(3):255-263.
[11]Crabtree GR, Olson EN. NFAT signaling: choreographing the social lives of cells[J]. Cell, 2002, 109(Suppl):S67-S79.
[12]Horsley V, Pavlath GK. NFAT: ubiquitous regulator of cell differentiation and adaptation[J]. J Cell Biol, 2002, 156(5):771-774.
[13]GraefiA, Wang F, Charron F, et al. Neurotrophins and netrins require calcineurin/NFAT signaling to stimulate outgrowth of embryonic axons[J]. Cell, 2003, 113(5):657-670.[14]Hill-Eubanks DC, Gomez MF, Stevenson AS, et al. NFAT regulation in smooth muscle[J]. Trends Cardiovasc Med,2003, 13(2):56-62.
[15]Luik RM, Lewis RS. New insights into the molecular mechanisms of store-operated Ca2+signaling in T cells[J]. Trends Mol Med, 2007, 13(3):103-107.

