利格列汀对2型糖尿病大鼠代谢性内毒素血症的影响
潘道延 沈洁 朱筱 赵德福 陈志 韩亚娟 李文婷 陈远程
利格列汀对2型糖尿病大鼠代谢性内毒素血症的影响
潘道延 沈洁 朱筱 赵德福 陈志 韩亚娟 李文婷 陈远程
目的 探讨利格列汀对高脂饮食联合小剂量链脲佐菌素(STZ)诱导的2型糖尿病大鼠代谢性内毒素血症的影响。方法 30只健康雄性Sprague-Dawley大鼠按随机数字法选择10只作为正常对照组,以正常饲料喂养,其余20只以高脂饲料饲喂8周后,予一次性腹腔注射STZ(35mg/kg)制备2型糖尿病模型。将造模成功大鼠共16只按随机数字法分为利格列汀干预组(3mg·kg-1·d-1灌胃,n=8)和糖尿病对照组(等量生理盐水灌胃,n=8),干预4周后测定大鼠空腹血糖、空腹胰岛素(FINS)、甘油三酯、总胆固醇、门静脉血浆脂多糖、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、二胺氧化酶(DAO)的水平,计算稳态模型评估-胰岛素敏感指数(HOMA-ISI)及稳态模型评估-胰岛素抵抗指数(HOMA-IR)。结果 与正常对照组相比,糖尿病对照组空腹血糖、FINS、HOMA-IR、甘油三酯、总胆固醇及体重等指标明显升高,ln(HOMA-ISI)明显降低,而利格列汀干预组上述指标除体重外较糖尿病对照组均有改善(F=39.18~136.74,P均<0.01)。糖尿病对照组门静脉血浆脂多糖、TNF-α、IL-6、血浆DAO水平明显高于正常对照组,而利格列汀干预组上述指标较糖尿病对照组有所下降(F=18.13~51.43,P均<0.05)。结论 利格列汀可以改善高脂饮食联合STZ诱导的2型糖尿病大鼠代谢性内毒素血症,并减轻全身系统性炎性反应。
利格列汀;2型糖尿病;代谢性内毒素血症;炎症
代谢性内毒素血症是指血循环中脂多糖水平较正常高2~3倍的一种低度炎性反应状态[1]。近年越来越多的研究表明,由高脂饮食介导的代谢性内毒素血症参与了胰岛素抵抗、肥胖及2型糖尿病等的发生、发展,降低血浆脂多糖含量可以明显减轻全身系统性的炎性反应并改善胰岛素抵抗状态[2-3]。二肽基肽酶-4(DPP-4)抑制剂作为一种新型降糖药物,因其可以抑制DPP-4对胰高血糖素样肽-1的水解,增加其在体内的作用时间,从而产生降糖作用,但随着研究的深入,逐渐发现其除了降糖之外还有其他广泛的作用,如降血脂、改善炎性反应、促进伤口愈合等[4-5]。本研究拟观察新型DPP-4抑制剂利格列汀对高脂饮食联合小剂量链脲佐菌素(STZ)诱导的2型糖尿病大鼠代谢性内毒素血症的影响。
1 材料与方法
1.1 实验动物及2型糖尿病模型的建立 30只SPF级雄性Sprague-Dawley大鼠,体重180~200 g,购自南方医科大学实验动物中心[批号为SCXK(粤)2011-0015]。大鼠自由进食进水,交替照明12 h,垫料每天更换。适应性饲喂1周后,按照随机数字法选择10只作为正常对照组,予普通饲料喂养。其余20只准备造模,予高脂饲料喂养。高脂饲料由标准大鼠饲料中添加10%的蔗糖,20%的熟猪油,2%的胆固醇,0.5%的猪胆盐组成,高脂饲料每天更换。第8周末准备造模大鼠禁食12 h,腹腔注射小剂量STZ(35mg/kg)进行2型糖尿病造模,正常对照组仅腹腔注射等体积柠檬酸-柠檬酸钠缓冲液。72 h后,所有大鼠禁食12 h后断尾取血0.5ml,测空腹血糖、空腹胰岛素(FINS),以随机血糖≥11.1mmol/L作为2型糖尿病的诊断标准[6]。
1.2 实验分组及干预 第8周末造模后,72 h内有4只动物死亡,剩余16只动物存活且随机血糖均大于11.1mmol/L,提示造模成功。将成功造模的大鼠按照随机数字法分为糖尿病对照组(n=8)及利格列汀干预组(n=8)。正常对照组给予标准饲料+0.9%生理盐水3ml·kg-1·d-1灌胃,糖尿病对照组给予高脂饲料+0.9%生理盐水3 ml·kg-1·d-1灌胃,利格列汀干预组给予高脂饲料+1mg/ml利格列汀溶液3ml·kg-1·d-1灌胃,共干预4周[7]。观察各组大鼠食欲、毛发、大小便、行为及整体状态情况,根据大鼠体重调整给药剂量。灌胃药液均每天配制。
1.3 主要试剂 STZ、二胺氧化酶(DAO)酶联免疫吸附试验(ELISA)检测试剂盒均购于美国Sigma公司,柠檬酸、柠檬酸钠、生理盐水等均由实验室提供。利格列汀片(5mg/片)由勃林格殷格翰公司馈赠。显色基质鲎试剂盒购于厦门鲎实验厂有限公司,大鼠胰岛素、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6采用美国Linco公司的ELISA试剂盒检测。
1.4 样本采集 12周末,末次给药后,所有大鼠空腹过夜,称量体重。以10%水合氯醛,0.35ml/100 g腹腔注射进行麻醉,经门静脉取血分别置于EDTA-K2抗凝管及无热原的肝素抗凝管中,4℃离心(3 500 r/min,r=8.6 cm)15min,取上清,-20℃保存,用于各项指标的测定。
1.5 指标检测 空腹血糖、甘油三酯、总胆固醇采用日立7600全自动生化仪检测;ELISA法检测血浆胰岛素,计算稳态模型评估-胰岛素敏感指数(HOMA-ISI)、稳态模型评估-胰岛素抵抗指数(HOMA-IR)。公式计算:HOMA-ISI=1/(空腹血糖×FINS);HOMA-IR=(空腹血糖×FINS)/22.5(空腹血糖单位为mmol/L;FINS单位为m IU/L)。利用鲎试剂采用基质显色偶氮法严格执行无热原操作检测血浆脂多糖含量;ELISA检测血浆TNF-α、IL-6及DAO水平。
1.6 统计学处理 采用SPSS19.0统计软件分析数据,GraphPad Prism 6作图,数据以均数±标准差表示,进行正态性、方差齐性检验,若资料符合正态性、方差齐,多样本均数比较采用完全随机设计的方差分析,组间比较采用LSD检验;方差不齐时多样本均数比较采用近似F检验的Welch法;组间比较采用非参数检验的Tamhane'sT2法;HOMA-ISI取自然对数纳入统计分析;以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况比较 造模及药物干预过程中,正常对照组活动正常,毛发整齐。糖尿病对照组活动减少,精神萎靡,多尿且毛发暗淡凌乱,利格列汀干预组与糖尿病对照组相比,尿量减少,毛发相对整齐。
2.2 各组体重、血糖及胰岛素等指标比较 与正常对照组相比,糖尿病对照组及利格列汀干预组体重、空腹血糖、FINS、HOMA-IR均明显升高(P均<0.05),而 ln(HOMA-ISI)明显降低(P<0.01);与糖尿病对照组相比,利格列汀干预组空腹血糖、FINS、HOMAIR 显著降低(P 均<0.01),而 ln(HOMA-ISI)明显升高(P<0.01),体重无明显变化,见表1。
2.3 各组血脂变化情况 与正常对照组相比,糖尿病对照组及利格列汀干预组血浆甘油三酯及总胆固醇水平均明显升高(P均<0.05);与糖尿病对照组相比,利格列汀干预组甘油三酯及总胆固醇水平均明显改善(P均<0.01),见表2。
表1 3组大鼠体重、血糖、胰岛素及胰岛素抵抗情况比较(±s)

表1 3组大鼠体重、血糖、胰岛素及胰岛素抵抗情况比较(±s)
注:与正常对照组相比,a P<0.01,b P<0.05;与糖尿病对照组相比,c P<0.01;FPG:空腹血糖;FINS:空腹胰岛素;HOMA-IR:稳态模型评估-胰岛素抵抗指数;ln(HOMA-ISI):稳态模型评估-胰岛素敏感指数的自然对数
表2 3组大鼠血脂变化(±s)

表2 3组大鼠血脂变化(±s)
注:与正常对照组相比,a P<0.01,c P<0.05;与糖尿病对照组相比,b P<0.01;TG:甘油三酯;TC:总胆固醇
2.4 各组血浆脂多糖、TNF-α、IL-6及DAO的含量变化 与正常对照组相比,糖尿病对照组及利格列汀干预组大鼠门静脉血浆脂多糖、TNF-α、IL-6及DAO水平均明显升高(P均<0.05);与糖尿病对照组相比,利格列汀干预后,大鼠门静脉血浆脂多糖、TNF-α及IL-6、DAO水平均有所下降(P均<0.05),见表3。
表3 3组大鼠血浆脂多糖、TNF-α、IL-6及DAO含量变化(±s)
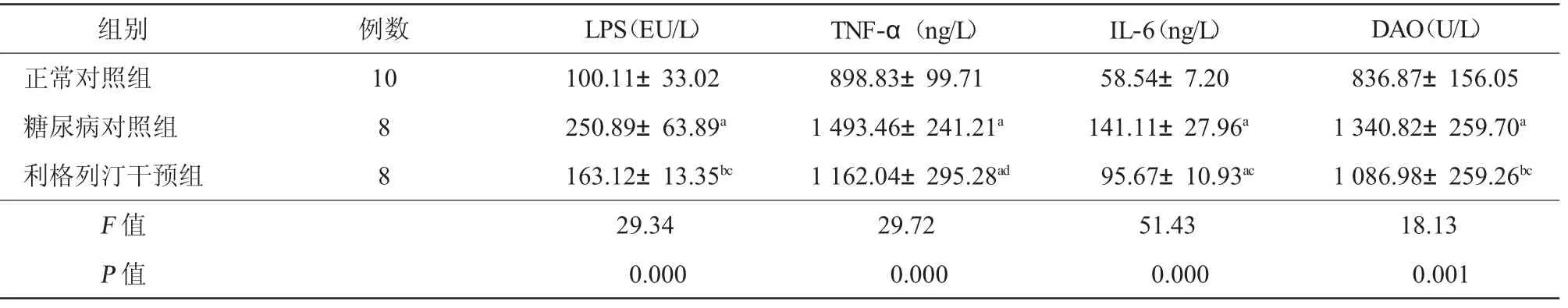
表3 3组大鼠血浆脂多糖、TNF-α、IL-6及DAO含量变化(±s)
注:与正常对照组相比,a P<0.01 ,b P <0.05;与糖尿病对照组相比,c P<0.01,d P<0.05;LPS:脂多糖;TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6;DAO:二胺氧化酶
3 讨论
本研究提示,通过高脂饮食联合小剂量STZ进行2型糖尿病造模,可以观察到糖尿病对照组和利格列汀干预组空腹血糖、胰岛素、甘油三酯及总胆固醇水平均较正常对照组有不同程度的上升,HOMA-IR明显上升,HOMA-ISI有所下降,提示胰岛素抵抗明显增加。同时,两组血浆脂多糖水平也较正常对照组明显升高,即发生了“代谢性内毒素血症”。随着研究的深入,肠道菌群目前已被认为是人体的“内分泌”器官,与胰岛素抵抗、肥胖及2型糖尿病等代谢性疾病均有着密切的联系。而脂多糖作为革兰阴性菌的细胞壁成分,也被认为是肠道菌群和机体发挥相互作用的一项极其重要的环节。脂多糖在引起肠道局部炎性反应的同时,进入血循环,与巨噬细胞、嗜中性粒细胞表面的Toll样受体4及白细胞分化抗原14结合,释放大量炎性因子。本研究中,高脂饮食干预后大鼠血循环中炎性细胞因子TNF-α和IL-6的水平明显上升,造成全身系统性炎性反应,而这一类代谢性低度炎性反应也被证实是胰岛素抵抗、肥胖及2型糖尿病等代谢性疾病发生、发展中的一项重要因素[2,8-9]。
但目前关于高脂饮食介导代谢性内毒素血症的机制尚存在争议,主要包括以下几个方面:有研究表明,脂多糖可以混入乳糜微粒中,随着乳糜微粒一起被吸收进入血循环;高脂饮食可以导致乳糜微粒在肠上皮细胞间堆积,造成肠道紧密连接损伤;另外,高脂饮食介导的局部肠道炎性反应也可以损伤肠道机械屏障,使细菌代谢产物如脂多糖的通透性增加[10-11]。同样,高脂饮食介导的肠道菌群改变也被认为是导致代谢性内毒素血症的发病机制之一,通过使用抗生素或益生元来调节肠道菌群后,血清脂多糖水平也有所下降[12]。
研究观察到高脂饮食干预后,糖尿病对照组和利格列汀干预组血浆DAO水平较正常对照组明显上升,而DAO主要存在于哺乳动物小肠黏膜或绒毛上层,在其他组织中则较少。当小肠黏膜屏障功能受损时,细胞释放DAO增加,DAO进入肠细胞间隙、淋巴管和血流,使血浆DAO升高,血浆DAO水平可以作为探讨肠道机械屏障功能损伤和修复的理想指标[13]。提示可能通过损伤肠道黏膜屏障使肠道通透性增加。
本研究使用利格列汀干预2型糖尿病大鼠,观察到利格列汀干预组对比糖尿病对照组,不仅血糖、胰岛素、血脂水平有所降低,HOMA-ISI及HOMA-IR等指标也均有所改善。同时,利格列汀还可以明显降低2型糖尿病大鼠血浆脂多糖水平,明显改善“代谢性内毒素血症”,并可以降低血浆中TNF-α、IL-6等炎性因子的表达,减轻全身系统性炎性反应,也可以降低血浆DAO水平,显示利格列汀可以减轻高脂饮食介导的肠道损伤。利格列汀作为新型DPP-4抑制剂,较其他同类药物具有作用时间长、抑制DPP-4效果强等特点。研究逐渐发现DPP-4抑制剂除了抑制体内DPP-4对胰高血糖素样肽-1的水解,还可以抑制DPP-4对葡萄糖依赖性促胰岛素多肽、基质细胞衍生因子-1等的降解,降低肠道来源的血清中富含甘油三酯的脂蛋白水平,发挥更多降糖之外的作用[14-15]。因此,本研究观察到的利格列汀可以缓解高脂饮食介导的肠道损伤,减少肠道脂多糖进入血循环,可能与其发挥降糖之外的作用相关,但具体作用机制有待进一步研究证实。
综上所述,利格列汀对2型糖尿病大鼠代谢性内毒素血症有一定的改善作用,可减轻全身系统性炎性反应,这可能与其可以减轻肠道损伤有关。
[1]CaniPD,Amar J,IglesiasMA,etal.Metabolic endotoxemia initiates obesity and insulin resistance[J].Diabetes,2007,56(7):1761-1772.
[2]Cani PD,Osto M,Geurts L,et al.Involvement of gutmicrobiota in the developmentof low-grade inflammation and type2 diabetes associated with obesity[J].GutMicrobes,2012,3(4):279-288.
[3]Cani PD,Bibiloni R,Knauf C,et al.Changes in gut microbiota control metabolic endotoxemia inflammation in high-fat dietinduced obesity and diabetes in mice[J].Diabetes,2008,57(6):1470-1481.
[4]Kern M,Klöting N,Niessen HG,et al.Linagliptin improves insulin sensitivity and hepatic steatosis in diet-induced obesity[J].PLoSOne,2012,7(6):e38744.
[5]Schürmann C,Linke A,Engelmann-Pilger K,et al.The dipeptidyl peptidase-4 inhibitor linagliptin attenuates inflammation and accelerates epithelialization in wounds of diabetic ob/ob mice[J].JPharmacol Exp Ther,2012,342(1):71-80.
[6]Davidson EP,Coppey LJ,Holmes A,et al.Effect of inhibition of angiotensin converting enzyme and/or neutral endopeptidase on vascular and neural complications in high fat fed/low dose streptozotocin-diabetic rats[J].Eur JPharmacol,2012,677(1-3):180-187.
[7]Thomas L,Eckhardt M,Langkopf E,et al.(R)-8-(3-aminopiperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methyl-quinazolin-2-ylmethyl)-3,7-dihydro-purine-2,6-dione(BI 1356),a novel xanthine-based dipeptidyl peptidase 4 inhibitor,has a superior potency and longer duration of action compared with other dipeptidyl peptidase-4 inhibitors[J].J Pharmacol Exp Ther,2008,325(1):175-182.
[8]Cani PD.Gut microbiota and obesity:lessons from the microbiome[J].Brief Funct Genomics,2013,12(4):381-387.
[9]McNelis JC,Olefsky JM.Macrophages,immunity,and metabolic disease[J].Immunity,2014,41(1):36-48.
[10]Ghoshal S,Witta J,Zhong J,etal.Chylomicrons promote intestinal absorption of lipopolysaccharides[J].J Lipid Res,2009,50(1):90-97.
[11]Shen W,Gaskins HR,McIntosh MK.Influence of dietary fat on intestinalmicrobes,inflammation,barrier function and metabolic outcomes[J].JNutr Biochem,2014,25(3):270-280.
[12]Wang JH,Bose S,Kim GC,et al.Flos Lonicera ameliorates obesity and associated endotoxemia in rats through modulation of gut permeability and intestinal microbiota[J].PLoS One,2014,9(1):e86117.
[13]Luk GD,Bayless TM,Baylin SB.Plasma postheparin diamine oxidase.Sensitive provocative test for quantitating length of acute intestinalmucosal injury in the rat[J].JClin Invest,1983,71(5):1308-1315.
[14]Matikainen N,Mänttäri S,Schweizer A,etal.Vildagliptin therapy reduces postprandial intestinal triglyceride-rich lipoprotein particles in patients with type 2 diabetes[J].Diabetologia,2006,49(9):2049-2057.
[15]Zhao Y,Yang L,Zhou Z.Dipeptidyl peptidase-4 inhibitors:multitarget drugs,not only antidiabetes drugs[J].JDiabetes,2014,6(1):21-29.
Effects of linagliptin on metabolic endotoxem ia in type 2 diabetic rats
Pan Daoyan,Shen Jie,Zhu Xiao,Zhao Defu,Chen Zhi,Han Yajuan,LiWenting,Chen Yuancheng.Department of Endocrinology and Metabolism,The Third Affiliated Hospitalof Southern Medical University,Guangzhou 510630,China
Shen Jie,Email:shenjiedr@163.com
Objective To investigate the effects of linagliptin onmetabolic endotoxemia in ratswith type 2 diabetesmellitus(T2DM)induced by high fat feeding and low dose streptozotocin(STZ).M ethods Ten of the 30 healthymale Sprague-Dawley rats were selected as normal control group according to random number and
basic diet,whereas the other 20 rats were fed with high-fat diet for 8 weeks and then treated with STZ intraperitoneal injection(35mg/kg)once to induce T2DM.Diabetes was successfully induced in 16 ratswhich were then randomly divided into linagliptin treatmentgroup(3mg·kg-1·d-1gavage,n=8) and T2DM control group(equivalent normal saline,n=8)according to random number.Four weeks later,fasting blood glucose,fasting blood insulin(FINS),triglyceride,totalcholesterol,portalblood plasma lipopolysaccharide(LPS),tumornecrosis factor-α(TNF-α),interleukin 6(IL-6)and diamine oxidase(DAO)weremeasured.Homeostasismodel assessment-insulin sensitive index(HOMA-ISI)and homeostasismodel assessment-insulin resistance index(HOMA-IR)were calculated.Results Compared with normal control group,the levelsof fasting blood glucose,FINS,HOMA-IR,triglyceride,total cholesteroland body weightwere all significantly increased in T2DM control group,whereas the ln(HOMA-ISI)was signifi-cantly reduced;compared with T2DM group,indexesmentioned above except body weightwere all improved in linagliptin treatment group(F=39.18-136.74,all P <0.01);compared with normal control group,the levels of portal blood plasma LPS,TNF-α,IL-6 and plasma DAO increased in T2DM control group,but indexes mentioned abovewerealldecreased in linagliptin treatmentgroup(F=18.13-51.43,all P<0.05).Conclusion Linagliptin can improve themetabolic endotoxemia in ratswith T2DM induced by high fat feeding and STZ,and attenuatesystemic inflammation response.
Linagliptin;Type2 diabetesmellitus;Metabolic endotoxemia;Inflammation
(Int JEndocrinol Metab,2015,35:230-233)
10.3760/cma.j.issn.1673-4157.2015.04.004
广东省科技计划项目(2011B010500027);广东省自然科学基金资助项目(S2013010016045)
510630 广州,南方医科大学第三附属医院内分泌代谢科
沈洁,Email:shenjiedr@163.com
2015-02-13)

