胶体金制备技术的改进与优化
刘颖沙,李建科,张琳,刘美慧
(陕西师范大学食品工程与营养科学学院,陕西西安,710119)
胶体金标记技术是一种常见的标记技术,利用胶体金为标记物的免疫金染色方法现已广泛应用于组织病理学和免疫学诊断等领域[1]。在食品安全快速检测领域,包括兽药残留、农药残留、动物传染病等也越来越广泛的被应用[2-5]。
自Faulk等[6]用兔抗沙门氏菌抗血清与胶体金颗粒结合、制备成金标抗体检测细菌表面抗原的分布,Romano等[7]用胶体金标记抗球蛋白抗体,建立间接免疫金染色法以来,胶体金作为一种新型免疫标记技术得到快速发展。它具有方便快捷、特异敏感、稳定性强、不需要特殊设备和试剂、结果判断直观等优点。
胶体金的制备常采用化学还原法,主要有白磷还原法、抗坏血酸还原法、柠檬酸三钠还原法、鞣酸-柠檬酸三钠还原法、乙醇超声波还原法和硼氢化钠还原法[8-10]。氯金酸(HAuCl4)在还原剂作用下,可聚合成一定大小的金颗粒,形成带负电的疏水胶溶液。由于静电作用而成为稳定的胶体状态,故称胶体金。胶体金标记是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。吸附机理可能是胶体金颗粒表面的负电荷与蛋白质的正电荷基团静电吸附,达到牢固的结合状态。
本文采用3种不同的方法制备纳米胶体金,并对其进行比较分析,选择最优的制备条件,以提高均一度和稳定性。故本文在胶体金制备前,先经0.22 μm滤膜过滤以提高颗粒均匀性,4℃下保存。
1 材料与方法
1.1 试剂和材料
氯化金(AuCl3)、NaCl、柠檬酸三钠、抗坏血酸、鞣酸、K2CO3,均为化学分析纯,西安晶博生物科技有限公司;试验用水为去离子水。
1.2 仪器设备
紫外-可见扫描分光光度计(UV-2450型),上海天普仪器有限公司;台式高速冷冻离心机(TGL-16G型),上海安亭科学仪器厂;超净工作台(SJ-CJ-2FQ型),苏州苏洁净化设备公司;高压蒸汽灭菌锅(LS-B型),日本SANYO公司;分析天平(ML104型),瑞士梅特勒—托利多公司;数显加热磁力搅拌器(SH21-1型),上海梅颖浦仪器仪表制造有限公司。
1.3 实验方法
1.3.1 胶体金的制备
根据不同的制备方法,可以制备出直径1~500 nm的胶体金粒子,但做为免疫标记探针,其直径应在3~30 nm。胶体金一般采用还原氯金酸(HAuC14)来制备,常见的方法有柠檬酸三钠还原法、抗坏血酸还原法、白磷还原法、硼氢化钠还原法、柠檬酸—鞣酸还原法。
1.3.1.1 胶体金制备前处理
各种玻璃器具均需要经蒸馏水多遍洗净并用双蒸水多次冲洗,烘干;并将器皿放入浓硫酸溶液中浸泡24 h超纯水多遍浸泡冲洗,烘干,避免粉尘等污染。经高压灭菌进行灭菌处理,最后经过去离子水冲洗多遍,高温干燥,备用。
1.3.1.2 胶体金制备的具体步骤[11]
(1)柠檬酸三钠法制备胶体金。① 取250 mL三角瓶一个,加99 mL双蒸水及1 mL 1%氯化金(浅黄色溶液),用0.22 μm滤膜过滤,加热沸腾。② 取0.75,1,1.5,2,4 mL 的1%柠檬酸钠先用0.22 μm 滤膜过滤,再加入上述溶液中,迅速混合均匀,再保持沸腾一定时间,在上述搅拌过程中,锥形瓶中溶液颜色呈现由浅黄色—紫色—酒红色的变化过程,取下锥形瓶冷却至室温,并用双蒸水补充至原体积,制备成酒红色的胶体金溶液,经0.22 μm滤膜过滤。③ 将胶体金溶液用试剂瓶分别保存于常温和4℃保存,备用;若胶体金溶液表面有漂浮物,说明不稳定以及均一度较差,应弃去。
(2)抗坏血酸还原法制备胶体金。与柠檬酸三纳法在开始阶段制法相同,只是在上述搅拌过程中,锥形瓶中溶液颜色呈现由浅黄色—红色的变化过程,取下锥形瓶冷却至室温,并用双蒸水补充至原体积,制备成酒红色的胶体金溶液,经0.22 μm滤膜过滤,备用。
(3)柠檬酸三钠—鞣酸制备胶体金。第一步与柠檬酸三纳法相同,之后取4 mL 1%柠檬酸三钠,加入0~5 mL 1%鞣酸,0~5 mL 25 mmol/L K2CO3(体积与鞣酸加入量相等),于此温度下保持一定时间,待溶液颜色变成深红色后,将溶液加热至沸腾,保持沸腾一定时间。取下锥形瓶冷却至室温,并用双蒸水补充至原体积,制备成酒红色的胶体金溶液,经0.22 μm滤膜过滤,备用。
1.3.2 胶体金颗粒质量评价及粒径的确定
通过目测可以得到胶体金的外观特征,UV-2450紫外-可见光分光光度计对胶体金在可见光范围(400~700 nm)进行扫描,记录结果。400~700 nm波段分光光度进行全波长扫描,胶体金的最大吸收峰波长与平均粒径的线性关系根据回归方程[12]:Y=0.427 1X+514.56(X,纳米金平均粒径;Y,最大吸收峰),可得到胶体金的粒径并由相对宽峰宽/峰高大小可以知道胶体金颗粒的均匀度,分别测定OD520与OD580的比值可进行均一性的比较。
2 结果与讨论
2.1 最佳烧制时间和最佳外观颜色的判定
对胶体金在可见光范围(400~700 nm)进行扫描,结果如图1。由图1可以看出,在烧制过程中,当胶体金颜色呈现黄色、深紫色、浅紫色均无明显的波峰出现,表明金离子未还原或未还原完全,不能聚合成的一定大小的金颗粒,故无明显的峰波出现;当颜色变为紫红色时,金粒子还原后聚合成金颗粒,即有明显的波峰出现。故选择胶体金颜色为紫红色为最佳外观颜色。若胶体金溶液继续保持沸腾时间过长,容易在沸腾状态下体系变得不稳定,胶体金溶液容易发生聚沉现象,使得过多的金颗粒沉淀。结合试验得到柠檬酸三钠法选择沸腾10 min,抗坏血酸还原法选择沸腾10 min、柠檬酸三钠-鞣酸法选择沸腾5 min为不同方法的最佳烧制时间,即可达到颜色均一。

图1 氯金酸溶液为黄色的全波长扫描曲线Fig.1 The spectrum scanning of AuNPs synthesized is yellow

图2 胶体金颜色为紫色全波长扫描曲线Fig.2 The spectrum scanning of AuNPs synthesized is purple

图3 胶体金颜色为浅紫色全波长扫描曲线Fig.3 The spectrum scanning of AuNPs synthesized is light purple

图4 胶体金颜色为紫红色全波长扫描曲线Fig.4 The spectrum scanning of AuNPs synthesized is fuchsia
2.2 紫外-可见光谱表征判定滤膜过滤前处理
未经0.22 μm滤膜过滤处理的胶体金颜色与经滤膜过滤的外观颜色无明显区别,但是经全波长扫面可以看出(图5),在波长为540 nm时曲线不平滑,说明颗粒为达到均一稳定的效果。故制备胶体金时,经先将氯化金溶液和柠檬酸三钠以及抗坏血酸等溶液进行0.22 μm滤膜过滤处理以确保制成均一稳定无杂质的胶体金。

图5 未经滤膜处理的胶体金全波长扫描曲线Fig.5 The spectrum scanning of AuNPs synthesized without the filter processing
2.3 胶体金紫外-可见光谱表征判定最优烧制条件
5种不同加入量的柠檬酸钠,当添加0.75,1,1.5 mL的1%柠檬酸三钠所得到的胶体金的颜色偏紫色,且随着添加量的增加,颜色逐渐加深;当添加2,4 mL的1%柠檬酸三钠时,制得的胶体金颜色偏红色,视觉效果良好透明度高,无悬浮颗粒出现。对烧制而成的胶体金进行400~700 nm波段分光光度扫描,得到的扫描图谱(见图6),不同添加量得到的胶体金均有明显的吸收峰。整理图表数据见表1,可当柠檬酸三钠添加量为2 mL时,峰高/峰宽较大,OD520/OD580=3.46,与其他数值相比最大,表明该添加量得到的胶体金颗粒均匀稳定性较好,颗粒分布均匀,粒径为20 nm,呈现紫红色,透明度高,更加适合后续的标记试验。在反应初期,随着柠檬酸三钠的增加,金离子更多还原成金颗粒,也能加快胶体金颗粒的形核速率。当还原剂加入量达到一定程度时,金离子还原达到饱和,聚合成金颗粒。综上所述故在柠檬酸三钠法中,100 mL浓度为0.01%的四氯金酸溶液中,1%柠檬酸钠的最佳添加量为2 mL。

图6 柠檬酸三钠法制成胶体金全波长扫描图Fig.6 The spectrum scanning of AuNPs synthesized by trisodium citrate
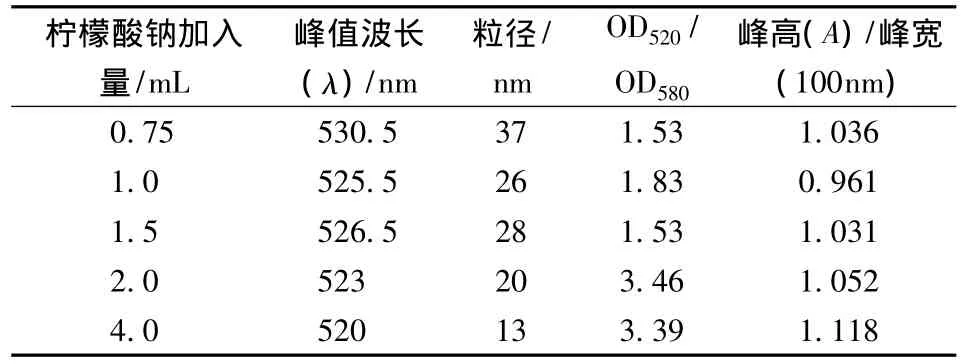
表1 胶体金制法—柠檬酸三钠法Table 1 AuNPs synthesized by trisodium citrate
4种不同加入量的抗坏血酸,形成的胶体金颜色偏红色,且随着添加量的增加,颜色逐渐加深,但制成的胶体金视觉效果一般,透明度较低,肉眼观看有明显的颗粒悬浮出现,放置一定时间,会有沉淀出现。对烧制而成的胶体金进行400~700 nm波段分光光度扫描,得到的扫描图谱(见图7),不同添加量得到的胶体金均有明显的吸收峰。整理图表数据见表2,对比第一种方法,此法在颗粒均一度上有明显的差别。粒径大致为60 nm左右,颗粒较大且不均匀。四种不同的添加量得到的胶体金在均一度、粒径和吸收峰方面均无明显差异。随着抗坏血酸的增加,胶体金的不稳定性增加,易发生聚沉现象,不适合胶体金后续的标记试验。故不适宜采取抗坏血酸法制备胶体金。

图7 抗坏血酸还原法体制成胶体金全波长扫描图Fig.7 The spectrum scanning of AuNPs synthesized by ascorbic acid reduction

表2 胶体金制法—抗坏血酸还原法Table 2 AuNPs synthesized by ascorbic acid reduction
6种不同加入量的柠檬酸三钠-鞣酸,所制成的胶体金颜色与柠檬酸三钠法制得的胶体金颜色类似,但是不同添加量制得的胶体金外观颜色没有明显的区别,视觉效果良好,透明度高,无悬浮颗粒出现。对烧制而成的胶体金进行400~700 nm波段分光光度扫描,得到的扫描图谱(见图8),各曲线在400~500 nm处有略微的上升趋势,造成吸收峰不明显。整理图表数据见表3,可知该法制得的胶体金粒径较适宜于后续胶体金的标记等试验探索。原因可能由于鞣酸具备还原性,同时其分子量相对较大,在胶体金的制备过程中常作为保护剂协同其他还原剂参与反应,所以可能在操作过程中鞣酸与还原剂的量的比例对胶体金的质量影响较大,不易操作。为了更加发挥鞣酸与柠檬酸三纳的协同作用,在以后的探索试验中继续摸索。

图8 柠檬酸三钠-鞣酸法制成胶体金全波长扫描图Fig.8 The spectrum scanning of AuNPs synthesized by trisodium citrate-tannin
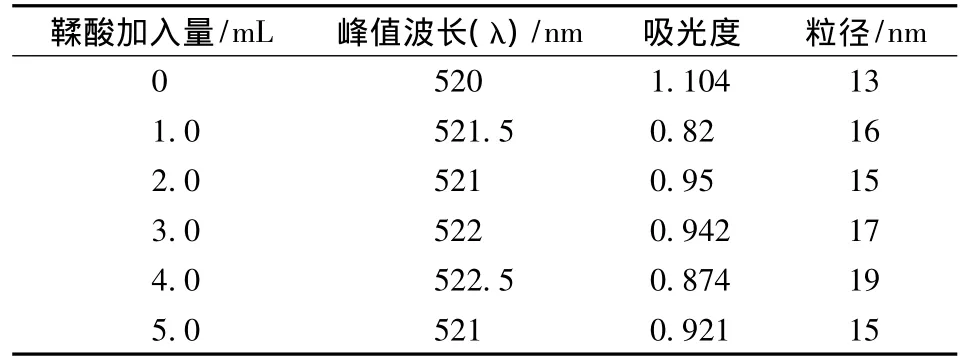
表3 胶体金制法—柠檬酸三钠—鞣酸法Table 3 AuNPs synthesized by trisodium citrate-tannin
综上述数据对比可得,柠檬酸三纳法实验室制得的胶体金从外观、吸收峰以及颗粒大小以及符合后续胶体金标记试验的要求,故选用此法。故将最适胶体金做一定程度的稀释得到下图为最适柠檬酸钠添加量的胶体金全波长扫描。紫外-可见光谱图在523 nm处出现一吸收峰,这是球形金纳米粒子特有的表面等离子共振吸收峰,其结果表明了金纳米粒子的生成,颗粒较均匀。根据回归方程:Y=0.427 1X+514.56(X,纳米金平均粒径;Y,最大吸收峰),表明其粒度约为20 nm。
2.4 胶体金的保存条件
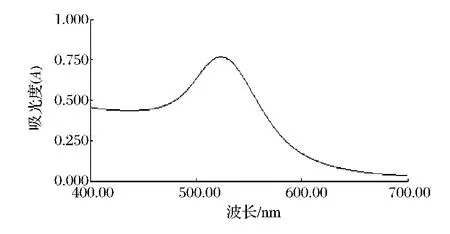
图9 最适柠檬酸三钠添加量的胶体金全波长扫描图Fig.9 The spectrum scanning of AuNPs synthesized by the optimum amount of trisodium citrate
将不同方法制成的胶体金分别在常温和4℃下进行保存,检测其稳定性后可知胶体金溶液在常温条件下保存3周就会出现肉眼可见的颗粒,而4℃胶体金的活力保持较好,胶体金溶液的最大吸收峰波长变化不明显。与杨玉新等人[13]关于胶体金保存条件研究结果一致。故选择4℃为保存条件。
3 结语
(1)本实验通过采用不同烧制方法制备胶体金,比较不同方法的优缺点,选取最优的制备方法。与目前胶体金产品相比,采用滤膜过滤法过滤胶体金可以提高均一性和稳定性,4℃下保存更优于常温。
(2)玻璃器皿必须彻底清理,否则影响生物大分子与金颗粒结合和活化后金颗粒的稳定性;氯金酸质量要求高,配成1%水溶液在4℃环境下可保存数月,但由于氯金酸易潮解,故最好一次性配制。
[1] Elghanian R,Storhoff J J,Mucic R C,et al.Selective colorimetric detection of polynucleotides based on the distancedependent optical properties of gold nanoparticles[J].Science,1997,277(5 329):1 078-1 081.
[2] 刘丽强,彭池芳,金征宇,等.纳米金技术的发展及在食品安全快速检测中的应用[J].食品科学,2007,28(5):348-352.
[3] 杨振修.胶体金在标记免疫测定中的应用[J].标记免疫分析与临床,1997,4(2):91-93.
[4] 方莹.免疫胶体金技术及其在微生物检测中的应用[J].中国卫生检验杂志,2006,16(11):1 399-1 401.
[5] 李忠秋,马红,刘梯,等.免疫胶体金技术基本原理及其在疾病检测中的应用进展[J].黑龙江畜牧兽医,2006,(9):16-18.
[6] Faulk W P,Taylor G M.An immunocolloid method for the electron microscope.Immunochemistry,1971,8(11):1 081-1 083.
[7] Romano E L,Stolinski C,Hughes-Jones N C.An antiglobu-lin reagent labelled with colloidal gold for use in electron microscopy[J].Immunochemistry,1974,11(8):521-522.
[8] 芦光新.胶体金标记探针的制备方法及其应用[J].青海大学学报:自然科学版,2004,22(3):43-46.
[9] 尹晋津,许利剑,曾晓希,等.生物检测用纳米金粒子还原制备方法比较[J].湖南工业大学学报,2008,22(1):104-108.
[10] 吴刚,姜瞻梅,田波,等.胶体金免疫层析技术在食品检测中的应用[J].食品工业科技,2007,(12):216-218.
[11] Frens G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nature Physical Science,1973,241(105):20-22.
[12] 彭剑淳,刘晓达,丁晓萍,等.可见光光谱法评价胶体金粒径及分布[J].军事医学科学院院刊,2000,24(3):211-212.
[13] 杨玉新,叶阳,周有祥,等.四种化学还原法制备胶体金的比较研究[J].湖北农业科学,2011,50(3):476-478.

