酵母多糖影响人朗格汉斯细胞C型凝集素受体的研究
傅方洁, 葛安兴, 孔令明, 徐 琪, 王雪莲*
(1.中国医科大学 临床三系,辽宁 沈阳 110122;2.中国医科大学基础医学院 病原生物学教研室,辽宁 沈阳 110122;3.中国医科大学 临床二系,辽宁 沈阳 110122)
酵母多糖影响人朗格汉斯细胞C型凝集素受体的研究
傅方洁1, 葛安兴2, 孔令明3, 徐 琪1, 王雪莲2*
(1.中国医科大学 临床三系,辽宁 沈阳 110122;2.中国医科大学基础医学院 病原生物学教研室,辽宁 沈阳 110122;3.中国医科大学 临床二系,辽宁 沈阳 110122)
探究酵母多糖(Zymosan)对人朗格汉斯细胞(Langerhans cells, LCs)C型凝集素受体(C-type lectin receptors, CLRs)的影响。收集健康志愿者血液样本,Ficoll淋巴细胞分离液分离外周血单个核细胞,CD14磁珠分选CD14+细胞,用含有GM-CSF(1 000 U/mL)、IL-4(1 000 U/mL)、TGFβ-1(10 ng/mL)的培养液诱导培养LCs, Zymosan刺激LCs,8、24 h后收集细胞。提取Zymosan实验组和对照组细胞RNA,实时RT-PCR分析5种CLRs(Dectin-1、Dectin-2、DC-SIGN、Mincle、MRC-2) mRNA的水平,扩增产物测序鉴定。共检测10个个体来源LCs在酵母多糖刺激后其CLRs mRNA变化的情况。在10组样本中,有6组Dectin-2受体mRNA较对照组增加(变化倍数≥2),其中3组增加明显(变化倍数≥5),最大增加倍数为20.91;有5组Mincle受体mRNA较对照组增加(变化倍数≥2),其中4组增加明显(变化倍数≥5),最大增加倍数为19.98;有1组MRC-2受体mRNA较对照组明显增加(变化倍数≥5)。Dectin-1和DC-SIGN受体mRNA没有增加。Zymosan能增加部分个体来源LCs内Dectin-2、Mincle和MRC-2受体mRNA的水平,而对Dectin-1和DC-SIGN受体mRNA的水平没有影响。本研究结果完善了Zymosan调节机体免疫功能的作用机制。
酵母多糖;朗格汉斯细胞;C型凝集素受体
酵母多糖(Zymosan)是从酵母的细胞壁中提取出来的一类大分子糖类聚合物,其主要成分是葡聚糖、甘露聚糖和几丁质[1-2]。近年研究发现Zymosan是一种有效的机体免疫调节剂,具有多种免疫调节功能,包括抗感染、抗肿瘤及免疫增强作用等[3-4]。朗格汉斯细胞(Langerhans cells,LCs)是一种广泛存在于人体皮下组织中的树突细胞(dendritic cells,DCs)[5]。在人体固有免疫中,LCs作为抗原提呈细胞,通过位于细胞上的模式识别受体(pattern recognition receptors, PRRs)识别病原相关分子模式(pathogen-associated molecular patterns, PAMPs)[6-8],在机体抗感染过程中发挥重要作用。C型凝集素受体(C-type lectin receptors, CLRs)是重要的PRRs之一,包括Dectin-1、Dectin-2、DC-SIGN、Mincle、MRC-2等,主要通过识别碳水化合物结构域(CRD),激发人体非特异性免疫系统的防御功能[9]。已有研究表明Dectin-1能够识别β-(1,3)-葡聚糖结构,启动Syk/CARD9-Bcl-10-MALT1级联途径和非典型 NF-κB信号途径[10],促进DCs成熟和Th1、Th17细胞的分化,从而加强机体免疫应答[11]; DC-SIGN则通过结合多种抗原表面的甘露糖、岩藻糖结构,参与DCs迁移与抗原呈递过程等,诱导T细胞活化,进而增强机体的免疫反应最终清除病原体[12];而MRC-2属于甘露糖受体(mannose receptor,MR),可参与抗原捕获,是一种抗原递呈相关受体[13]。Dectin-2和Mincle是近年来新发现的CLRs,主要在多种巨噬细胞和DCs表面表达[14]。其中Dectin-2具有甘露糖结构结合位点,能够识别白假丝酵母菌、结核分枝杆菌等多种微生物表面的甘露聚糖结构,活化下游Syk、PKCδ和CARD9-Bcl10-Malt1信号通路,释放TNF、IL-2、IL-10等多种细胞因子,并促进炎性小体激活,从而有效促进人体固有免疫功能[15]。Mincle除具有甘露糖结构识别位点外,还受脂多糖等炎性因子刺激,坏死细胞产生的SAP130同样可激活Mincle受体,从而减少炎症损伤[16]。表明Mincle除具有激发自身免疫的作用外,还有一定的免疫监视功能。本研究通过qRT-PCR方法检测Zymosan体外刺激的LCs内包括Dectin-1、Dectin-2、MRC-2、DC-SIGN和Mincle在内的5种CLRs mRNA变化的情况,探究Zymosan参与免疫调节的可能机制。
1 材料与方法
1.1 材料
RPMI-1640培养基、小牛血清、Ficoll购自Fisher Inc.;CD14磁珠购自MiltenyiBiotec Co. Ltd.;rhGM-CSF、rhIL-4、TGF-β1购自PeproTech Inc.;Zymosan购自InvivoGen;RNA提取试剂盒购自Qiagen;DNase I购自Promega;引物由Beacon Design软件设计;SuperScript®III First-Strand Synthesis System购自Life Technologies。
1.2 方法
1.2.1 外周血CD14+单核细胞分离 收集健康志愿者血液样本10份,依次记为k1~k10组。应用Ficoll淋巴细胞分离液分离外周血单核细胞(PBMCs)。应用CD14 Isolation Kit分离CD14+细胞。细胞计数后备用。
1.2.2 LCs诱导培养及Zymosan处理 用含有GM-CSF(1 000 U/mL)、IL-4(1 000 U/mL)、TGFβ-1(10 ng/mL)的RPMI-1640培养液诱导培养CD14+细胞(106个/mL),第3天补加细胞因子,7 d后获得LCs。应用酵母多糖(10 μg/mL)刺激LCs,8和24 h后收集细胞备用。同时设阴性对照组。
1.2.3 RNA提取 用RNeasy kit提取Zymosan实验组和阴性对照组细胞的RNA,最后溶于30 μL无RNase水中。分光光度计测定RNA浓度。
1.2.4 实时RT-PCR分析CLRs的mRNA ①cDNA构建:应用SuperScript®III First-Strand Synthesis System去除RNA样品中RNase、DNA,构建cDNA。反应体系为20 μL,包括:10×buffer 2 μL,dNTP (10 mmol/L) 2 μL,MgCl2(25 mmol/L) 2.8 μL,Oligodt (50 mmol/L) 0.25 μL,R hex (50 μmol/L) 0.5 μL,RNase OUT (40 U/μL) 0.2 μL,DNase (1 U/μL) 0.75 μL,双蒸水1.5 μL,RNA 10 μL(0.1 μg)。反应条件:37 ℃ 15 min;70 ℃ 12 min。每个反应体系加入0.5 μL SuperScript III反转录酶(200 U/μL),逆转录反应条件:25 ℃ 10 min;50 ℃ 50 min;70 ℃ 15 min。②引物序列的设计及PCR扩增:应用Beacon Design软件设计所需引物,其序列见表1。PCR扩增反应按试剂盒说明书进行。以管家基因3-磷酸甘油醛脱氢酶(GAPDH)为内参照,所有样本同时对目的基因和内参照GAPDH进行扩增,实时PCR结果以阈值循环数(cycle threshold,Ct)形式体现。反应体系体积12.5 μL:RNA free H2O 3.25 μL, SYBR Green 6.25 μL, 正向引物0.25 μL, 反向引物0.25 μL。在对应的孔中加入10倍稀释的2.5 μL cDNA。反应条件:95 ℃ 3 min;95 ℃ 10 s, 60 ℃ 30 s,40个循环。③数据计算及分析:共检测10个个体来源LCs在酵母多糖刺激后其受体mRNA变化的情况。以GAPDH为内参照,比较相同RNA样品中目的基因的量。采用Ct相对定量法,即表达量倍数的变化用目的基因量=2-ΔΔCt法计算。ΔΔCt=(Ct目的基因-CtGAPDH)实验组-(Ct目的基因- CtGAPDH)对照组。目的基因量表示样本中目标cDNA表达量相对于相应的空白对照组的变化倍数。设定空白对照ΔΔCt=0, 空白对照组相应的基因量=1。

表1 qRT-PCR引物序列
1.2.5 扩增产物的鉴定 配制琼脂糖凝胶,取PCR扩增产物加样于琼脂糖凝胶孔道中,电泳后回收,测序鉴定。
2 结果与分析
2.1 Zymosan对Dectin-2受体mRNA的影响
在检测的10组样本中,有6组Dectin-2 mRNA在8或24 h时较对照组增加(增加倍数≥2),刺激24 h的样本Dectin-2 mRNA均高于刺激8 h的样本,其中k3、k5、k10三组增加明显(增加倍数≥5),最大增加倍数为K10组刺激24 h时,可达20.91倍(图1)。结果提示Zymosan可增加部分个体来源的LCs表面Dectin-2受体mRNA水平,推测Zymosan可能通过上调Dectin-2受体的表达,增强机体的免疫应答。
2.2 Zymosan对Mincle受体mRNA的影响
在检测的10组样本中,有5组Mincle受体mRNA在8或24 h时较对照组增加(变化倍数≥
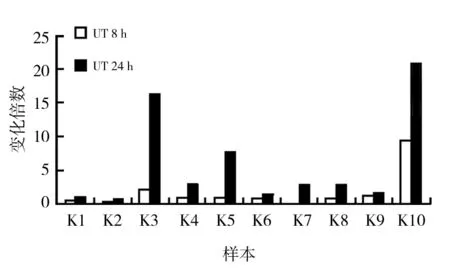
图1 Zymosan对LCs Dectin-2受体mRNA的影响Fig.1 The Dectin-2mRNA in LCs stimulated by Zymosan
2倍),刺激24 h时Mincle受体mRNA均高于刺激8 h时,其中k6、k8、k9、k10四组增加明显(变化倍数≥5倍),最大增加倍数为K8组刺激24 h时,可达19.98倍(图2)。结果提示Zymosan可增加部分个体来源的LCs表面Mincle受体mRNA水平,推测上调Mincle受体的表达可能是Zymosan增强机体免疫应答的机制之一。

图2 Zymosan对LCs Mincle受体mRNA的影响
2.3 Zymosan对MRC-2受体mRNA的影响
在检测的9组样本中,有1组MRC-2受体mRNA在8 h时较对照组明显增加(变化倍数≥5倍,图3),24 h时各组表达均无明显变化。结果提示Zymosan可刺激部分个体来源LCs表面MRC-2受体表达上调,还提示MRC-2可能在Zymosan调节机体免疫反应的早期阶段发挥作用。

图3 Zymosan对LCs MRC-2受体mRNA的影响
2.4 Zymosan对Dectin-1和DC-SIGN受体mRNA的影响
检测的10组样本在刺激8和24 h后,Dectin-1和 DC-SIGN受体mRNA的水平均无增加(图4、图5)。提示Zymosan可能不通过改变这两种受体的表达数量参与免疫应答。

图5 Zymosan对LCs DC-SIGN受体mRNA的影响Fig.5 TheDC-SIGNmRNA in LCs stimulated by Zymosan
3 讨 论
近年来,Zymosan对免疫系统的多种活性作用成为研究热点。Zimmermann等[17]通过Zymosan体外刺激培养的小鼠胸腺细胞和脾淋巴细胞发现:Zymosan与αCD3、PLPp等联合使用,能够有效促进这些固有免疫细胞分泌促炎细胞因子、IL-6、IFN-γ等。Wei等[18]应用人体细胞的实验研究发现Zymosan可通过刺激DCs产生大量GM-CSF、TNF-α等细胞因子促进Th1 和Th17细胞的激活,从而有效增强人体免疫应答。在进一步的免疫机制研究中,Yang等[19]发现Zymosan体外刺激小鼠肥大细胞,其细胞表面Dectin-1表达在刺激3 h时显著增加,而6 h时下降,提示Zymosan可能通过改变免疫细胞表面受体数量参与免疫调节。Gonzalo等[20]发现DC-SIGN受体在Zymosan刺激后的DCs表面重排并介导细胞间黏附,提示DC-SIGN重排可能是Zymosan调节免疫反应的机制。
由此推测,Zymosan可能通过与免疫细胞表面多种CLRs作用,改变CLRs表达情况,如数量或分布方式,或者改变其与细胞CLRs结合的能力,达到免疫调节的目的。Mincle和Dectin-2是近年来新发现且研究较多的CLRs,在DCs表面表达,能够识别甘露糖结构并促进多种细胞因子的分泌[21-22]。因此,Mincle和Dectin-2很可能作为Zymosan作用的受体参与人体非特异性免疫应答。本研究结果显示,Zymosan增加部分个体来源LCs内Mincle、Dectin-2 和MRC-2 mRNA的水平,提示细胞表面多种受体的表达增加,利于识别并结合更多抗原,开启下游信号通路,促进多种细胞因子产生,增强机体的免疫应答。这可能是Zymosan发挥免疫调节作用的机制之一。
本研究检测了Zymosan刺激LCs后8和24 h这两个时间点细胞内Dectin-1 mRNA的水平,结果显示Dectin-1无明显增加(图4),结合Marshall[18]等对小鼠肥大细胞的实验结果分析,即Dectin-1表达在Zymosan作用后3 h增加,而6 h下降,推测Dectin-1可能参与Zymosan刺激早期的免疫反应(0~6 h),而在后期(8~24 h)无明显反应。也可能是LCs和肥大细胞两种不同的免疫细胞对Zymosan的反应不同。同时在检测中发现,Zymosan刺激LCs后,其表面MRC-2表达在8 h时明显高于24 h,推测MRC-2可能也参与早期免疫反应。Zymosan不能刺激DC-SIGN的水平增加(图5),间接佐证了Zymosan通过刺激免疫细胞表面DC-SIGN重排而非数量增加参与免疫反应。
本研究证实Zymosan能够明显增加部分个体来源LCs内Dectin-2、Mincle和MRC-2的水平,且间接佐证了其对Dectin-1和DC-SIGN的刺激作用,本研究结果进一步完善了Zymosan调节机体免疫反应的机制,即通过改变免疫细胞表面CLRs的受体数量或分布方式达到免疫调节的目的。研究结果也提示Zymosan可能作为临床辅助治疗药物或免疫佐剂的发展方向。
[1] Di Carlo FJ, Fiore JV. On the composition of zymosan[J].Science,1958,127(3301):756-757.
[2] 韩晓阳,徐泽平,周传兵,等. 酵母多糖的提取、水解及组分分析[J].Chin J Biologicals,2013, 26(10):1513-1516.
[3] Lily I. Jiang, Paul C. Sternweis, Jennifer E. Wang.Zymosan activates protein kinase A via adenylyl cyclase VII to modulate innate immune responses during inflammation[J].MolImmunol,2013,54(1): 14-22.
[4] 葛淑芝,张庆波,刘印华,等.酵母多糖对免疫功能低下小鼠免疫功能的影响[J].Chinese Journal of Coal Industry Medicine,2014,17:105-108.
[5] JuhiUpadhyay, Ram B. Upadhyay, Pankaj Agrawal, et al.Langerhans cells and their role in oral mucosal diseases[J].North American Journal of Medical Sciences,2013, 5:505-514.
[6] de Jong MA, Vriend LE, Theelen, et al.C-type lectin Langerin is a beta-glucan receptor on human Langerhans cells thatrecognizes opportunistic and pathogenic fungi[J].Mol Immunol,2010,47(6):1216-1225.
[7] Vincent Flacher, MarielleBouschbacher, Estelle Verrone`se, et al.Human Langerhans Cells Express a Specific TLR Profile and Differentially Respond to Viruses and Gram-Positive Bacteria[J].J Immunol,2006,177:7959-7967.
[8] LuiginaRomani.Immunity to fungal infections[J].Immunology,2011,11:275-288.
[9] FigdorCG, van Kooyk Y, Adema GJ. C-type lectin receptors on dendritic cells and Langerhans cells[J].Nat Rev Immunol, 2002,2(2):77-84.
[10]Sonja I Gringhuis, Jeroen den Dunnen, ManjaLitjens, et al.Dectin-1 directs T helper cell differentiation bycontrolling noncanonical NF-jB activation throughRaf-1 and Syk[J].Nat Immunol, 2009,10(2):203-213.
[11]LeibundGut-Landmann S, Gross O, Robinson MJ, et al. Syk-and CARD9-dependent coupling of innateimmunity to the induction of T helper cells thatproduce interleukin 17[J].Nat Immunol, 2007,8(6):630-638.
[12]Linehan SA.The mannose receptor is expressed by subsets of APC in non-lymphoid organs[J].BMC Immunol,2005,(6):4.
[13]Svajger U, Anderluh M, Jeras M, et al. C-type lectin DC-SIGN: An adhesion, signalling and antigen-uptake molecule thatguides dendritic cells in immunity[J].Cell Signal, 2010,22(10):1397-1405.
[14]Ishikawa T, Itoh F, Yoshida S, et al.Identification of Distinct Ligands for the C-typeLectin Receptors Mincle and Dectin-2in the Pathogenic Fungus Malassezia[J].Cell Host Microbe, 2013,13(4):477-488.
[15]Yonekawa A, Saijo S, Hoshino Y, et al.Dectin-2 Is a Direct Receptor for Mannose-CappedLipoarabinomannan of Mycobacteria[J].Immunity, 2014,41(3):402-413.
[16]deRiveroVaccari JC, BrandFJ, Berti AF, et al.Mincle Signaling in the Innate Immune Response after Traumatic Brain Injury [J].J Neurotrauma, 2015,32(4):228-236.
[17]Zimmermann C, Weber A, Mausberg AK, et al.T cell activation status determines the cytokinepattern induced by zymosan and bacterial DNA both in thymocytes and splenocytes[J].Clin Exp Immunol, 2013,172(2):245-253.
[18]Wei WC, Su YH, Chen SS, et al.GM-CSF plays a key role in zymosan-stimulated human dendritic cellsfor activation of Th1 and Th17 cells[J].Cytokine, 2011,55(1):79-89.
[19]Yang Z, Marshall JS.Zymosan treatment of mouse mast cells enhances dectin-1 expressionandinduces dectin-1-dependent reactive oxygen species (ROS) generation[J].Immunobiology, 2009,214(4):321-330.
[20]Gonzalo de la R.,María YM,Rafael S., et al.Regulated recruitment of DC-SIGN to cell-cell contact regions during zymosan-induced human dendritic cell aggregation[J].J Leukoc Biol, 2005,77(5):699-709.
[21]Behler F, Maus R, Bohling J,et al.Macrophage-inducible C-type lectin Mincle expressing dendritic cells contribute to control splenic Mycobacterium bovis BCG infection in mice[J].Infect Immun, 2015,83(1):184-196.
[22]Barrett NA, Maekawa A, Rahman OM, et al.Dectin-2 Recognition of House Dust Mite Triggers Cysteinyl Leukotriene Generation by Dendritic Cells[J].J Immunol,2009,182(2): 1119-1128.
The Impact of Zymosan on C-Type Lectin Receptors on Human Langerhans Cells
FU Fang-jie1, GE An-xing2, KONG Ling-ming3, XU Qi1, WANG Xue-lian2
(1.ThirdDept.ofClinic.Med. 98K, 2.Teach. &Res.Div.ofPathog.Organism,Coll.ofBasicMed.Sci.,3.SecondDept.ofClinic.Med. 98K,ChinaMed.Uni.,Shenyang110122)
The impact of zymosan on C-type lectin receptors (CLRs) on human Langerhans cells (LCs) was investigated. Blood samples from healthy volunteers were collected, and PBMCs were isolated using Ficoll lymphocyte isolating liquid, and CD14+cells were isolated using CD14 microbeads. The LCs were induce-cultured in medium liquid containing GM-CSF (1 000 U/mL), IL-4 (1 000 U/mL), TGFβ-1 (10 ng/mL); LCs were stimulated with zymosan and collected the cells after 8 h and 24 h. RNA was extracted from zymosan group and control group, then the levels of 5 CLRs (Dectin-1, Dectin-2, DC-SIGN, Mincle, MRC-2) mRNA were analyzed by real-time RT-PCR, the amplified products were identified by sequencing. The variances of CLRs mRNA of a total 10 individuals LCs after stimulated with zymosan were determined and tested. The results showed that among the 10 samples, 6 groups Dectin-2 receptor mRNA increased as compared with the control group (variance times ≥2), among them 3 groups significantly increased (variance times ≥5), the largest increasing times was 20.91; 5 groups Mincle receptor mRNA increased as compared with the control group (variance times ≥2), among them 4 groups significantly increased (variance times ≥5), the largest increasing times was 19.98; 1 group MRC-2 receptor mRNA significantly increased as compared with the control group (variance times ≥5). Dectin-1 and DC-SIGN receptor mRNA were not increased. Therefore, zymosan can increase part of individual mRNA levels of Dectin-2, Mincle and MRC-2 receptor mRNA in LCs and has no effect on mRNA levels of the Dectin-1 and DC-SIGN receptor. This study perfected the mechanism of zymosan on regulating immune response.
zymosan; Langerhans cells; C-type lectin receptor
国家自然科学基金项目(81472439,81101989)
傅方洁 女,七年制本科在读。研究方向为人乳头瘤病毒相关疾病的生物治疗。E-mail: ffj0324@hotmail.com
* 通讯作者。女,副教授。研究方向为人乳头瘤病毒相关疾病的生物治疗。E-mail:wxlcmu@hotmail.com
2015-04-29;
2015-06-07
Q539
A
1005-7021(2015)06-0069-05
10.3969/j.issn.1005-7021.2015.06.013

