617株耐亚胺培南铜绿假单胞菌耐药性及其产超广谱β-内酰胺酶基因型研究
陈君灏, 章晓鹰
(上海市中医药大学 附属曙光医院检验科,上海 201203)
617株耐亚胺培南铜绿假单胞菌耐药性及其产超广谱β-内酰胺酶基因型研究
陈君灏, 章晓鹰*
(上海市中医药大学 附属曙光医院检验科,上海 201203)
探讨耐亚胺培南铜绿假单胞菌的耐药性及其产超广谱β-内酰胺酶基因型。收集2011年7月至2013年12月上海市中医药大学附属曙光医院临床分离的铜绿假单胞菌共1 125株,筛选亚胺培南耐药株,常规纸片法检测其耐药性,并用E-test检测金属β-内酰胺酶(MBL),采用PCR法检测耐药基因型。结果显示,1 125株铜绿假单胞菌中耐亚胺培南铜绿假单胞菌共计617株,占54.8%;亚胺培南敏感铜绿假单胞菌共计508株,占45.2%。617株亚胺培南耐药铜绿假单胞菌100%为多重耐药,而亚胺培南敏感铜绿假单胞菌的多重耐药率仅为13.78%,明显较前者低(χ2=871.15,P<0.05);亚胺培南耐药的铜绿假单胞菌中MBL表型阳性共126株,阳性率为15.4%,94株(74.60%)表现为VIM-2阳性,10株(7.94%)表现为IMP-1阳性,1株检出OXA-10,且该例菌株同时表达VIM-2。临床分离的耐亚胺培南的铜绿假单胞菌多为多重耐药,其产MBL的主要基因型是VIM-2。
亚胺培南;铜绿假单胞菌;耐药性;分子机制
铜绿假单胞菌(Pseudomonasaeruginosa, Pa)是引起院内获得性感染常见的条件致病菌,且其在医院的分离率列居第2位,仅次于大肠埃希菌[1],亚胺培南(imipenem, IPM)是目前临床上治疗铜绿假单胞菌感染常用的碳青霉烯类抗生素,但近年耐亚胺培南的铜绿假单胞菌株逐渐上升,不仅如此,耐碳青霉烯的铜绿假单胞菌大多为多重耐药株[2],给临床治疗带来很大的困扰。而且,铜绿假单胞菌产超广谱β-内酰胺酶(ESBLs)引起的耐药已经成为当前全球非常重要的院内感染问题。IPM-1与VIM-2基因编码产生的金属β-内酰胺酶是产生耐亚胺培南铜绿假单胞菌的主要原因[3],掌握并分析Pa通过产金属β-内酰胺酶介导的耐药率及其耐药机制对防控耐药的Pa至关重要。本研究通过对临床标本中分离到的耐亚胺培南铜绿假单胞菌(imipenem resistant Pa, IPMRPa)的耐药性进行分析,检测其相关携带的耐药基因,初步探讨其耐药的分子机制,以期为临床用药提供指导。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集2011年7月至2013年12月上海市中医药大学附属曙光医院临床分离的Pa共1 125株,去除同一病例相同部位分离的菌株。质控菌株铜绿假单胞菌(ATCC27853)、大肠埃希菌(ATCC25922)购自卫生与计划生育委员会临床检验中心。
1.1.2 试剂与仪器 E-test 试纸条:用于检测MBL,分成亚胺培南/亚胺培南+EDTA (IP/IPI),其抗菌浓度范围为4~256 mg/ (IP)和1~64 mg/L (IPI),购自法国生物梅里埃公司。仪器:生物安全柜(江苏安泰),超净工作台(苏州净化),WBS-100 比浊仪(北京六一),ESCO二氧化碳培养箱(新加波),PCR仪(nexus gradient eppendorf公司),M-H琼脂商品培养基(法国生物梅里埃公司),全自动细菌鉴定仪VITEK2-compact(法国生物梅里埃公司),凝胶成像系统(Bio-Rad公司),引物均由上海英骏生物公司合成(高效液相色谱法纯化),高速离心机(Thermo 公司)。
1.2 方法
1.2.1 药物敏感试验方法 药敏纸片:亚胺培南(IMP, 10 μg)、阿米卡星(AMK, 30 μg)、环丙沙星(CIP, 30 μg)、左氧氟沙星(LVX,5 μg)、氨曲南(ATM, 30 μg)、美罗培南(MEM,10 μg)、庆大霉素(GEN,10 μg)、头孢他啶(CAZ, 30 μg)、头孢吡肟(FEP, 30 μg)、哌拉西林(PIP, 100 μg),哌拉西林/他唑巴坦(TZP, 100/10 μg),均为OXID公司产品,在保质期内使用。所有菌株按照《全国临床检验操作规程》进行样本留取接种,采用VITEK细菌鉴定仪进行菌种鉴定,以铜绿假单胞菌(ATCC27853)为质控菌株,根据美国CLSI 2008年版要求采用K-B法测定以上11种抗菌药物的敏感性。
1.2.2 E-test法检测金属β-内酰胺酶(MBL) 取0.5麦氏单位细菌悬液均匀涂布于M-H平板后,将试纸条贴在平板上,35 ℃培养18 h,读取试纸条两端的最小抑菌圈浓度,以IP/PIP≥3,或试纸条中间空白区出现协同抑菌圈,或无抑制剂的一端抑菌圈尾部变形判断为MBL阳性[4]。
1.2.3 MBL基因型分析 ①模板制备:从分离纯化的样本菌株琼脂平板上挑取单个克隆菌落,接种于LB培养基,37 ℃,置于水平摇床上160 r/min 摇震培养16 h,运用煮沸法提取细菌DNA,吸取1 mL 菌液于EP管,12 000 r/min离心1 min,弃上清后加入500 μL无菌蒸馏水,吹匀菌液,95 ℃水浴10 min,12 000 r/min离心 10 min,吸取上清;酚:氯仿/异戊醇抽提1次,无水乙醇沉淀1 h后,各管产物溶于200 μL水,置于-20 ℃保存备用。②引物设计:参考文献[5]设计引物,并将引物序列导入Primer 5引物设计软件进行验证。PCR体系设置为20 μL,如下:2×PCR mix 10 μL, sense/antisense: 1 μL/1 μL (6 μmol/L),DNA样品 3 μL,H2O 5 μL。混匀后置于PCR管离心机上,12 500 r/min 离心10 s,将液体全部甩至管底后置于PCR仪上。引物序列:VIM-2: Sense: 5′-CAGATTGCCGATGGTGTTTGG-3′, Antisense: 5′-AGGTGGGCCATrCAGCCAGA-3′ Product: 523 bp;IMP-1: sense: 5′-ATGAGCAAGTTATCTGTATTC-3′, Antisense: 5′-TTAGTTGCTTGGTTTTGATG-3′ Product: 741 bp;OXA-10: Sense: 5′-TCAACAAATCGCCAGAGAAG-3′, Antisense:5′-TCACAACAACTAAAAGCACTG-3′, Product:276 bp。③PCR扩增条件:S1: 95 ℃,10 min;S2: 95 ℃,50 s;S3: 55 ℃(OXA), 56 ℃(VIM、IMP), 50 s; S4: 72 ℃,50 s; S2~S4循环30次,阴性对照为以H2O代替模板加入PCR体系。产物点样于1% 琼脂糖,电泳条件为5 V/cm,30 min,与DL3000 marker同时电泳。
1.2.4 统计分析 统计分析采用SPSS17.0软件。所观测资料主要为细菌耐药性(以耐药率表示)等,均为一般计数资料。两菌株样本组间比较采用χ2检验。显著性水准α=0.05。P<0.05为差异有统计学意义。
2 结果与分析
2.1 IPMRPa与非IPMRPa的耐药性比较
1 125株Pa中,IPMRPa共计617例,占54.8%;非IPMRPa共计508例,占45.2%。IPMRPa与非IPMRPa的耐药性比较见表1。

表1 IPMRPa与非IPMRPa的药敏试验结果
注:IPMRPa:耐亚胺培南铜绿假单胸菌
2.2 多重耐药比较
目前把对亚胺培南、头孢他啶、哌拉西林、环丙沙星4种药物均耐药的Pa定义为多药耐药(MDRPa)[6]。本文比较了IPMRPa/非IPMRPa对其他抗生素的耐药性,结果发现,617株IPMRPa 100%为多重耐药(对3类或3类以上药物同时耐药),而非IPMRPa的多重耐药率仅为13.78%,差异具有统计学意义(χ2=871.15,P<0.05)。见表2。
表2 IPMRPa/非IPMRPa多重耐药性比较
Table 2 Comparison of multi-drug resistance of IPMRPa and non-IPMRPa
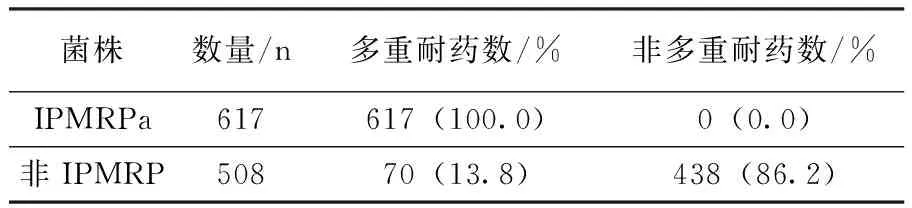
菌株数量/n多重耐药数/%非多重耐药数/%IPMRPa617617(100.0)0(0.0)非IPMRP50870(13.8)438(86.2)
2.3 产MBL菌株检测及其基因型分析
E-test结果显示:617株亚胺培南耐药的铜绿假单胞菌,MBL表型阳性共126株,阳性率为15.4%。
对126株产MBL菌株检测其产MBL基因型的结果显示,共有94株(74.60%)表现为VIM-2阳性(扩增产物大小523 bp);10株(7.94%)表现为IMP-1阳性(扩增产物大小为741 bp),1株为OXA-10(扩增产物大小为276 bp),且该例菌株同时表达VIM-2,见图1。其余菌株检测结果均为阴性。

图1 VIM-2、IMP-1、OXA-10基因扩增图Fig.1 Gene amplification of VIM-2, IMP-1 and OXA-10梯度条带表示DL3 000 marker;1:VIM-2; 2:IMP-1; 3:OXA-10; 4:阴性对照 Gradient bands represent DL3 000 marker; 1:VIM-2; 2:IMP-1; 3:OXA-10; 4:Negative control
3 讨 论
铜绿假单胞菌是临床常见的条件致病菌,其临床分离率已经占到革兰阴性细菌总数的20%~23%[7]。其本身可选的抗生素范围比较窄,临床用于Pa感染的抗生素主要是β-内酰胺类,氨基糖苷类与喹诺酮类。Pa对氨基糖苷类抗生素的耐药性最低,为15%左右[8-9];而其对喹诺酮类的耐药性在20%左右;在β-内酰胺类抗生素中,碳青霉烯类的亚胺培南是目前临床对Pa效果比较好的抗生素,而目前其耐药性也在以较快的速度上升,这可能和近年来临床上亚胺培南频繁使用导致耐药菌株被选择出来并广泛传播有关。研究表明,目前喹诺酮类与氨基糖苷类抗生素仍然是治疗Pa感染有效的抗生素。
IPMRPa分离率逐年上升已经引起临床的足够重视,而产金属酶是Pa对亚胺培南耐药的主要机制,介导Pa耐药的MBL可由质粒与染色体双重介导[10]。其发挥活性依赖于Zn2+,其作用主要是通过水解包括碳青霉烯类在内的绝大多数β-内酰胺类抗生素,此外,OXA-10属于D类β-内酰胺酶,也可以水解碳青霉烯类抗生素,进而介导Pa对亚胺培南的耐药。了解临床分离的亚胺培南耐药Pa的耐药机制,对指导临床治疗Pa所致的感染及控制耐药性的播散具有重要意义。
本研究检测了临床分离的Pa菌株对亚胺培南的敏感性,结果显示,超过一半的Pa表现出对亚胺培南的耐药,与杜艳等[11]报道的数据接近。研究还发现,对亚胺培南耐药的Pa均表现出多重耐药性,而非亚胺培南耐药的Pa的多重耐药性则明显要低,这可能提示介导耐亚胺培南的机制本身就是多样的,其除了可以导致该菌株对亚胺培南耐药外,还可以导致对其他抗生素耐药,并不能排除多重耐药性是由各自相互独立的原因所导致。
本研究在20.4%的耐亚胺培南菌株中检出MBL,这一比例较国内其他报道稍高[12-13],在所分离的MBL阳性菌株中检测了VIM-2、IMP-1、OXA-10基因型的存在,结果表明绝大多数(74.60%)的细菌是VIM-2阳性,只有7.94%的表现为IMP-1阳性,且同时还有1例是OXA-10阳性。这表明目前上海市中医药大学附属曙光医院Pa产MBL主要是由VIM-2基因介导,没有分离出VIM-2与IMP-1同时双阳性的菌株,但发现了1例VIM-2与OXA-10双阳性的菌株,尽管VIM-2与OXA-10所引起的耐药机制不尽相同,但其表达产物均可导致对亚胺培南的耐药,表明同一菌株可能会同时出现抵抗同一类抗生素的多个耐药基因。
综上所述,IPMRPa在临床具有较高的分离率,其耐药谱广且有向单一菌株多重耐药发展的表现,提示临床上应加强病原学检查,根据药物敏感性结果选择药物,以达到最佳的治疗效果。
[1] Giske CG, Buar L, Sundsfjord A, et al. Alterations of porin, pumps, andpenicillin-binding proteins in carbapenem resistant clinical isolates ofPseudomonasaeruginosa[J].Microb Drug Resist,2008,14(1):23-30.
[2] Valentine CD, Zhang H, Phuan PW,et al.Small molecule screen yields inhibitors ofPseudomonashomoserinelactone-induced host responses[J].Cell Microbiol, 2014,16(1):1-14.
[3] Pereira V, Lopes C, Castro A,et al.Characterization for enterotoxin production, virulence factors, and antibiotic susceptibility ofStaphylococcusaureusisolates from various foods in Portugal[J].Food Microbiol,2009,26(3):278-82.
[4] Walsh T R, Bolmstrom A, Qwarnstrom A. et al. Evaluation of a new Etest for detecting metallo-beta-lactamases in routine clinical testing[J]. Journal Of Clinical Microbiology,2002, 40(8): 2755-2759.
[5] Zaborina O, Kohler JE,Wang Y. Annals of clinical microbiology and antimicrobials[J]. An Clin Microbiol Antimicrob, 2006,7(1): 1-10.
[6] Strateva T, Yordanov D.Pseudomonasaeruginosa-a phenomenon of bacterial resistance[J]. Journal Of Medical Microbiology,2009, 58(Pt 9): 1133-1148.
[7] 马玲. 多粘菌素B对多重耐药铜绿假单胞菌和鲍曼不动杆菌的体外抗菌活性研究[D].重庆:重庆医科大学,2010.
[8] 张祎博,倪语星,孙景勇,等.2010年中国CHINET铜绿假单胞菌耐药性监测[J]. 中国感染与化疗杂志,2012,12(3):161-166.
[9] 施晓群,孙景勇,倪语星,等. 2011年中国CHINET铜绿假单胞菌耐药性监测[J]. 中国感染与化疗杂志,2013,13(3):218-221.
[10]Cristina L, Elisabetta E, Lucilla D, et al. Molecualr evolution of Metallo-β-Lactamase-ProducingPseudomonasaeruginosain a Nosocomial Setting of High-Level Endemicity[J]. J Clin Microbiol, 2006, 44(7):2348-2353.
[11]杜艳,陈瑞春,穆玉姣,等. 耐亚胺培南铜绿假单胞菌及其产金属酶的相关基因bla_(VIM-2)研究[J]. 中国抗生素杂志,2012,37(07):507-509,527.
[12]Falagas M E, Koletsi P K, Bliziotis I A. The diversity of definitions of multidrug-resistant (MDR) and pandrug-resistant (PDR) Acinetobacter baumannii andPseudomonasaeruginosa[J]. Journal Of Medical Microbiology,2006,55(Pt 12): 1619-1629.
[13]Yuan Z, Tam V H. Polymyxin B: a new strategy for multidrug-resistant Gram-negative organisms[J]. Expert Opin Investig Drugs, 2008,17(5): 661-668.
Drug Resistance & Genotype of Extended Spectrum β-Lactamases among 617 Cases of Imipenem-ResistantPseudomonasaeruginosa
CHEN Jun-hao, ZHANG Xiao-ying
(Dept.ofLab.,Affil.ShuguangHosp.ofShanghaiUni.ofTCM,Shanghai201203)
The drug resistance and genetype genotype of super-broad spectrum β-lactamase of imipenem-resistantPseudomonasaeruginosawere investigated. 1 125 strains ofP.aeruginosaisolated from Shanghai TCM University affiliated Shuguang Hospital collected from July 2011 to December 2013 were screened for imipenem-resistant strains, and detected their drug resistance with routine paper sheet, and adopted E-test to detect metal β-lactamase (MBL) PCR to detect their drug resistance genotype. The results showed that of all 1 125P.aeruginosastrains 617 strains (54.8%) was imipenem-resistant, while 508 (45.2%) were imipenem-sensitive. 617 strains of imipenem-resistantP.aeruginosawere all multi-drug resistant (100%), while the rate imipenem sensitive strains was only 13.78%, obviously lower than the former (χ2=871.15,P<0.05). 126 strains of imipenem-resistantP.aeruginosawere MBL phenotypic, with positive rate of 15.4%, of them 94 strains (74.60%) wereVIM-2 positive, 10 strains wereIMP-1 positive; one strain was detected asOXA-10 and simultaneously expressedVIM-2. Therefore, clinically isolated imipenem-resistantP.aeruginosawere mostly multi-drug resistant, the MBL-producing genotype manly wasVIM-2.
imipenem;Pseudomonasaeruginosa; drug resistance; molecular mechanisms
陈君灏 男,主管检验师。主要从事微生物临床检验相关工作。E-mail:chenjunhao897@163.com
2015-08-07;
2015-08-25
Q939.11+2
A
1005-7021(2015)06-0078-04
10.3969/j.issn.1005-7021.2015.06.015
* 通讯作者。女,硕士,主任检验师。主要从事PCR室相关研究与检验工作。

