TSG101在病毒出芽过程中的作用及其机制
许 岩, 张 莹
(1.中国医科大学 临床医学七年制,辽宁 沈阳 110000;2.中国医科大学 科学实验技术中心三部,辽宁 沈阳 110013)
TSG101在病毒出芽过程中的作用及其机制
许 岩1, 张 莹2*
(1.中国医科大学 临床医学七年制,辽宁 沈阳 110000;2.中国医科大学 科学实验技术中心三部,辽宁 沈阳 110013)
TSG101基因是新发现的抑癌基因候选者,定位于人类 11号染色体 p1511-p1512,其编码产物TSG101蛋白N端区域与泛素结合酶(UBC)同源。近年来研究发现,TSG101基因具有多种重要的功能,与多种病毒出芽密切相关,所以TSG101可作为一个新的抗病毒靶点。本文主要从TSG101在多种病毒(HIV、IAV、MARV、ASV等)出芽过程中扮演的角色,TSG101与多种蛋白(泛素、Nedd4、ARMMs、Tom1、Gag、VP40、NP等)的相互作用进而辅助病毒出芽的机制,以及TSG101抑制剂的研究等方面进行阐述。
TSG101;UBC ;病毒出芽;抗病毒靶点
TSG101基因是1996年由Li等在鼠成纤维细胞3T3中发现的,因具有抑制肿瘤的功能,被命名为肿瘤易感基因101(tumor susceptibility gene 101,TSG101)。该基因的表达产物TSG101蛋白是细胞内体分选复合物-I (Endosomal sorting complexes required for transport-I, ESCRT-I)的组成部分, TSG101蛋白在细胞液泡蛋白分选途径(vacuolar protein sorting,Vps)中起着重要作用,是细胞正常生理功能必须的,其表达过多或过少都会影响细胞的正常生命活动。随着研究的逐渐深入,人们发现TSG101和病毒有密切关系,现将其综述如下。
1 TSG101基因与蛋白的结构
人类TSG101基因位于人类 11号染色体 p1511-p1512,基因组全长46.63 kb,包括10个外显子,mRNA全长1 550 bp,通过转录翻译,生成含有 390个氨基酸残基、相对分子质量为 46 kDa的人TSG101蛋白。人TSG101与小鼠TSG101有94%的同源性,两者之间只存在20个不相一致的氨基酸和一个间隙。这些都表明人和鼠的TSG101基因都具有高度保守的全长结构。人TSG101蛋白由N端至C端在结构上可分为4个主要功能区[1](图1):第一个功能区为N端的UEV结构域(ubiquitin E2 variant),这一结构域与泛素结合酶UBC(Ubiquitin-conjugated domain)具有明显的同源性,但其缺少UBC执行功能所必须的氨基酸半胱氨酸;第二个功能区为富含脯氨酸区域 (proline rich region, PRR),此区为转录调控的活性区域;第三个功能区为一个卷曲螺旋结构域CC(coiled-coil domain),此结构域中的DNA结合单元具有转录因子特性;第四个功能区为C端的羟基末端卷曲螺旋结构的保守序列SB区(steadiness box domain),该区域能够调节甾类激素受体的转录活性。
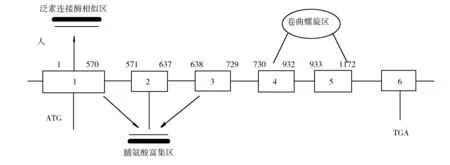
图1 人TSG101基因结构模式图Fig.1 Genetic structure of human TSG101
2 TSG101对病毒的作用
大部分包膜病毒出芽都需要从宿主细胞中获取包膜,这就需要ESCRT的参与。ESCRT是四聚体蛋白复合物,分别为ESCRT-0、I、II、III。这些成员辅助病毒形成多泡体(multivesicular body,MVB)时细胞膜的分裂,介导病毒颗粒从宿主细胞的释放。TSG101蛋白是ESCRT-I的组成单位之一,ESCRT-I由TSG101、VPS28、VPS37、MVB(最新发现)4个亚基组成[2]。ESCRT与TSG101蛋白涉及HIV从细胞内的出芽过程,并且在Vps中起重要作用,其主要功能是识别泛素化的物质,并且也被证明是多种病毒体出芽过程中不可或缺的。现今研究认为,ESCRT-I和III的招募是病毒出芽所必需的,在出芽的后期和ESCRT装置的再循坏利用需要AAA-ATPase VPS4的作用。
在病毒的出芽过程中,内体小泡的形成是不可缺少的。Thomas 等[3]研究发现,内体小泡的形成是ESCRT依赖的,因为这个过程被hVps4的K173Q显性失活突变体抑制。TSG101通过作用于正性调节者,从而控制内体小泡的形成。Luyet等[4]发现,TSG101介导受体分选到多泡体,对于病毒包膜与核内体膜融合和病毒RNA转运到多泡体(也就是晚期内体,late endosomes,LEs)不是必需的,但对于感染是必需的。与ESCRT-0成分Hrs相比,TSG101在介导核衣壳从多泡核内体释放到胞质中的过程中起直接作用,大概是通过控制后融合过程。TSG101通过与Hrs和Alix (细胞内宿主蛋白ALG-2相关作用蛋白X,ALG-2 interacting protein X)选择性相互作用,连接受体分选和溶酶体靶向到后融合的过程,这个过程参与病毒衣壳的释放。
2.1 TSG101与HIV
人类免疫缺陷病毒(Human immunodeficiency virus,HIV)的生命周期需要从宿主细胞蛋白和通路中获得广泛的帮助,其病毒颗粒包含 3种必要的结构蛋白,其中 Gag蛋白是含量最丰富的蛋白质,大约构成了病毒结构蛋白的85%,而且是在病毒颗粒形成过程中唯一必需的蛋白质,Gag蛋白在质膜中的装配过程是HIV病毒颗粒生产的驱动力。有研究发现HIV病毒的成熟和释放依赖于细胞中TSG101的表达[5],TSG101被独特地暴露在HIV感染细胞的外膜,且在HIV病毒体出芽过程中通过与Gag蛋白结合招募ESCRTIII到出芽的部位,从而形成一个复杂的细胞蛋白装置帮助HIV病毒颗粒的释放。消耗病毒感染细胞中的TSG101将导致HIV病毒颗粒的出芽缺陷。Leyla等[6]研究发现,TSG101在辅助耐药株和猴免疫缺陷病毒(simian immunodeficiency virus,SIV)从感染细胞内出芽的过程中也扮演着同样的角色。
2.2 TSG101与其他病毒
EB病毒 (Epstein-Barr virus,EBV)编码的早期蛋白Rat通过超激活一个裂解性基因表达的级联控制着病毒裂解性感染程序的再活化。Chua 等[7]研究发现,TSG101对Rat介导的L-基因活性的激活在EBV裂解性感染周期的完成中起重要作用。TSG101通过在浆膜组装的晚期病毒包膜多泡体分选过程中发挥作用,从而进一步促进EBV的复制。
甲型流感病毒(influenza A virus,IAV)的出芽过程现今被认为是非ESCRT依赖的,但并不意味着TSG101不影响IAV的出芽。血凝素HA是IAV包膜蛋白中的一种,分布在病毒的表面,决定了流感病毒的感染部位在呼吸道。在IAV出芽的过程中若耗竭胞质中TSG101蛋白则会导致HA不能从高尔基复合体中顺利送往细胞膜,不能对子代病毒进行包被,从而影响病毒的出芽[8]。
马尔堡病毒(Marburg virus, MARV)感染后的宿主细胞会表达基质蛋白VP40,TSG101与VP40相互作用在病毒样颗粒(Virus Like Particles,VLPs )出芽中起重要作用。VP40也是埃博拉病毒(Ebola virus, EBO)编码数量最多的结构蛋白,功能类似于反转录病毒中的Gag蛋白,通过与TSG101蛋白特异性结合对病毒的装配和出芽过程起驱动作用。
此外,有研究表明,禽类肉瘤病毒(avian sarcoma virus, ASV)[9]、乙肝病毒(Hepatitis B Virus)[10]、胡宁阿根廷出血热病毒[11](Junin Argentine hemorrhagic fever virus)等病毒的出芽也与TSG101蛋白表达密切相关。
3 TSG101对病毒的作用机制
3.1 TSG101与泛素
ESCRT复合物参与泛素化蛋白质的降解,ESCRT对已泛素化蛋白质的识别和处理能力预示着ESCRT依赖的病毒的释放有可能受泛素化的控制[12-16]。就HIV病毒而言,去泛素化的TSG101蛋白对于Alix非依赖的病毒粒子释放过程是抑制的。而对于无TSG101表达的马传染性贫血病毒(EIAV)来说,病毒颗粒的释放依靠Alix途径,该途径同样受去泛素化的Alix的制约。不仅如此,去泛素化Gag蛋白的存在也是阻止病毒颗粒释放的重要原因之一。虽然没有直接的证据说明泛素和病毒出芽有关,但是近些年越来越多的发现支持此观点。
3.2 TSG101与Nedd4
Nedd4蛋白家族属于泛素连接酶的一种,在各种形式的蛋白质翻译后修饰(post-translational modifications, PTM)的过程发挥重要作用。Nedd4参与病毒出芽过程已经得到证实,如HIV病毒[17]、猫免疫缺陷病毒(FIV)[18]、禽类肉瘤病毒[9]、鼠白血病病毒(MLV)[19]等。
实验证明,当猕猴受到猴免疫缺陷病毒感染后,胞浆内Nedd4水平会大幅度提升。有研究发现TSG101蛋白与Nedd4结合从而招募Gag与TSG101蛋白的复合体进入晚期内体[20]。免疫共沉淀技术(Co-Immunoprecipitation)可从感染细胞的胞浆中分离出Nedd4与TSG101蛋白的复合物,两者结合的机制还需进一步实验证明。TSG101和Nedd4也可分别通过与Gag蛋白结合促进子代病毒的释放,并且TSG101在促进病毒出芽过程中在一定程度上可代替Nedd4的功能[9]。
3.3 TSG101与ARMMs
Joseph等[21]发现了一个内在的细胞机制导致超微小泡从质膜直接释放,该过程被证明病毒通过非MVB依赖的途径在质膜表面直接出芽(direct plasma membrane budding,DPMB)。辅助蛋白ARRDC1(arrestin domain-containing protein 1)通过它的捕获子结构域定位在质膜上,与PASP作用后致使TSG101的定位从内体转移到质膜上,并且介导包含TSG101蛋白、ARRDC1和其他细胞蛋白的超微小泡释放。不同于外生体来源于多泡体,ARRDC1介导的超微小泡(ARRDC1-mediated microvesicles, ARMM)缺乏已知多泡体标志。ARMM的形成需要VPS4-ATP酶,并且被E3连接酶WWP2加强,此酶与ARRDC1作用并且使ARRDC1泛素化。研究表明,DPMB正是由TSG101与ARRDC1的四肽PASP结构域的特异相互作用驱动的。降低感染细胞内ARRDC1蛋白水平会导致病毒出芽缺陷。此机制被证明与许多病毒有关,包括HIV。HIV的Gag蛋白和其他病毒蛋白正是模仿了ARRDC1促进超微小泡释放的机制来介导子代病毒从宿主细胞中的释放。
3.4 TSG101与Gag蛋白的P6区域
在病毒出芽的过程中,病毒蛋白酶裂解Gag 产生一系列新的病毒蛋白和间隔肽 (spacer peptide, SP)。这些新蛋白分别称为基质蛋白 (matrix, MA)、衣壳蛋白 (capsid, CA)、SP1、核衣壳蛋白 (nucleocapsid, NC)、 SP2 和p6, 这些蛋白质重排产生成熟感染性病毒颗粒。P6蛋白的L区携带着富含脯氨酸结构域的高度保守的“PTAP”(Pro-Thr-Ala-Pro)氨基酸序列[22]。此序列与TSG101蛋白特异性结合招募ESCRT-I到病毒出芽位点,继而招募ESCRT-II和ESCRT-III到内涵体膜上以辅助病毒颗粒出芽。
Susan等[23]发现,HIV中P6的保守氨基酸残基S40若发生突变不但会影响Gag蛋白的成熟,而且还对HIV出芽过程有着广泛的影响。
3.5 TSG101与Tom1
Yuko等[24]发现,Tom1(target of Myb1)有TSG101的潜在结合序列,此结合序列是多泡体MVB形成的一个关键调节者。Tom1和其家族蛋白Tom1L1(target of Myb 1-like 1)、Tom1L2共有GAT结构域。研究表明Tom1L1中GAT结构域与泛素特异性结合对已泛素化的蛋白质分选后送往MVB的过程中起重要作用。GAT 结构域中的PYAP序列和C端的PSAP序列负责Tom1L1与TSG101的UEV结构域 结合从而影响病毒出芽,并且Tom1L1依靠TSG101在胞质分裂期间与核内体和中间体联合。
3.6 TSG101与VP40
马尔堡病毒(Marburg virus,MARV)在质膜的装配期间,核衣壳被基质蛋白VP40和包含跨膜糖蛋白(glycoprotein,GP)的病毒包膜包裹。VP40中的PPPY序列是MARV出芽的关键。Urata等[25]研究发现PPPY结构域通过使NP和GP的共表达在相当大程度上增加了VLPs的产生。在MARV中,TSG101与VP40相互作用取决于PPPY域。与马尔堡病毒不同的是,埃博拉病毒(Ebola virus,EBOV)VP蛋白的N端有PTAP和PPEY两个与TSG101结合的区域。TSG101首先直接或间接地与脂筏上(去垢剂不溶)的膜蛋白结合,然后招募VP40(分布在溶于去垢剂的区域)进入脂筏微区域,VP蛋白也对招募起促进作用并在此区域辅助病毒出芽。
3.7 TSG101与NP
根据重组表达,VP40单独能够诱导病毒样颗粒VLPs的形成和释放,这些VP40诱导的VLPs的释放部分依赖于细胞ESCRT机制,这个机制与VP40中L-结构域基序相互反应。和NP的共表达很大程度上通过一个未知的机制提高了VP40诱导的VLPs的出芽。存在于NP中的L-结构域对VLPs的释放是有影响的。ESCRT-I蛋白TSG101被NP招募到NP诱导的核周区域包含体中,在VP40存在的情况下,NP然后被招募到VP40阳性的细胞膜簇上,转而,通过一个NP中C端的PASP L-结构域基序招募TSG101。这个PASP结构域也介导TSG101结合到VLPs的增加,并且它的缺失很大程度上减少了NP在VLPs释放上的正性作用。总而言之,NP通过一个PASP L-结构域基序招募TSG101到VP40阳性出芽部位,从而提高VLPs的出芽[26]。
3.8 TSG101与PI(4,5)P2/Ca2+信号通路
Ehrlich等[27]研究发现,TSG101通过调控PI(4,5)P2/Ca2+信号通路来影响Gag的合成,细胞内Ca2+不仅对Gag在细胞膜上的定位起稳定作用,而且对子代病毒的生成和释放有促进作用。磷脂酰肌醇特异性磷脂酶C(phospholipase C,PLC)可将磷脂酰肌醇-4,5-二磷酸(phosphatidyalinosital-4,5-diphosphate,PIP2)分解成重要的第二信使-二脂酰甘油(diacylglycerol,DAG)和肌醇三磷酸(inositol-1,4,5-triphosphate,IP3)。IP3是水溶性分子,可扩散到内质网膜上,并与其受体结合。IP3的受体是IP3控制的Ca2+通道,结合IP3后开放,促进细胞钙库内的Ca2+迅速释放。研究发现在细胞内Ca2+升高的同时细胞内Gag蛋白表达水平也上升,对Ca2+的进一步释放有诱导作用,并且防止Ca2+浓度过高。Gag对Ca2+的调控能力必须经过PTAP序列和TSG101蛋白结合之后才具备。综上所述,TSG101通过赋予Gag蛋白调节细胞中Ca2+浓度的能力进而影响Gag蛋白的合成和病毒的释放。
4 TSG101抑制剂的研究
HIV病毒颗粒从感染细胞中释放是通过招募正常情况下介导宿主细胞内吞作用功能的蛋白完成,这个过程需要HIV Gag蛋白与宿主细胞蛋白的相互作用。Tavassoli等[28]运用细菌逆向双杂交系统(bacterial reverse two-hybrid)筛选环肽库(cyclic-peptide library)的方法,找到能干扰TSG101与HIV Gag蛋白结合并抑制HIV病毒出胞的肽适体(aptamer)。肽适体是人工体外合成的一段寡核苷酸序列,有与靶分子结合的极高的亲和力和特异性。肽适体与HIV转录正调控蛋白Tat相连后能穿过培养的人类细胞膜,通过消减TSG101来抑制这些细胞产生VLPs。该实验通过肽适体干扰TSG101-Gag的结合、减少VLPs的释放的方式达到治疗HIV感染的目的,肯定了小分子肽类药物阻断病毒与宿主蛋白分子相互作用在抗HIV治疗上的重要意义。Leyla等[6]研究发现,由于TSG101被独特地暴露在HIV感染细胞的外膜,所以TSG101的特异抗体,例如CB8-2,能够与TSG101特异性结合从而减少感染细胞中病毒的产生,因此TSG101可以作为基因治疗的靶点。
5 结 语
TSG101作为病毒出芽过程中一个必要的宿主细胞因子与HIV、IAV、MARV、EB、ASV等病毒的出芽有关,并且通过与泛素、Nedd4、ARMMs、P6、Tom1等相互作用来影响病毒出芽,由此成为病毒在体内扩散传播的门槛。根据它的作用机理设计出相应的病毒抑制剂,将可能在抗病毒药物研究中有新的突破。到目前为止,人类对TSG101基因的研究还处于探索阶段,TSG101与其他病毒是否也存在某种关系,这种关系是否有特异性,TSG101抑制剂是否可以有效地预防疾病等,所有的疑问都需要进一步研究。
[1] Liu FL,Fu SB,Li P.Advances in TSG101 Gene [J].Int J Genet,2007,30:14-18.
[2] Ku P-I,Bendjennat M,Ballew J,et al.ALIX is recruited temporarily into HIV-1 budding sites at the end of Gag[J]. PLoS One,2014,9(5): e96950.
[3] Thomas F,Pierre PL,Christin B,et al.In vitro budding of intralumenal vesicles into late endosomes is regulated by Alix and Tsg101[J].Molecular Biology of the Cell,2008,19(11): 4942-4955.
[4] Luyet PP,Falguieres T,Pons V,et al. The ESCRT-I subunit TSG101 controls endosome to cytosol release of viral RNA [J].Traffic,2008,9(12):2279-2290.
[5] McDonald B,Martin-Serrano.Regulation of TSG101 expression by the steadiness box:a role of TSG101-associated ligase[J].Molecular Biology of the Cell,2008,19(2):754-763.
[6] Leyla D,Hanwen M,Yu Z,et al.TSG101 exposure on the surface of HIV-1 infected cells: implications for monoclonal antibody therapy for HIV/AIDS[J]. Am J Transl Res,2010,2(4):368-380.
[7] Chua HH,Lee HH,Chang SS,et al.Role of the TSG101 gene in Epstein-Barr virus late gene transcription [J].Journal of virology,2007,81(5):2459-2471.
[8] Sumana S,Joseph A,Takeshi M,et al.Type I Interferon imposes a TSG101/ISG15checkpoint at the Golgi for glycoprotein trafficking during Influenza Virus infection[J].Cell Host & Microbe,2013,14(5):510-521.
[9] Gisselle M,Andrew P,Lorna S,et al.Tsg101 can replace Nedd4 function in ASV Gag release but not membrane targeting [J].Virology,2008,377(1):30-38.
[10]Stieler JT,Prange R.Involvement of ESCRT-II in Hepatitis B Virus morphogenesis[J].PLoS ONE,2014,9(3):e91279.
[11]Lu J,Han Z,Liu Y,et al.A host-oriented inhibitor of Junin Argentine hemorrhagic fever virus egress[J].Journal of Virology,2014,88(9):4736-4743.
[12]Chung HY,Morita E,von Schwedler U,et al.NEDD4L overexpression rescues the release and infectivity of human immunodeficiency virus type 1 constructs lacking PTAP and YPXL late domains[J].Journal of Virology,2008,82(10):4884-4897.
[13]Joshi A,Munshi U,Ablan SD,et al.Functional replacement of a retroviral late domain by ubiquitin fusion[J].Traffic,2008,9(11):1972-1983.
[14]Weiss ER,Popova E,Yamanaka H,et al.Rescue of HIV-1 release by targeting widely divergent NEDD4-type ubiquitin ligases and isolated catalytic HECT domains to Gag[J].PLoS Pathogens,2010,6(9):e1001107.
[15]Zhadina M,Bieniasz PD.Functional interchangeability of late domains,late domain cofactors and ubiquitin in viral budding[J].PLoS Pathogens,2010,6(10):e1001153.
[16]Paola S,Kunio N,Robert CP,et al.Ubiquitin conjugation to Gag is essential for ESCRT-mediated HIV-1 budding[J].Retrovirology,2013,10:79.
[17]Lewis B,Whitney S,Hudacik L,et al.Nedd4-Mediated Increase in HIV-1 Gag and Env Proteins and Immunity following DNA-Vaccination of BALB/c Mice[J].PLoS ONE,2014,9(3):e91267.
[18]Calistri A,Del Vecchio C,Salata C,et al.Role of the feline immunodeficiency virus L-domain in the presence or absence of Gag processing: involvement of ubiquitin and Nedd4-2s ligase in viral egress[J].Cell Physiology,2009,210(1):175-182.
[19]Camus G,Segura-Morales C,Molle D,et al.The clathrin adaptor complex AP-1 binds HIV-1 and MLV Gag and facilitates their budding[J].Molecular Biology of cell,2007,18(8):3193-3203.
[20]Lewis B,Whitney S,Hudacik L,et al.Nedd4-Mediated Increase in HIV-1 Gag and Env Proteins and Immunity following DNA-Vaccination of BALB/c Mice[J].PLoS ONE,2014,9(3):e91267.
[21]Joseph FN,Ruo XH,Raymond S,et al.Formation and release of arrestin domain-containing protein 1-mediated microvesicles(ARMMs)at plasma membrane by recruitment of TSG101 protein [J].PNAS,2012,109(11):4146-4151.
[22]Kim SE,Liu F,Im YJ,et al.Elucidation of New Binding Interactions with the Tumor Susceptibility Gene 101 (Tsg101)Protein Using Modified HIV-1 Gag-p6 Derived Peptide Ligands [J].ACS Medicinal Chemistry Letters,2011,2(5):337-341.
[23]Susan MW,Min-Huei Chen,Mahfuz K,et al.The S40 residue in HIV-1 Gag p6 impacts local and distal budding determinants, revealing additional late domain activities[J].Retrovirology, 2013,10:143.
[24]Yuko YI,Tomomi T,Ray I,et al.Recruitment of Tom1L1/Srcasm to Endosomes and the Midbody by Tsg101[J].Cell Structure and Function,2008,33(1):91-100.
[25]Urata S,Noda T,Kawaoka Y,et al.Interaction of Tsg101 with Marburg virus VP40 depends on the PPPY motif,but not the PT/SAP motif as in the case of Ebola virus,and Tsg101 plays a critical role in the budding of Marburg virus-like particles induced by VP40,NP,and GP[J].Journal of virology,2007,81(9):4895-4899.
[26]Olga D,Larissa K,Lea S,et al.Tsg101 is recruited by a late domain of the nucleocapsid protein to support budding of Marburg Virus -Like particles[J].Journal of virology, 2010,84(15):7847-7856.
[27]Ehrlich LS,Medina GN,Photiadis S,et al.Tsg101 regulates PI(4,5)P2/Ca2+signaling for HIV-1 Gag assembly[J].Front Microbiol,2014,225:234.
[28]Tavassoli A,Lu Q,Gam J, et al.Inhibition of HIV budding by a genetically selected cyclic peptide targeting the Gag-TSG101 interaction [J]. ACS Chemitry Biology,2008, 3(12):757-764.
The Action and Mechanism of TSG101 during Virus Budding
XU Yan1, ZHANG Ying2
(1.ClinicalMedicSeven-yearProgram,ChinaMed.Uni.,Shenyang110000;2.The3rdExperim'lTechnol.Ctr.,ChinaMed.Uni.,Shenyang110013)
TSG101 gene is a newly discovered candidate of tumor suppressor genes and locates in the human chromosome XI p1511-p1512. Its product TSG101 protein N-terminal region is isogenous with ubiquitin-conjugated domain (UBC). It was found in recent studies that TSG101 has many important functions and it is closely associated with viral budding, therefore, TSG101 would be a useful anti-virus target for drug design. The role of TSG101 played in the process of virus budding (such as HIV, IAV, MARV, ASV), the mutual action mechanism of TSG101 and proteins (ubiquitin, Nedd4, ARMMs, Tom1, Gag, VP40, NP etc.) in assisting virus budding, and TSG101 inhibitors and other aspects were elaborated in this paper.
TSG101; UBC; virus budding; anti-virus target
辽宁省自然科学基金项目(2014021095);沈阳市科学技术项目(F12-264-4-01)
许岩 女,七年制本科生。研究方向为分子病毒学。E-mail: 576599259@qq.com
* 通讯作者。女,讲师,医学博士。研究方向为TSG101基因与病毒的关系。Tel:024-31939617,E-mail:20769876@163.com
2015-04-17;
2015-07-15
Q939.4
A
1005-7021(2015)06-0090-06
10.3969/j.issn.1005-7021.2015.06.018

