裂谷热病毒Gc蛋白主要抗原区的表达、纯化及鉴定
夏 鹏,沈 丽,魏建超,钟登科,陆莹梅,李蓓蓓,刘 珂,邵东华,邱亚峰,温贵兰,马志永
(1.贵州大学动物科学学院,贵阳550025;2.中国农业科学院上海兽医研究所,上海200241; 3.上海农林职业技术学院动物科学技术系,上海 201600)
·研究论文·
裂谷热病毒Gc蛋白主要抗原区的表达、纯化及鉴定
夏 鹏1,2,沈 丽3,魏建超2,钟登科3,陆莹梅2,李蓓蓓2,刘 珂2,邵东华2,邱亚峰2,温贵兰1,马志永2
(1.贵州大学动物科学学院,贵阳550025;2.中国农业科学院上海兽医研究所,上海200241; 3.上海农林职业技术学院动物科学技术系,上海 201600)
根据裂谷热病毒(Rift valley fever virus, RVFV)M基因(GenBank 登录号:DQ380206)序列,用PCR方法扩增其主要抗原区,将目的基因克隆至原核表达质粒pColdⅠ中,将重组质粒转化到BL21感受态细胞中,诱导表达重组蛋白,将表达蛋白利用His-tag Ni柱进行亲和层析纯化。纯化后的蛋白分别应用SDS-PAGE、Western blot方法鉴定,结果显示,本研究不仅成功表达出Gc蛋白的主要抗原区,而且具有良好抗原性,为后续裂谷热抗原ELISA试剂盒的研制奠定了物质基础。
裂谷热病毒;Gc蛋白;原核表达;抗原性
裂谷热(rift valley fever,RVF)作为一种以蚊子为主要传播媒介的烈性传染病,主要传染反刍动物,也可传染人。动物感染裂谷热后多表现为高烧不退、流涕、厌食、急性腹泻甚至黄疸。犊牛和羔羊的死亡率很高,怀孕母牛羊的流产率达80%~100%[1]。人感染后症状类似于流行性感冒。世界动物卫生组织将其列为法定报告病中A类传染病,我国将其定为一类传染病。
2000年9月,中东地区的阿拉伯半岛和也门爆发此病,仅仅三个月就有1087疑似病例,其中121例死亡[2]。现今非洲东部和南部及阿拉伯半岛地区裂谷热已成周期性流行[3]。世界各国动物性进出口贸易日益频繁,而阿拉伯半岛又毗邻亚欧大陆,所以更应加强对RVF的检疫,同时对RVF疫苗的研制也迫在眉睫。裂谷热没有特征性临床症状,因此个别病例的诊断较为困难耗时,但该病的大面积传播有以下特征:大批母畜流产,新生幼畜大批死亡,以及人群发病。目前的诊断方法主要通过病毒分离、血清学、核酸技术等[4]。
裂谷热病毒(Rift valley fever virus, RVFV)属于布尼亚病毒科(Bunyaviridae)、白蛉热病毒属(Phlebovirus),具包膜,与家族的其他病毒一样,RVFV基因组由三节段的负链RNA组成,分别为L、M、S节段。L片段全长6404 nt,反向编码RNA依赖的RNA聚合酶也称为L蛋白,M片段反向编码4个蛋白,其中主要为糖蛋白Gn、Gc,另外2个次要蛋白为14 kDa的非结构蛋白(NSm)和78 kDa的结构蛋白[5]。S节段长度为1690 nt,利用双向策略,反义链编码核衣壳蛋白(N),正义链编码一个非结构蛋白(NSs),2个相向的开放阅读框之间的基因间区域为91 nt[6]。
糖蛋白对于布尼病毒在高尔基体内的成熟具有重要作用,Gn和Gc蛋白参与高尔基体的定位过程。有报道显示,Gn蛋白C端的48个氨基酸部位 (包括20个氨基酸的跨膜区域和邻近的蛋白C末端28个氨基酸) 就是RVFV的高尔基体定位信号,Gc蛋白通过物理作用与Gn蛋白相结合从而定位于高尔基体[7]。N蛋白是RVFV主要的免疫原,而病毒表面的Gn和Gc蛋白含有中和表位,也能刺激机体产生抗体[8,9]。RVFV囊膜糖蛋白(G)是由M基因片段编码的,翻译后修饰过程中裂解为两个蛋白(Gn和Gc糖蛋白)[10,11],是病毒的主要免疫原结构蛋白。本项目分别构建原核表达质粒,在BL21感受态细胞中,通过IPTG诱导表达截短囊膜蛋白基因片段,重组蛋白经Ni柱His·Band亲和层析纯化后,获得纯化蛋白,为后续快速检测RVF奠定基础。
1 材料与方法
1.1 实验材料原核表达质粒PcoldⅠ、大肠杆菌感受态DH5α和大肠杆菌感受态BL21(DE3)细胞均由本实验室保存;各种限制内切酶分别购自Fermentas公司;Ni NTA His Bind resin蛋白纯化试剂盒购自Novagen公司;各种DNA Marker均购自北京天根生物公司;抗His标签鼠源单抗、辣根过氧化物酶( HRP) 标记的羊抗鼠二抗购自Sigma公司;In-Fusion®HD Cloning Kit试剂盒购自Clontch公司;小提质粒试剂盒和DNA胶回收试剂盒购置于Axygen公司;氨苄青霉素和IPTG购置于Sigma公司;化学合成裂谷热病毒M基因(GenBank登录号:DQ380206)克隆于pUc57质粒(M-pUc57),由Invitrogen公司合成。
1.2 方法
1.2.1 引物设计 根据裂谷热病毒M基因(GenBank登录号:DQ380206),DNAStar生物软件分析Gc基因,确定其主要抗原区Gc1(2114-2476)、Gc2 (2609-3040),用Primer Premier 5.0分别设计上下游引物。Gc1-F:5'-ATCGAAGGTAGGCATCTCC AGAATCACCACTTGCT-3',Gc1-R:5'-TCTAG ACTGCAGGTCTCCACATTGCTCAAAACAC-3';Gc2-F:5'-ATCGAAGGTAGGCATCACAGACTTT GATGGCTC-3',Gc2-R:5'-TCTAGACTGCAGGT CTACAGAGCCCTTAGAGAAAG-3'。
1.2.2 PCR扩增 以化学合成的裂谷热M片段(GenBank登录号:DQ380206)为模板,用特异性引物PCR扩增Gc基因的主要抗原区Gc1、Gc2。PCR反应体系如下:1μL模板、0.2μL LA Taq酶、上下游引物各0.2 μL、2 μL 10×Buffer、3.2 μL dNTP、dd H2O补足20 μL。PCR反应条件:95℃预变性 4 min;95℃ 45 s,55℃ 45 s,72℃ 45 s,共35个循环;72℃延伸 5 min。1%的琼脂糖凝胶电泳鉴定。
1.2.3 原核表达质粒的构建 DNA胶回收试剂盒回收纯化PCR产物和单酶切原核表达质粒PcoldⅠ,按照In-Fusion®HD Cloning Kit试剂盒说明,55℃连接15 min,转化到大肠杆菌感受态DH5α中,摇菌,涂含有氨苄青霉素抗性的LB平板,37℃震荡培养1 h,涂含有氨苄青霉素抗性的LB平板,37℃温箱培养过夜,挑取单克隆菌落于LB培养液中5 h,用质粒小提试剂盒提质粒,以提取质粒为模板,特异性引物PCR方法扩增鉴定,筛选PCR鉴定正确的质粒送生物公司测序。测序正确后阳性质粒分别命名为PcoldⅠ- Gc1、PcoldⅠ- Gc2。
1.2.4 诱导表达条件的优化及表达产物的鉴定 对含有重组阳性质粒PcoldⅠ-Gc1、PcoldⅠ-Gc2的BL21 (DE3)宿主菌进行培养温度和诱导条件的优化,确立按1∶100的比例接种于新鲜的LB(含氨苄青霉素抗性)培养液,37℃震荡培养3 h,IPTG加至终浓度为1.0 mmol/L,18℃振荡培养24 h。取诱导表达24 h的菌液,离心取沉淀,用binding buffer悬浮于冰上超声破碎处理,超声后的菌体,10 800×g、4℃离心25 min,收集上清并用5×SDS沸水浴5~10 min制样,菌体用含有6 mol/L 尿素的binding buffer重新悬浮,4℃放置过夜后并制样(同上清),分别取上清和沉淀样品,用15% SDS-PAGE鉴定表达形式。
1.2.5 重组蛋白的纯化 将诱导表达的蛋白,按照His-tag Ni柱进行亲和层析纯化说明书纯化重组蛋白,用15%的SDS-PAGE检测纯化效果。
1.2.6 Western blot检测重组蛋白的表达 重组蛋白在SDS-PAGE电泳后,0.24A恒安电流下转NC膜(硝酸纤维素膜)2 h,同时设立阴性对照,室温封闭2 h,用TBST洗涤3次,一抗分别为抗His标签鼠源单克隆抗体(稀释度为1∶5000),以及本实验室制备和鉴定的兔抗RVFV Gc1和Gc2多克隆抗体(效价达1∶256 000,稀释度为1∶1000)[14],4℃孵育过夜,用TBST洗膜3次,二抗为辣根过氧化物酶(HRP)标记的羊抗鼠,稀释度为1∶10 000,二抗室温孵育2 h,TBST孵育3次,加显色底物显色,分析Gc1和Gc2的免疫原性。
2 结果
2.1 原核表达质粒的构建与鉴定根据DNAStar分析裂谷热病毒M片段的Gc基因的主要抗原区Gc1和Gc2大小分别为363 bp和432 bp,克隆入原核表达质粒pColdⅠ,用质粒小提取试剂盒提质粒,以提取质粒为模板,特异性引物进行PCR扩增,用1% 琼脂糖核酸凝胶电泳鉴定,结果显示条带与预期大小一致(图1)。把鉴定正确的质粒送上海桑尼生物公司和Invitrogen生物公司测序,鉴定结果表明序列正确没有发生突变。
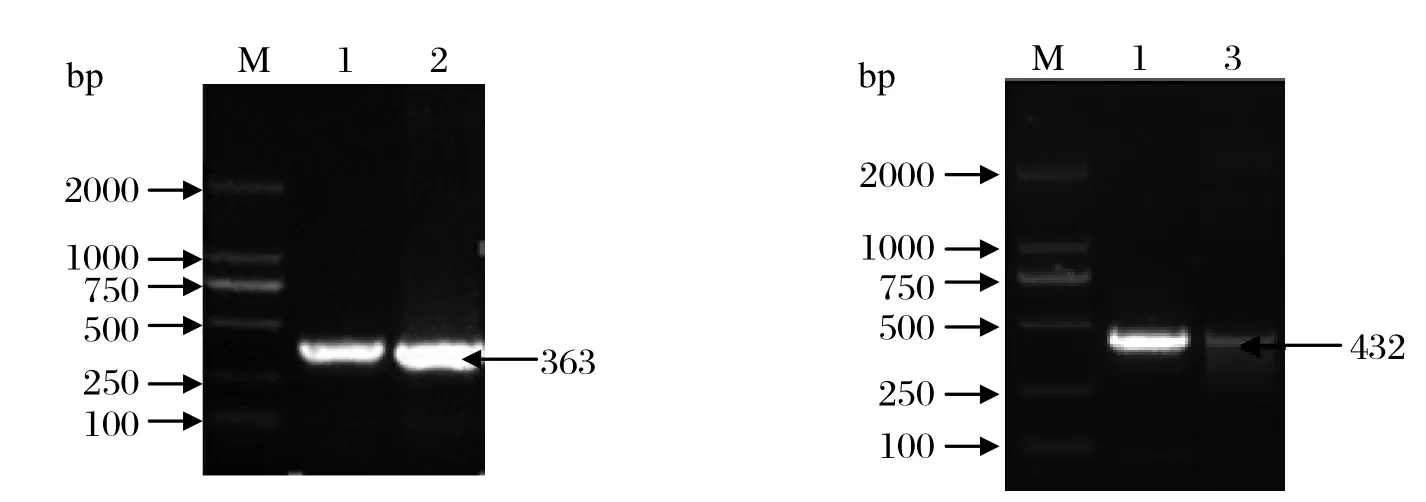
图1 裂谷热病毒Gc1、Gc2的PCR扩增产物电泳图谱Fig.1 Amplifi cation of Gc1 and Gc2 of Rift valley fever virus
2.2 重组蛋白的诱导表达鉴定及纯化将重组阳性质粒pColdⅠ-Gc1和pColdⅠ-Gc2转化到BL21(DE3)细胞中,37℃摇床震荡培养至OD600达0.4~0.6,以终浓度为1 mmol/L 的IPTG在18℃诱导24 h。取未诱导的菌液、未超声诱导的菌液、超声的诱导菌液上清、超声的诱导菌液沉淀,用15%的SDS-PAGE电泳鉴定。结果显示,Gc1、Gc2分子量分别约为13 kDa和15 kDa(图2、图3),与理论值一致且可以确定其表达产物在包涵体中。按1.2.4诱导表达的条件和步骤,得到超声后沉淀溶于含有6 mol/L 尿素的binding buffer,4℃过夜。样品用0.22μm膜过滤后,按Ni NTA His·Bind resin蛋白纯化试剂盒步骤纯化蛋白,取有波峰批次样品,15%的SDS-PAGE电泳鉴定纯化效果,结果显示条带比较单一。

图2 重组Gc1蛋白表达产物的鉴定及纯化Fig.2 Analysis of expression and purifi cation of recombinant protein Gc1
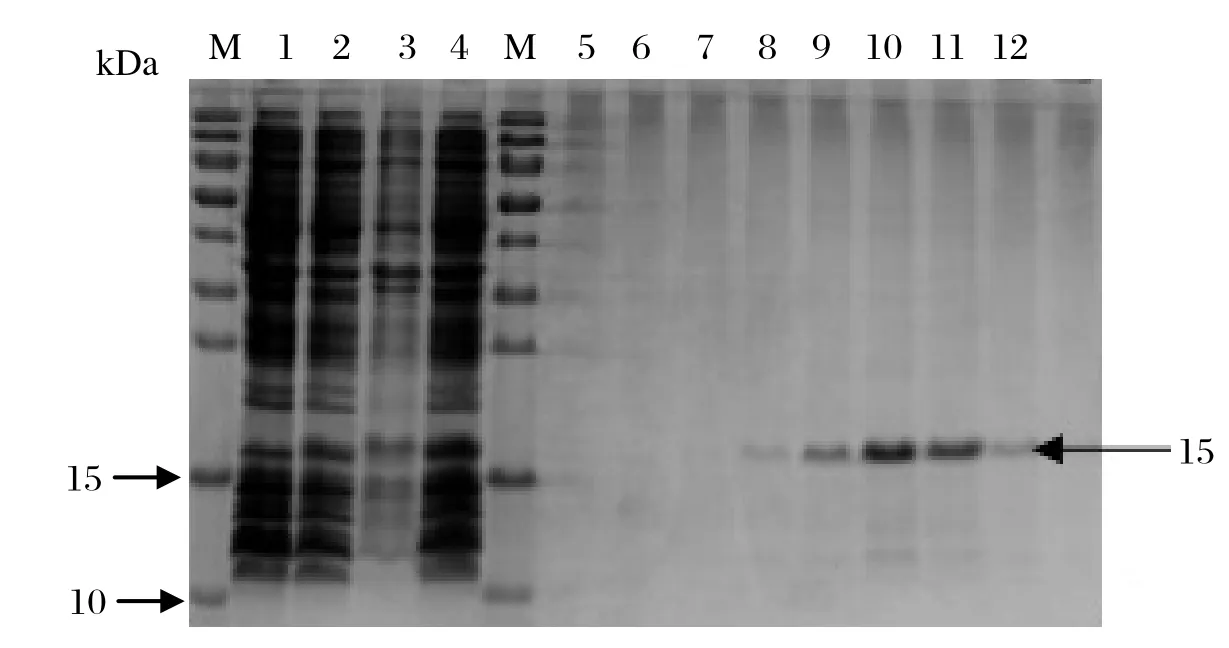
图3 重组pColdⅠ-Gc2蛋白表达产物的鉴定及纯化Fig.3 Analysis of expression and purifi cation of recombinant protein Gc2
2.3 纯化蛋白的Western bolt分析Western blot结果显示,在硝酸纤维素膜上出现与目的蛋白大小一致的条带,而空载体泳道并未显示任何条带,表明所构建的pColdⅠ-Gc1、pColdⅠ-Gc2重组表达菌,诱导表达蛋白能够被商品化的抗His标签鼠源单抗和兔抗RVFV Gc1和Gc2多克隆抗体(本实验室保存),证明诱导表达的目的蛋白具有良好的抗原性。
3 讨论
裂谷热作为一种最急性或急性人兽共患传染病,同时也是烈性虫媒传染病,蚊子是其重要的传播媒介,病毒在脊椎动物寄主和蚊子之间循环[11]。虽然,我国目前还没有发现裂谷热疫情,但近年来,随着中非贸易合作规模的日趋加大,人员流动和交通运输愈加频繁,地域边界和天然屏障已很难有效阻止虫媒病毒的入侵,传入的风险也与日俱增,所以裂谷热的防控一直备受关注。
图4 重组蛋白 Gc1、Gc2的Western blot鉴定Fig.4 Identifi cation of recombinant protein Gc1, Gc2 by Western blot
如今,世界各国动物性进出口贸易日益频繁,而阿拉伯半岛又毗邻亚欧大陆,所以更应加强对RVF的检疫,同时对RVF疫苗的研制也迫在眉睫。然而,我国在裂谷热的检测研究领域还基本上处于空白。面对裂谷热传入的威胁,我国应提高警惕,密切注视国外疫情变化,并建立一系列的检测技术,做好技术储备,尤其是建立快速、准确、简便、特异的RVF实验室检测方法,对于防止裂谷热从口岸传入我国具有重要的意义。
由于RVFV属于高危病毒,需要在生物安全四级实验室操作,所以目前世界上仅有少数几个国家的实验室能开展裂谷热的研究,主要集中在欧美等国。关于裂谷热病毒的检测,国外已经建立了多种检测抗原抗体的技术,比如:病毒分离、RTPCR、荧光定量PCR、ELISA等;检测抗体的方法有血凝试验、间接免疫荧光、Western blot、ELISA等[13]。由于裂谷热康复病人和动物可携带抗体,从防止裂谷热病毒从口岸传入来看,在建立检测裂谷热抗体技术的同时,检测RVFV抗原或基因技术也是非常实用有效的。从裂谷热爆发现场检测的实际应用结果来看,ELISA方法具有快速、敏感的优点,是检测RVFV的首选检测技术[14]。
本研究成功表达了Gc蛋白的抗原区,获得的纯化蛋白具有良好的抗原性,可以被特异性抗体识别,为后续快速检测RVFV方法的建立奠定了基础。
[1] Wallance D B, Ellis C E, Espach A, et al.Protective immune response induces by different recombinant vaccine regimes to Rift Valley fever [J].Vaccine, 2006, 24(49-50)∶ 7181-7189.
[2] Balkhy H H , Memish Z A.Rift Valley fever∶an uninvited zoonosis in the Arabian peninsula [J].Int J Antimicrob Agents, 2003, 2(1)∶ 153-157
[3] Liu L, Celma C C, Roy P.Rift Valley fever virus structural proteins∶ expression characterization andassembly of recombinant proteins [J].Virol J, 2008, 82(2)∶ 142-158.
[4] Oreshkova N, van Keulen L, Kant J, et al.A single vaccination with an improved nonspreading Rift Valley fever virus vaccine provides sterile immunity in lambs[J].PLoS One, 2013, 8(10)∶ 1-10.
[5] Muller R, Poch O, Delarue M , et al.Rift Valley fever virus L segment:correction of the sequence and possible functional role of newly identified regions conserved in RNA-dependent polymerases[J].J Gen Virol, 1994, 75(pt6)∶ 1345-1352.
[6] Mandell R B, Koukuntla R, Mogler L J, et al.A replication-incompetent Rift Valley fever uaccine∶chimeri virus-like particles protect mice and rats against lethal challenge[J].Virology, 2010, 397(1)∶ 187-198.
[7] Gerrard S R, Nichol S T.Characterization of the Golgi retention motif of Rift Valley fever virus G(N) glycoprotein[J].J Virol, 2002, 76(23)∶ 12200-12210.
[8] Flick R, Bouloy M.Rift Valley fever virus.[J].Curr Mol Med, 2005, 5(8)∶ 827-834.
[9] Gerrard S R, Nichol S T.Characterization of the Golgi retention motif of Rift Valley fever virus G(N) glycoprotein[J ].J Virol, 2002,76(23)∶ 12200-12210.
[10] Jäckel S, Eiden M, Balkema-Buschmann A, et al.A novel indiret ELISA based on glycoprotein Gn for detection of IGg antidodies against Rift Valley fever virus in small ruminants[J].Res Vet Sci, 2013, 95(2)∶ 725-730.
[11] Bird B H, Nichol S T, Maclachlan N J.Rift Valley fever virus[J].J Am Vet Med Assoc, 2009, 234(7)∶ 883-893
[12] 万小颖, 秦立志, 施丽娟, 等.兔白细胞介素-10基因的克隆、原核表达及其多克隆抗体的制备[J].畜牧兽医学报, 2013, 44(5)∶ 788-795.
[13] Sall A A, Macondo E A, Sène O K, et al.Use of reverse transcriptase PCR in early diagnosis of Rift valley fever [J].Clin Diagn Lab Immunol, 2002, 9(3)∶ 713-715.
[14] Näslund J, Lagerqvist N, Habjan M.Vaccination with virus-like particles protects mice from lethal infection of Rift Valley Fever Virus[J].Virology, 2009, 385(2)∶ 409-415.
EXPRESSION, PURIFICATION AND IDENTIFICATION OF THE MAJOR ANTIGENIC REGION OF GC PROTEIN OF RIFT VALLEY FEVER VIRUS
XIA-Peng1,2, SHEN-Li3, WEI Jian-chao2, ZHONG Deng-ke3, LU Ying-mei2, LI Bei-bei2, LIU Ke2, SHAO Dong-hua2, QIU Ya-feng2, WEN Gui-lan1, MA Zhi-yong2
(1.College of Animal Science,Guizhou University, Guiyang 550025, China; 2.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 3.Department of Animal Science and Technology, Shanghai Vocational and Technical College of Agriculture and Forestry, Shanghai 201600, China)
The major antigenic region fragments were designed and amplifi ed with PCR according to the M whole genome sequence of Rift valley fever virus (RVFV) in GenBank (GenBank ACCESSION: DQ380206).The synthesized gene was sub-cloned into plasmid Pcold I, and the recombinant protein was induced by iptg after the recombinant plasmid was transformed into E.coli BL21 competent bacteria.The expressed protein was purified with His-Tag Ni+.The results of SDS-PAGE and Western blot demonstrated that the purifi cation of protein was successfully expressed with good antigenicity.The research makes a huge contribution to develop an ELISA kit for detecting Rift valley fever virus.
Rift valley fever virus; Gc protein; prokaryotic expression; anfi genicity
S852.659.5
:A
:1674-6422(2015)01-0015-06
2014-12-02
国家科技支撑计划(2013BAD12B05); 国家自然科学基金(31302116);上海高校青年教师培养资助计划(ZZnlzl2003)上海农林职业技术学院院级科研项目(091227)
夏鹏,男,硕士研究生,预防兽医学专业
温贵兰,E-mail:guilanwen@hotmail.com;马志永,E-mail:zhiyongma@shvri.ac.cn

