伊犁黑蜂蜂胶对变形链球菌属及其生物膜代谢影响研究
伊犁黑蜂蜂胶对变形链球菌属及其生物膜代谢影响研究
祖力卡尔江·阿合买提1, 李艳2, 孟凡琦1, 赵今1
(1新疆医科大学第一附属医院牙体牙髓科·新疆维吾尔自治区口腔医学研究所, 乌鲁木齐830054;
2新疆医科大学第五附属医院口腔科, 乌鲁木齐830011)
摘要:目的探讨伊犁黑蜂蜂胶乙醇提取物(Ethanol extract of Propolis, EEP)与氟化钠(NaF)对致龋变形链球菌属产酸、产糖代谢关键酶乳酸脱氢酶(Lactate dehydrogenase, LDH)与葡萄糖基转移酶(Glycosyltransferase, GTF)及基因表达的影响及其防龋机制。方法分别培养游离状态与生物膜状态下生长的变形链球菌、远缘链球菌,以含梯度浓度EEP的脑心浸液培养基(Brian Heart Infusion,BHI)作为实验组,50 mg/L NaF的BHI培养基作为阳性对照组,以不添加任何药物的BHI培养基作为阴性对照组。各组与不同生长状态的细菌作用18 h。采用还原性辅酶I氧化法测定乳酸脱氢酶活性。硫酸铵盐析结合超滤离心法提取GTFs粗酶,蒽酮法测定GTFs活性。RT-qPCR法测定各组LDH编码基因ldh表达和各组GTFs编码基因gtfb、gtfc、gtfd表达。结果在游离状态与生物膜状态下,变形链球菌、远缘链球菌各实验组和NaF组LDH活性均明显受到抑制(P<0.05)。在游离状态和生物膜状态下,EEP组、NaF组变形链球菌GTFs活性没有变化(P>0.05)。游离状态时,变形链球菌、远缘链球菌实验组和NaF组ldh表达明显受到抑制(P<0.05);生物膜状态下,变形链球菌实验组在1、1/2、1/4MBEC浓度时ldh表达受到抑制(P<0.05),远缘链球菌实验组在1、1/2、1/4、1/8MBEC浓度时ldh表达受到抑制(P<0.05),NaF组细菌在ldh表达差异没有统计学意义(P>0.05)。游离状态与生物膜状态下,变形链球菌实验组gtfb、gtfc、gtfd基因表达与阴性对照组差异无统计学意义(P>0.05)。游离与生物膜生长状态下,变形链球菌NaF对gtfb基因表达有促进作用(P<0.05)。结论伊犁黑蜂蜂胶是通过抑制产变形链球菌属糖代谢途径LDH活性及其转录来抑制变形链球菌产酸,从而达到防龋的效果。
关键词:蜂胶; 变形链球菌属; 乳酸脱氢酶; 葡萄糖基转移酶; 荧光定量PCR
中图分类号:R780.1文献标识码:A
doi:10.3969/j.issn.1009-5551.2015.07.011
[收稿日期:2015-04-08]
基金项目:新疆重大疾病医学重点实验室—省部共建国家重点实验室培育基地开放课题(SKLIB-XJMDR-2014-Y3)
作者简介:贺家勇(1974-),男,本科,主治医师,研究方向:肿瘤的基础与临床研究。
In vitro study of effect in Yili dark propolis on Mutans Streptococci
metabolism in both planktonic and biofilm state
Zulkar Ahmat1, LI Yan2, MENG Fanqi1, ZHAO Jin1
(1DepartmentofEndodontics,TheFirstAffiliatedHospitalofXinjiangMedicalUniversity.
ResearchInstitutionofStomatologyofXinjiangUygurAutonomousRegion,Urumqi830054,China;
2DepartmentofStomatology,TheFifthAffiliatedHospitalofXinjiangMedicalUniversity,
Urumqi830011,China)
Abstract:ObjectiveTo expolore effect of ethanol extract of Propolis (EEP) and NaF on bacteria′s lactate dehydrogenase(LDH) and glycosyltransferase(GTFs) activity and transcription of related coding gene on mechanism of Caries-preventive. MethodsStreptococcus mutans and Streptococcus sobrinus in both planktonic and biofilm state were incubated,which were interacting with BHI culture medium which containing various concentration of EEP; BHI culture medium which containing 50mg/L NaF, and BHI culture medium were interacted for 18 hours. Coenzyme I reduced method was used to assay LDH activity of each group. GTFs crude enzyme was extracted from supernatant ;anthrone method was used to calculate GTF activity .Total RNA was extracted by Trizol, and levels of ldh gtfb, gtfc, gtfd were tested by means of RT-qPCR. ResultsThe significant inhibition of LDH activity found between all study groups and NaF group compared to negative control in both planktonic and biofilm of Streptococcus mutans and Streptococcus sobrinus after interaction (P<0.05). As for planktonic state of Streptococcus mutans and Streptococcus sobrinus, after interaction with all groups, significant down-regulation of ldh was detected in both study group and NaF group (P<0.05). ldh down-regulation ratio in study group was greater than NaF group (P<0.05); to the state of biofilm, Streptococcus mutans after interaction with all groups, study groups contain MBEC,1/2,1/4MBEC EEP significantly down-regulated ldh expression compared to the negative control (P<0.05); for Streptococcus sobrinusbiofilm, all concentrations of EEP in study group significantly down-regulate ldh expression compared to the negative control (P<0.05). While NaF group in neither Streptococcus mutans and Streptococcus sobrinus didn't show difference to negative control (P>0.05). In both planktonic and biofilm state of Streptococcus mutans, expression of gtfb, gtfc, gtfd weren't affected by EEP in study group, as for positive control group, NaF upregulated the gtfb expression. ConclusionPossible mechanism of Yili dark Propolis inhibiting acid production of Mutans Streptococci is inhibiting LDH activity as well as down regulating ldh gene expression in both planktonic and biofilm state. Propolis has little affect on the GTF activity and gtfs gene expression.
Key words: propolis; Mutans Streptococci; lactate dehydrogenase; glycosyltransferase; real-time PCR
变形链球菌、远缘链球菌与人类龋病发生关系最为密切[1]。有效控制口腔菌斑中变形链球菌属及其毒力因子可以降低龋病的发生。乳酸脱氢酶(LDH)与葡萄糖基转移酶(GTF)是变形链球菌属糖代谢途径中的关键酶。由于化学药物控制口腔微生物有着诸多局限性[2-3],天然药物防龋逐渐成为了防龋研究的热点。蜂胶是一种药理作用非常宽泛的天然药物[4-6]。有大量研究发现蜂胶有防龋活性[4-5,7-8]。然而,蜂胶的化学组成与药理活性因地域、气候及植物来源不同而呈现高度的异质性[9-13],且蜂胶防龋机制尚未明确。本课题组为探讨伊犁黑蜂蜂胶可能的防龋机制,对变形链球菌致龋毒力因子的影响进行了系列研究,前期研究发现伊犁黑蜂蜂胶对不同状态下变形链球菌属的生长、产酸毒力因子有显著的抑制作用,对变形链球菌产糖毒力因子有抑制活性,并测得伊犁蜂胶乙醇提取物对变形链球菌最低抑菌浓度(Minimum Inhibitory Concentration,MIC)及最低生物膜清除浓度(Minimum biofilm eradication concentration, MBEC)[5]。为进一步研究伊犁黑蜂蜂胶对变形链球菌产酸、产糖抑制机制,本研究通过伊犁黑蜂蜂胶对不同状态下变形链球菌乳酸脱氢酶、葡萄糖基转移酶及其编码基因的影响,分析伊犁黑蜂蜂胶抑制变形链球菌产酸、产糖的原因,并探讨其可能的防龋机制。
1材料与方法
1.1实验菌株与菌液制备国际标准菌株变形链球菌(Streptococcus mutans ATCC25175)、远缘链球菌(Streptococcus sobrinus ATCC 6715)购于美国ATCC公司(American Type Culture Collection)。BHI血琼脂平板上分别接种变形链球菌与远缘链球菌冻干株,80%氮气、20%二氧化碳、37℃条件下厌氧培养48 h后,观察平板有无菌落生长或菌落生长形态,随机选取几个单个菌落革兰氏染色显微镜下观察鉴定,确定纯培养后,再次挑取典型菌落接种于BHI血琼脂平板,80%氮气、20%二氧化碳、37℃条件下厌氧培48 h,挑取形态均匀的单菌落放入BHI液体培养基,采用Mcfarland法调定细菌悬液浓度约为3×106暂存。
1.2实验药品的制备 新疆伊犁黑蜂蜂胶醇粗提物制备蜂胶采自伊犁尼勒克县种蜂场。将粗蜂胶置于-20℃冰箱中过夜后在研钵内粉碎,使用水浴法(m∶v=1∶8)在70℃下水浴除蜡,再用冷浸法提纯蜂胶。称取15 g除蜡蜂胶粉碎后按照固液比1∶5的比例,加70%乙醇75 mL,封口后浸泡2 w。滤去沉渣,蜂胶原重量减去沉渣干燥后的重量,配制成100 mg/mL蜂胶乙醇溶液,用1 mol/L NaOH调整pH=7.0后经0.22 μm的无菌滤器过滤备用。
1.3实验仪器与试剂超声波细胞粉碎机(宁波新芝生物科技股份有限公司),核酸蛋白测定仪(美国Thermo scientific 型号Nanodrop 1000),常规PCR 仪(美国伯乐Bio-Rad,型号 C100),实时荧光PCR仪(美国伯乐型号 CFX96)。伊犁黑蜂蜂胶(新疆伊犁尼勒克县种蜂场),脑心浸液培养基(Brain Heart Infusion,BHI:美国BD),脱纤维蛋白无菌羊血(新疆医科大学实验动物中心提供),乳酸脱氢酶试剂盒(南京建成生物有限公司,批号:A020-2),Trizol裂解液(美国 Invitrogen,批号 93908-520),SYBRGreen Master Mix(美国Thermo scientific,批号00166002),RevertAidfirst strand cDNA Synthesis kit反转录第一链cDNA合成试剂盒(美国Thermo scientific,批号00145469)。
1.4不同状态细菌的培养游离状态:15 mL无菌离心管内加入1 mL菌悬液与5 mLBHI液体培养基,轻摇混匀,封口膜封闭管口,放入摇床,280 r/min、37℃下厌氧培养24 h。生物膜状态: 6孔细菌培养板分别加入细菌悬液 1 mL和5 mL含1%蔗糖BHI液体培养基(pH=7.0)混匀,37℃下厌氧培养24 h后观察有无细菌生物膜形成。
1.5实验分组根据本课题组前期实验得到伊犁蜂胶乙醇提取物对变形链球菌的最低抑菌浓度 (Minimum Inhibitory Concentration, MIC)为0.78 mg/mL;对变形链球菌生物膜的最低生物膜清除浓度(Minimum biofilm eradication concentration, MBEC)为6.25 mg/mL;对远缘链球菌的MIC为0.39 mg/mL,MBEC为1.56 mg/mL[5]。本实验采用完全随机设计,根据MIC与MBEC浓度划分实验组。每组样本设立6个平行样本,每个样本测定2次以减少随机误差。不同生长状态变形链球属菌分组:阴性对照组:未加入任何药物的BHI液体培养基(pH=7.0)。阳性对照组:含50 mg/L氟化钠BHI液体培养基(pH=7.0)。游离实验组:分别含1、1/2、1/4、1/8MIC浓度EEP的BHI液体培养基(pH=7.0)。生物膜实验组:分别含1、1/2、1/4、1/8MBEC浓度EEP的BHI液体培养基(pH=7.0)。
1.6乳酸脱氢酶活性测定分别收集药物作用后不同状态组细菌沉淀,加5 mL磷酸盐缓冲液(0.1 mol/L,pH 6.2)重悬2次,以1 mL含5 mg/mL溶菌酶TRIS-HCL缓冲液混匀悬浮37℃孵育1 h;冰浴下瞬时多次超声破碎菌细胞,20 KHz,功率300 W。将产物4℃、12 000 r/min离心20 min,收集上清液,BCA蛋白定量试剂盒测定各个样本蛋白浓度,采用还原性辅酶I法,用乳酸脱氢酶试剂盒测定各个样本乳酸脱氢酶活性,具体操作步骤:按照表1在各个反应孔中加入相应的试剂并吹打混匀,37℃孵育15 min;在各个孔中加入25 μL二硝基苯肼混合均匀,37℃孵育15 min,加入250 μL 0.4 mol/L NaOH混匀,室温放置5 min,全波长酶标仪测定450 nm吸光值(每个样品设立2个副孔控制系统误差)。乳酸脱氢酶活性的计算:乳酸脱氢酶活性(IU/L)=(测定管吸光度值-对照管吸光度值)÷(标准管吸光度值-空白管吸光度值)。

表1 乳酸脱氢酶活性测定操作步骤/μL
1.7葡萄糖基转移酶活性测定分别向各组离心收集的菌细胞沉淀加入0.4 mol/L 氢氧化钠溶液5 mL反复吹打重悬、离心3次(10 000 r/min,10 min),收集上清液,以葡聚糖为标准品,蒽酮法测定多糖含量。分别收集各组离心收集的培养基上清液,向其中少量多次加入固体硫酸铵达到60%浓度,4℃下放置24 h;12 000 r/min,离心30 min,收集沉淀,加入5 mL磷酸盐缓冲液溶解;将溶解液转入孔径为10 Kd超滤离心管(12 000 r/min,15 min)离心2次,弃去管底水;收集超滤离心管滤膜以上葡萄糖基转移酶粗酶,PierceBCA蛋白定量分析试剂盒测定粗酶浓度(具体操作步骤严格按照生产商说明书法微孔检测方案)。将测定胞外多糖以及粗酶浓度的数据导入到Excel 2010,并使用Excel 2010对导入数据进行处理与储存,制作标准曲线,计算酶活性。
1.8RT-qPCR 测定ldh、gtfb、gtfc、gtfd基因表达情况逆转录实时荧光定量PCR操作步骤:将药物作用18 h的菌液,4℃、10 000 r/min 离心30 min,收集细菌沉淀,按照TRIZOL试剂说明书进行细菌总RNA的提取。用反转录第一链cDNA合成试剂盒、RevertAid first strand cDNA Synthesis kit:(Thermo scientific)进行RNA的反转录。目的基因引物序列为:内参基因16srRNA上游序列5′-GGCGACGCTCTTGATCTTAG-3′,下游序列5′-GGTTAGCAGCAACGAGGAAG-3′:ldh基因上游引物序列5′-GGCGACGCTCTTGATCTTAG-3′,下游序列5′-CTACGCATTTCACCGCTACA-3′;gtfb基因上游引物序列5′-TGCCGCAGTCCCTTCTTATTC-3′,下游序列5′-GCCATGTATTGCCCGTCATCT-3′;gtfc基因上游引物序列5′-GTGCGCTACACCAATGACAGAG-3′,下游序列5′-GCCTACTGGAACCCAAACACCTA-3′;gtfd基因上游引物序列5′-TACCTTGGGCACCACAACACT-3′,下游序列5′-TGCCGCCTTATCATCCTCACT-3′。实时荧光定量PCR半定量测定基因表达的反应体系为:cDNA模板2 μL,PCR 上游引物0.4 μL(10 μM),PCR 下游引物0.4 μL(10 μM),SYBR Green Mix 12.5 μL, ddH2O29.7 μL,总体系25 μL。反应条件:预变性95℃ 30 s后40个循环(95℃,5 s变性; 60℃,30 s延伸;60℃~95℃绘制溶解曲线)。每个样品设立2个副孔。结果利用2-△△CT法对其进行分析:分别求出6个平行样本待测基因和内参基因16sRNA平均Ct值后,应用内参基因16sRNA对同种培养状态下的未用药组和用药组进行校正:△Ct(对照组)=对照组X基因Ct值-对照组16RNA基因Ct值;△Ct(待测组)=待测组X基因Ct值-待测组16sRNA基因Ct值。对照组和待测组的△Ct进行归一化:△△Ct=△Ct(待测样本)-△Ct(校准样本);根据△△Ct算出待测组与对照组间X基因的表达差异(W):W=2-△△CT。

2结果
2.1蜂胶对变形链球菌属乳酸脱氢酶的影响
2.1.1各组药物对游离生长状态变形链球菌属乳酸脱氢酶活性的影响在游离生长状态下,变形链球菌、远缘链球菌各实验组和阳性对照组乳酸脱氢酶活性均明显受到抑制(P<0.05)。变形链球菌实验组在1、1/2MIC浓度时,乳酸脱氢酶活性低于阳性对照组,差异有统计学意义(P<0.05);变形链球菌实验组在1/8MIC浓度时及阴性对照组乳酸脱氢酶活性高于阳性对照组,差异有统计学意义(P<0.05);远缘链球菌实验组在1、1/2、1/4MIC浓度时乳酸脱氢酶活性低于阳性对照组,差异有统计学意义(P<0.05);阴性对照组乳酸脱氢酶活性高于阳性对照组,差异有统计学意义(P<0.05),见表2。
2.1.2各组药物对生物膜生长状态变形链球菌属乳酸脱氢酶活性的影响在生物膜生长状态下,变形链球菌、远缘链球菌各实验组乳酸脱氢酶活性明显受到抑制(P<0.05)。阳性对照组与阴性对照组相比乳酸脱氢酶活性明显受到抑制(P<0.05)。变形链球菌实验组在1、1/2MBEC浓度时,乳酸脱氢酶活性低于阳性对照组,在1/8MBEC浓度时,乳酸脱氢酶活性高于阳性对照组,差异有统计学意义(P<0.05)。远缘链球菌实验组在1、1/2、1/4MBEC浓度时,乳酸脱氢酶活性低于阳对照性组,差异有统计学意义(P<0.05),见表3。

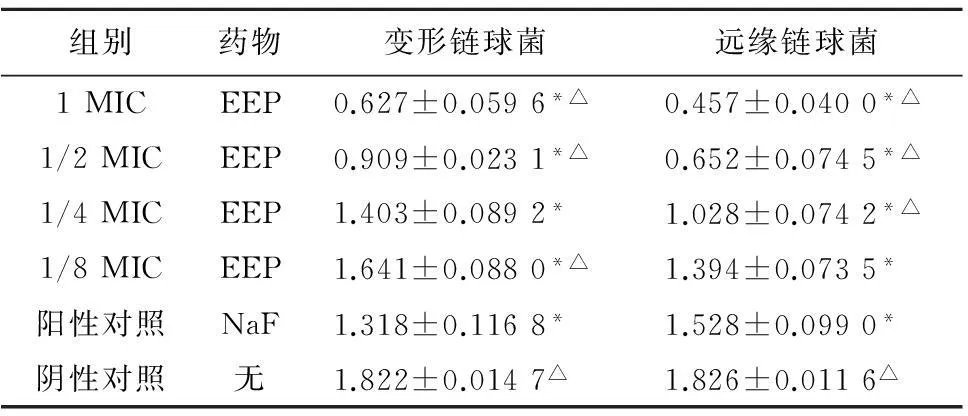
组别药物变形链球菌远缘链球菌1MICEEP0.627±0.0596*△0.457±0.0400*△1/2MICEEP0.909±0.0231*△0.652±0.0745*△1/4MICEEP1.403±0.0892*1.028±0.0742*△1/8MICEEP1.641±0.0880*△1.394±0.0735*阳性对照NaF1.318±0.1168*1.528±0.0990*阴性对照无1.822±0.0147△1.826±0.0116△
注:与阴性对照组比较,*P<0.05; 与阳性对照组比较,△P<0.05。


组别药物变形链球菌远缘链球菌1MBECEEP0.826±0.07194*△0.615±0.0429*△1/2MBECEEP1.112±0.07422*△0.958±0.0642*△1/4MBECEEP1.596±0.04709*1.237±0.1160*△1/8MBECEEP1.817±0.07488*△1.679±0.0992*阳性对照NaF1.451±0.05676*1.697±0.0920*阴性对照无2.011±0.02481△1.962±0.0645△
注:与阴性对照组比较,*P<0.05; 与阳性对照组比较,△P<0.05。
2.2各组药物对变形链球菌葡萄糖基转移酶的影响差异在游离与生物膜2种状态下,变形链球菌实验组葡萄糖基转移酶活性没有受到影响,差异无统计学意义(P>0.05);阳性对照组变形链球菌活性没有受到影响,差异无统计学意义(P>0.05),见表4。
2.3蜂胶对变形链球菌属ldh表达差异
2.3.1游离生长状态变形链球菌属ldh表达差异在游离生长状态下,变形链球菌、远缘链球菌各实验组和阳性对照组乳酸脱氢酶编码基因ldh表达均明显受到抑制(P<0.05)。变形链球菌阳性对照组乳酸脱氢酶表达量高于1、1/2、1/4、1/8MIC蜂胶组,低于阴性对照组(P<0.05)。远缘链球菌阳性对照组乳酸脱氢酶编码基因ldh表达量与1、1/2、1/4MIC蜂胶组差异有统计学意义(P<0.05),见表5。

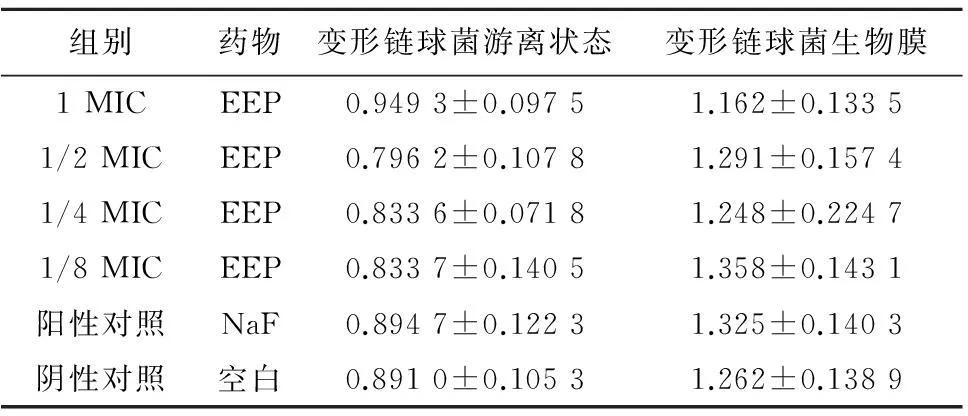
组别药物变形链球菌游离状态变形链球菌生物膜1MICEEP0.9493±0.09751.162±0.13351/2MICEEP0.7962±0.10781.291±0.15741/4MICEEP0.8336±0.07181.248±0.22471/8MICEEP0.8337±0.14051.358±0.1431阳性对照NaF0.8947±0.12231.325±0.1403阴性对照空白0.8910±0.10531.262±0.1389


组别药物变形链球菌远缘链球菌1MICEEP0.136±0.0257*△0.132±0.0436*△1/2MICEEP0.253±0.0702*△0.227±0.1795*△1/4MICEEP0.378±0.0783*△0.186±0.0845*△1/8MICEEP0.470±0.2160*△0.670±0.1838*阳性对照NaF0.667±0.1168*0.369±0.1966*阴性对照无1.000±0.0608△1.000±0.0157△
注:与阴性对照组比较,*P<0.05; 与阳性对照组比较,△P<0.05。
2.3.2生物膜生长状态变形链球菌属ldh基因表达差异在生物膜生长状态下,变形链球菌实验组在1、1/2、1/4MBEC浓度时乳酸脱氢酶编码基因ldh表达明显受到抑制(P<0.05)。远缘链球菌实验组在1、1/2、1/4、1/8MBEC浓度时乳酸脱氢酶编码基因ldh表达明显受到抑制(P<0.05)。变形链球菌、远缘链球菌阳性对照组与阴性对照组相比乳酸脱氢酶编码基因ldh表达差异无统计学意义(P>0.05),见表6。


组别药物变形链球菌远缘链球菌1MBECEEP0.216±0.124*0.304±0.1014*1/2MBECEEP0.360±0.079*0.308±0.0830*1/4MBECEEP0.498±0.198*0.514±0.2113*1/8MBECEEP0.908±0.4410.670±0.1331*阳性对照NaF0.866±0.4830.695±0.6162阴性对照无1.000±0.0391.000±0.0213
注:与阴性对照组比较,*P<0.05
2.4蜂胶对变形链球菌gtfs基因转录的影响
2.4.1各组实验药物对游离生长状态变形链球菌gtfs基因表达差异在游离生长状态下,变形链球菌实验组gtfb、gtfc、gtfd基因表达并没有受到影响。阳性对照组gtfb基因表达增加(P<0.05),见表7。
2.4.2实验药物对生物膜生长状态变形链球菌gtfs基因表达差异 在生物膜生长状态下,变形链球菌实验组gtfb、gtfc、gtfd基因表达并没有受到影响。阳性对照组gtfb基因表达增加(P<0.05),见表8。


组别药物gtfbgtfcgtfd1MICEEP1.202±0.26781.074±0.32961.060±0.24751/2MICEEP0.981±0.22161.008±0.10631.283±0.35721/4MICEEP1.080±0.36591.196±0.48621.186±0.35321/8MICEEP0.876±0.20071.093±0.30240.981±0.3015阳性对照NaF2.695±0.9469*0.982±0.30971.059±0.2846阴性对照无0.999±0.03111.000±0.05801.000±0.0340
注:与阴性对照组比较,*P<0.05

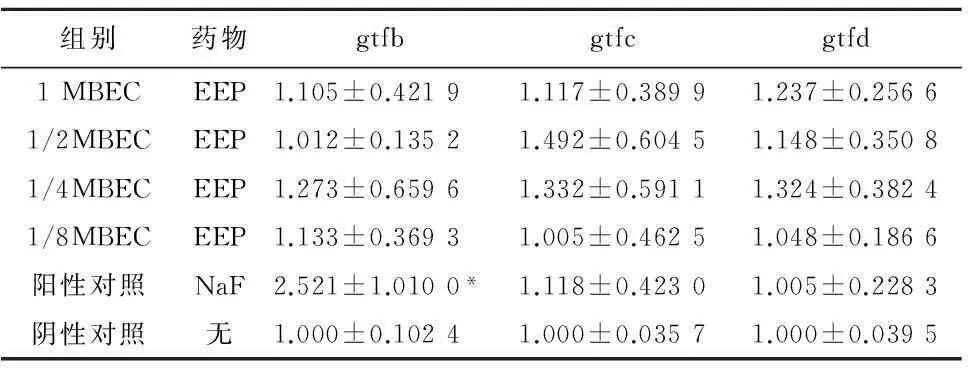
组别药物gtfbgtfcgtfd1MBECEEP1.105±0.42191.117±0.38991.237±0.25661/2MBECEEP1.012±0.13521.492±0.60451.148±0.35081/4MBECEEP1.273±0.65961.332±0.59111.324±0.38241/8MBECEEP1.133±0.36931.005±0.46251.048±0.1866阳性对照NaF2.521±1.0100*1.118±0.42301.005±0.2283阴性对照无1.000±0.10241.000±0.03571.000±0.0395
注:与阴性对照组比较,*P<0.05
3讨论
国内外已有学者发现蜂胶具有防龋活性,研究表明蜂胶提取物对变形链球菌有很强的抑制作用[4,5,10]。然而蜂胶抗微生物的作用机理较复杂,其明确的抗龋机制亦尚不明确。因此本课题组前期针对伊犁黑蜂蜂胶对口腔主要致龋菌的作用进行一系列的体外研究,发现蜂胶对游离和生物膜生长状态变形链球菌属生长、黏附、产糖和产酸等毒力因子有着不同程度的抑制活性。乳酸脱氢酶和葡萄糖基转移酶分别在细菌糖分解代谢和糖合成代谢中起着至关重要的作用。为进一步探究不同生长状态下伊犁黑蜂蜂胶对变形链球菌、远缘链球菌产酸、产糖的影响机制,本研究针对蜂胶对变形链球菌、远缘链球菌产酸、产糖代谢过程中乳酸脱氢酶和葡萄糖转移酶的影响进行实验研究。
3.1伊犁黑蜂蜂胶对变形链球菌、远缘链球菌乳酸脱氢酶活性的影响本研究结果显示,蜂胶乙醇提取物对游离生长状态和生物膜生长状态的变形链球菌、远缘链球菌乳酸脱氢酶活性均有显著的抑制活性,游离生长状态下变形链球菌实验组中 1、1/2 MIC组,远缘链球菌 1、1/2、1/4、1/8 MIC组;生物膜生长状态变形链球菌与远缘链球菌1、1/2MBEC组的抑制程度比NaF组更为明显(P<0.05)。提示黑蜂蜂胶比氟化钠对乳酸脱氢酶作用更为敏感。由此可推断,伊犁黑蜂蜂胶可能通过对变形链球菌属影响乳酸脱氢酶的活性,抑制细菌产酸。
国外学者Duarte等[14]发现,蜂胶提取物通过影响生物膜生长状态变形链球菌耐酸关键酶质子移位膜三磷酸腺苷(F-ATP)酶活性抑制产酸。Jeon等[15]发现,蜂胶提取物通过对游离生长状态变形链球菌细胞膜质子渗透性的作用影响细菌耐酸能力。他们认为蜂胶对变形链球菌产酸的影响是通过抑制细菌耐酸能力进而使细菌内环境酸化,使糖代谢途径中相关酶活性受抑制从而降低细菌产酸能力。这与本研究结果有差异,可能是由蜂胶成分的异质性造成的。而杨清岭等[16]体外实验研究发现,蜂胶对变形链球菌乳酸脱氢酶活性有抑制作用且与药物浓度呈正相关,此与本实验结果一致。Pandit等[17]研究氟化物对变形链球菌生物膜的影响发现,氟离子在10、25、125 ppm浓度时可以抑制变形链球菌生物膜产酸,通过直接影响细胞膜质子通透性和抑制F-ATP酶活性对细菌耐酸产生影响。可见黑蜂蜂胶与氟化钠的防龋机制有所差异。氟化物是目前公认的有效的防龋制剂,但其使用具有明显的局限性,能够使用小剂量、低毒性的天然药物防龋作为替代也是一种不错的选择。在本实验条件下,伊犁黑蜂蜂胶表现出对游离生长状态和生物膜生长状态变形链球菌、远缘链球菌的乳酸脱氢酶活性及编码基因的抑制能力,从而抑制细菌产酸。
3.2伊犁黑蜂蜂胶对变形链球菌葡萄糖基转移酶活性的影响本研究结果显示伊犁黑蜂蜂胶对游离生长状态与生物膜生长状态葡萄糖基转移酶活性的影响没有明显差异,生物膜状态下酶活性高于游离状态。说明伊犁黑蜂蜂胶对GTF酶活性直接抑制作用并不明显。有学者对蜂胶在致龋细菌细胞外多糖合成及其代谢过程中关键酶葡萄糖基转移酶的影响进行了比较深入的研究。彭志庆等[18]研究发现蜂胶对变形链球菌的 GTF酶活性有抑制作用,随着蜂胶浓度升高,变形链球菌GTF酶活性逐渐降低,当浓度达1.56 g/L时抑制作用不再增强。Hayacibara等[19]用给予标准 GTFB与 GTFC使用14C标记的蔗糖作为底物,蜂胶醇提取物作为干预措施与对照组相比较,发现蜂胶乙醇提取物可有效抑制酶活性。上述学者们用不同的实验方法对各个地区的蜂胶进行研究发现蜂胶对变形链球菌的葡萄糖基转移酶有不同程度的抑制活性。然而,也有学者实验研究得到不同的结果,Duarte 等[14]通过研究6型巴西蜂胶对变形链球菌产糖、产酸以及耐酸的影响发现,6型巴西蜂胶对变形链球菌产酸和耐酸有明显的抑制作用,而对细菌产糖毒力因子没有影响,并指出6型巴西蜂胶与其他型蜂胶成分不同,其中没有发现黄酮类物质,主要是由脂酸构成。
目前蜂胶对葡萄糖基转移酶活性的作用仍存在争议。产生这些不同结论的原因可能是蜂胶成分中存在对葡萄糖基转移酶活性有直接影响的活性成分,而蜂胶的活性成分又受到地理、植物源等多种因素的影响,因此蜂胶对变形链球菌葡萄糖基转移酶活性影响,研究必须结合蜂胶成分进行研究,方可发现其中的联系。对于伊犁黑蜂蜂胶活性成分的研究目前还处于起步状态,需要进一步研究。
3.3伊犁黑蜂蜂胶对变形链球菌、远缘链球菌ldh基因转录的影响在游离生长状态下,变形链球菌和远缘链球菌实验组与阳性对照组ldh基因的表达差异亦具有统计学意义。而在生物膜生长状态下,变形链球菌EEP在1、1/2、1/4MBEC浓度下均可抑制ldh基因的表达,而在1/8浓度的EEP与氟化钠对生物膜生长状态细菌ldh表达差异无统计学意义。远缘链球菌生物膜实验组所有浓度的EEP对ldh基因表达有抑制,阳性对照组EEP对ldh基因影响与阴性对照组比较差异无统计学意义。结果提示对于2种状态的变形链球菌、远缘链球菌,EEP的影响较氟化钠显著,并且EEP对游离细菌的ldh表达抑制比较生物膜生长状态更为明显。根据现有数据与实验条件,变形链球菌与远缘链球菌的MIC与MBEC浓度差异,2种细菌间表达差异无法计算。本实验结果提示伊犁黑蜂蜂胶可能是通过对变形链球菌属与变形链球菌属生物膜乳酸脱氢酶ldh基因表达的调节抑制其产酸的。国内外有关蜂胶或其主要活性成分对变形链球菌属ldh基因表达的研究非常少,大多研究只停留在对于酶作用的水平。而本研究通过体外实验发现,蜂胶对变形链球菌、远缘链球菌乳酸脱氢酶编码基因在转录水平就有抑制作用,对乳酸脱氢酶活性也有抑制作用。说明伊犁黑蜂蜂胶是在酶和转录2个水平抑制变形链球菌、远缘链球菌产酸能力。
3.4伊犁黑蜂蜂胶对变形链球菌gtfs基因转录的影响本实验结果显示蜂胶对GTF酶和其编码基因的影响不显著。值得一提的是,NaF对游离和生物膜生长状态下变形链球菌gtfb基因的表达有上调作用。Koo等[20]体外实验研究发现,蜂胶有效成分芹菜素可在短时间内使游离生长状态以及生物膜生长状态的变形链球菌gtfb、gtfc基因表达受到抑制,而使gtfd基因的表达增高;通过对内参照基因以及酶活性的独立实验证明其影响效果不受细菌活性和酶的活性的影响。其研究结果与本实验有差异,造成这种差异的原因可能是本课题组所使用的是蜂胶乙醇提取物,而Koo等[20]所使用的实验药物是经过分离提纯后的纯物质,不会受到蜂胶中其他成分的影响。
伊犁黑蜂蜂胶作为新疆本地生产的具有良好生物学性能的天然药物,具有其独特的生物学特性和多方面的药理活性,伊犁黑蜂蜂胶的毒副作用较氟化物小,具有成为新型防龋药物的重要潜质,且采购经济又方便,因此具有宽广的开发应用前景。口腔的微生物环境是非常复杂的环境,其中多种微生物相互拮抗、相互协作达到动态平衡。蜂胶对多细菌菌斑的影响有待进一步研究。本实验只对产酸与产糖代谢途径中关键酶及编码基因的转录水平进行了评价,而与细菌耐酸、信号传导途径的影响有待更深层次的研究。本实验初步探讨了蜂胶预防与治疗龋病的物质基础和药理作用机制,为开发天然维药防龋制剂提供了理论和实验依据。
参考文献:
[1]Loesche WJ.Role of Streptococcus mutans in human dental decay[J].Microbiological Reviews, 1986,50(4):353-380.
[2]Ten Cate JM. The need for antibacterial approaches to improve caries control[J].Adv Dent Res,2009,21(1):8-12.
[3]Pandit S, Kim JE, Jung KH,et al.Effect of sodium fluoride on the virulence factors and composition of Streptococcus mutans biofilms[J].Arch Microbiol,2011,56(7):643-649.
[4]Possamai MM, Honorio-Franca AC, Reinaque AP, et al.Brazilian propolis: a natural product that improved the fungicidal activity by blood phagocytes[J].Biomed Res Int,2013,5(4):10-18.
[5]于倩, 哈木拉提·吾甫尔, 林静.伊犁黑蜂蜂胶对口腔主要致龋细菌作用的体外实验[J].医学研究生学报,2014,27(12):1269-1272.
[6]Toreti VC, Sato HH, Pastore GM. Recent progress of propolis for its biological and chemical compositions and its botanical origin[J].Evid Based Complement Alternat Med,2013,2013(1):13-66.
[7]Gomez-Caravaca AM, Gomez-Romero M, Arraez-Roman D, et al.Advances in theanalysis of phenolic compounds in products derived from bees[J].J Pharm Biomed Anal,2006,41(4):1220-1234.
[8]Woisky R, Salatino A.Analysis of propolis: some parameters and procedures for chemical quality control[J].J Apicult Res,1998,37(1):99-105.
[9]Cao Y, Wang Y, Yuan Q.Analysis of flavonoids and phenolic acid in propolis by capillary electrophoresis[J].Chromatographia,2004,59(3):135-140.
[10]Castro D, Ishida VF, Negri G, et al. A new type of Brazilian propolis: Prenylated benzophenones in propolis from Amazon and effects against cariogenic bacteria[J].Food Chemistry,2011,125(3):966-972.
[11]Navarro M, Ruiz-Bustos P, Valencia D, et al.Antibacterial activity of Sonoran propolis and some of its constituents against clinically significant Vibrio species[J].Foodborne Pathog Dis,2013,10(2):150-158.
[12]托合尼牙孜木, 艾米尔艾, 热合曼依.新疆产蜂胶总黄酮的提取工艺优化及GC_MS分析[J].食品科学,2011,32(2):56-60.
[13]高振中,降升平.我国不同地区蜂胶乙醇提取物化学成分的分析[J]. 天津科技大学学报,2010,25(3):43-47.
[14]Duarte S, Rosalen PL, Hayacibara MF et al.The influence of a novel propolis on mutans streptococci biofilms and caries development in rats[J].Arch of Oral Biol,2006,51(1):15-22.
[15]Jeon JG, Pandit S, Xiao J, et al. Influence of trans-transfarnesol,a membrane-targeting sesquiterpenoid, on Streptococcus mutans physiology and survival within mixed-species oral biofilms[J].Int J Oral Sci,2011,3(2):98-106.
[16]杨清岭,连爽,赵玥,等.蜂胶与柠檬提取物混合液对变形链球菌作用的体外研究[J].黑龙江医药科学,2014,37(3):54-66.
[17]Pandit S, Kim JE, Jung KH, et al.Effect of sodium fluoride on the virulence factors and composition of Streptococcus mutans biofilms[J]. Arch Oral Biol,2011,56(7):643-649.
[18]彭志庆.国产水溶性蜂胶对主要致龋链球菌及其耐氟菌株致龋性的影响[D].重庆:重庆医科大学:2010.
[19]Hayacibara MF, Koo H, Rosalen PL, et al. In vitro and in vivo efects of isolated fractions of Brazilian propolis on caries development[J]. J Ethnopharmacol, 2005,101(1-3):110-115.
[20]Koo H, Seils J, Abranches J, et al. Influence of apigenin on gtf gene expression in Streptococcus mutans UA159[J].Antimicrob Agents Chemother,2006,50(2):542-546.
(本文编辑杨晨晨)
通信作者:杨晨晨,女,在读博士,研究方向:肿瘤的分子发生机制,E-mail:yccbys@163.com。

