现代显微成像技术综述
张祥翔
摘要:概述了光学宽视场显微镜、共聚焦显微镜、超分辨率显微镜中所应用的现代显微成像技术,对各种传统和先进的显微成像原理进行了总结。光学宽视场显微镜最常用的显微技术有明场成像、暗场成像、相衬成像、偏光成像、微分干涉(DIC)成像、调制对比成像和荧光成像。相衬成像中根据不同的成像结构还有切趾相衬成像。微分干涉除了传统的偏振光照明还有圆偏振光照明(CDIC)和专用于塑料的微分干涉(PlasDIC)。共聚焦显微镜随着计算机技术和制造技术的发展而有了巨大的发展。除了传统的共聚焦荧光显微镜以外,还有连续反斯托克斯拉曼散射(CARS)共聚焦、多光子共聚焦和白光共聚焦。超分辨率显微镜中主要介绍了受激辐射淬灭(STED)技术和紧随基态淬灭显微技术的单分子返回(GSDIM)技术。
关键词:宽视场显微镜; 共聚焦显微镜; 超分辨率; 显微成像技术
中图分类号: O 435 文献标志码: A doi: 10.3969/j.issn.10055630.2015.06.017
Abstract:The imaging technology in modern microscope for widefield microscope, confocal microscope and superresolution microscope is outlined here. The most frequentlyused technology in the widefield microscope is brightfield, darkfield, phase contrast, polarization, DIC, modulation contrast and fluorescence. In phase contrast, there is also apodized phase contrast. In addition, DIC, CDIC and PlasDIC are also presented. Confocal microscope is developed greatly with the development of computer and manufacture technology. Besides conventional confocal system, the principle of coherent antiStokes Raman scattering(CARS) confocal,multiphoto confocal, white confocal are also explained in detail. As for superresolution microscope, the principle of stimulated emission depletion(STED) and ground state depletion microscopy followed by individual molecule return(GSDIM) are clarified.
Keywords:widefield; confocal; superresolution; microscope imaging technology
引 言
显微镜根据成像方式可以分为光学宽视场显微镜、共聚焦显微镜、体视显微镜[1]。光学宽视场显微镜和共聚焦显微镜更多地应用于生命科学研究,对成像的要求更高,而体视显微镜更多应用于工业领域,对数码化和人性化的要求更高[2]。本文主要阐述用于生命科学领域的显微成像技术,光学宽视场显微镜常用的显微技术有明场成像、暗场成像、相衬成像、偏光成像、微分干涉(DIC)成像、调制对比成像和荧光成像,共聚焦显微镜常用的显微技术有荧光、全反射、超分辨、多光子和白光共聚焦成像。
1 光学宽视场显微镜
在光学宽视场显微镜中的各种成像技术中,明场、暗场、偏光和荧光成像是为了使需要观察的标本结构可见,而相衬、微分干涉、调制对比成像是将标本结构中的相位变化显现出来。很多情况下几种成像技术同时使用。
1.1 明场成像和暗场成像
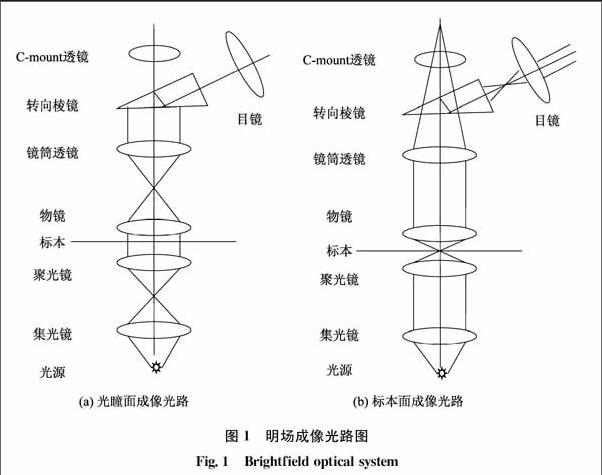
明场成像是最基本的显微成像技术,其他所有的成像技术都是以明场成像为基础的。明场成像光路如图1所示,光源通过集光镜和聚光镜聚焦到标本上,如果是临界照明,灯丝的像直接会聚到标本;如果是科勒照明,灯丝像会聚在聚光镜前焦面,由聚光镜再照射到标本上。透射过标本的光线由物镜收集在物镜后焦面上形成光瞳的像,光瞳的像是相对于空间的成像光线角度的分布,现代显微镜中多用这个位置进行各种对比方式的变化。经过后焦面后,光线进入镜筒透镜,镜筒透镜将相对于空间的角度分布变换为相对于空间的位置分布,即在镜筒透镜的后焦面形成中间像面。现代显微镜中,在镜筒透镜形成中间像面之前,会利用Cmount镜头转接中间像面到摄像头上,从而实现数码成像,便于现代教学和研究。最后中间像面由目镜成像到眼睛的视网膜上,从而看到放大的像。
暗场成像和明场成像只有照明光路有所区别。暗场成像是以超出物镜数值孔径的角度照明,标本由于大角度照明产生衍射光或者散射光,包含在物镜数值孔径内的衍射光或者散射光由物镜收集,按照明场光路投射到眼睛或者摄像头。暗场照明如图2所示,有两种方式:一种是透射式暗场照明,直接用中间不透光的圆环在聚光镜前焦面拦截光线;另一种是反射式暗场照明,暗场反射镜面安装在物镜外壳靠近标本的位置,光线经过暗场反射镜面以超出物镜数值孔径的角度入射在标本上,标本发出的衍射或者杂散光由物镜收集后成像。反射式暗场照明镜面有的是球面,有的是非球面,有的在照明光路中加上微透镜或者散射片,都是为了实现大面积均匀照明。
1.2 相衬成像
相衬成像光路如图3所示。相衬成像是在物镜后焦面或者后焦面的共轭位置,也就是光线角度相对于空间分布的位置(光瞳位置),选取某一环带的光线,将通过这一环带0级光线强度降低到和1级衍射光相同,再将0级光线的相位改变180°,和1级衍射光的相位相反。这样当光线在光瞳面进行相位和强度变换后,镜筒透镜将其按照空间位置合成,在中间像面就会凸显出由1级衍射光所表征的结构特征,同时由于0级光变弱,背景将比较暗。
不同级次的衍射光在经过标本(类似光栅的作用)后分开,0级衍射光经过物镜中的相衬环后强度和相位发生了变化,物镜相衬环的宽度小于某种特征结构产生的衍射角对应的宽度,这样该0级光对应的1级衍射光可以保持强度和相位不变。介于这个角度之间的特征结构,1级衍射光会有部分产生强度和相位的变化,在和0级衍射光合成的时候就会产生光晕,而且角度越小,光晕的影响越大,这是相衬成像的缺点。一般会根据经验找到一个合适的相衬环宽度,光晕和成像细节平衡得比较好。
正是由于相衬成像的这种特点,只有某种结构的相位变化可以通过相衬成像反映出来。一般是通过相衬成像较易反映细胞内部结构,但不易反映细胞的边界。其他结构,特别是以上提到的小角度的结构,都或多或少的有一些光晕产生。
Nikon公司采用了切趾相衬成像的方法,将小角度的光线透过率进一步降低,小角度的光线对应于大尺寸的结构,也就是非精细结构的强度降低,同时大角度的光线对应于小尺寸即精细结构更容易显现出来。
1.3 偏光成像
偏光成像顾名思义就是用偏振光进行成像。偏光成像分为正交偏振和锥光偏振两种,光路如图4所示。正交偏振是指经过起偏器的线偏振光经过聚光镜、标本、物镜后,标本的偏振特性会使原来的线偏振光的振动方向发生变化,只有垂直于原来线偏振光振动方向的偏振光可以通过后面的验偏器,从而被目镜接收。正交偏振是直接用目镜观察的偏振成像方式。另外一种锥光偏振是指用勃氏镜和目镜直接观察物镜后焦面的偏振光成像,其余和正交偏光相同。由于观察的是物镜后焦面的成像情况,相当于观察的是标本面上光线的角度随空间变化的情况,所以称之为锥光偏振。锥光偏振一般配合大数值孔径的物镜使用。
偏光成像在生命科学领域的应用较少,主要用于地质材料科学研究中。
1.4 微分干涉成像
微分干涉也是将标本的相位差转化为振幅变化后进行成像,这一点和相衬成像相同。但是微分干涉只对0级光进行调制,而相衬成像对0级光和1级光进行调制。
图5为微分干涉成像光路图。在明场成像的基础上,聚光镜前焦面上放置起偏器和渥拉斯顿棱镜。线偏振光被分为寻常光o光和非寻常光e光,它们的振动方向成90°。o光和e光在标本上通过聚光镜会聚,标本的双折射性能或者相位偏差会对o光和e光的相对振动方向产生影响,也就是o光和e光不再是相互90°的振动方向,或者o光或者e光有了微小的相位差。标本的相位信息带入光路中,再通过第二块渥拉斯顿棱镜,使o光和e光具有相同的振动方向,这样带有相位差的o光或者e光就会进行干涉,相位的变化则转换为振幅的变化。但是有一些光由于振动方向的变化在经过第二块渥拉斯顿棱镜后没有干涉,变成杂散光,于是就需要验偏器选择进行干涉,而且垂直于入射光偏振方向的光进入镜筒透镜和目镜。实际应用中渥拉斯顿棱镜都换为诺玛斯基棱镜,可以保证合适的工作距离。
由于o光和e光是渥拉斯顿棱镜分出的两束不同位置的光,也就是o光和e光都会分别成像,它们由第二块渥拉斯顿棱镜合成的时候,由于棱镜的位移作用,所成的像会在X和Y向有所位移,产生浮雕的效果。故如果调解渥拉斯顿棱镜的相对位置,则可调解浮雕效果。
微分干涉先是微分然后是干涉,先把相位变成了相位的变化(即相位差),再将相位差通过干涉变成振幅变化,而相衬成像中直接把反应结构的相位通过降低背景光的方法显现出来(本质上也是干涉)。因此微分干涉容易将细胞的边界显现出来,因为边界上对o光和e光的相位变化较大,而内部的连续介质对o光和e光的相位变化就较小。但是相衬成像直接将相位显现出来,所以通常是内部的精细结构具有更大的相位角,更容易通过相衬方法显现出来。
微分干涉对相位差的依赖既是其优点,也是其缺点。特别是在线偏振光情况下,只有和偏振方向相同的相位差才能显现。Zeiss采用圆偏振光(CDIC)[3]后,各个方向的相位差都有所显现,较好地平衡微分干涉和偏振。
普通微分干涉还需要特殊的物镜,只能在很小的焦深内实现较好的微分干涉的效果,并且只适用于培养皿为塑料的标本。这些都对微分干涉的应用产生了限制。Zeiss在专利DE 10219804和文献[2]中提供了一种PlasDIC的微分干涉方式[4],而且已经成功商用。只需要一个偏振片和渥拉斯顿棱镜就可以实现DIC效果。而且只需要普通物镜,培养皿为塑料的标本也适用。但是在聚光镜前必须使用狭缝,物镜数值孔径也不能过大,因此仅小于40X物镜可用。仅有的一对渥拉斯顿棱镜和验偏器放在物镜和镜筒透镜之间,非偏振光只有在经过物镜和该渥拉斯顿棱镜之后才变成偏振光并分为o光和e光,由于是平行于渥拉斯顿棱镜的狭缝照明产生的光,所以这里的o光和e光也是相差90的振动方向。同时由于o光和e光已经经过了标本,出现了相位差,所以在验偏器使o光和e光在同一振动方向时,就发生了干涉,产生了相对于相位变化的振幅变化。
1.5 调制对比成像
调制对比光路见图6,调制对比成像也是在物镜后焦面或者后焦面的共轭面上,对倾斜入射的狭缝光,使其+1级衍射光的强度大于背景光,-1级衍射光的强度小于背景光,这样就形成浮雕效果。调制对比成像也可以配合起偏器和验偏器,通过旋转起偏器来调解浮雕效果。调制对比成像适用于各向同性和各向非同性的标本,而微分干涉仅适用于各向同性的标本。
调制对比和相衬成像类似都是利用的1级或者-1级光进行调整,相对于DIC利用0级光的能量降低很多,因此调制对比成像的效果不如DIC,但是由于其对物镜的要求低、不需要复杂的棱镜、适用范围广,还是受到了广泛的欢迎。
1.6 荧光成像
荧光成像是在落射光照明下的成像技术。光源通常为汞灯或者LED。荧光成像很多情况下标本必须用多种荧光染色剂进行染色(也有自发荧光物质,但是自发荧光能量较弱),不同的荧光染色剂会附着在细胞中需要观察的不同结构上。不同的荧光染色剂在不同波长的光的激发下会产生不同波长的荧光,这样被附着的各种细胞结构就会被观察到。通常会用多种波长的光进行激发,从而得到多种波长的荧光图像,然后再进行图像综合,这样就可以得到多种颜色的标本图像。荧光成像中最重要的元件就是激发滤光片和截止滤光片。
图7(a)为普通荧光成像。荧光光源汞灯或者LED通过落射照明光路由分光棱镜入射到物镜中,并激发标本产生荧光,返回到物镜中,通过镜筒透镜成像。入射到物镜的光会被激发滤光片滤出一定波长的激发光,被激发光激发的荧光染色剂会产生不同波段的荧光,由截止滤光片将其他波段的光截止,最终激发出的荧光到达镜筒透镜。由于激发光和被激发荧光之间的波长差,使得截止滤光片可以选出被激发荧光,同时截止激发光。
荧光成像由于被激发的荧光来自不同的焦面位置,特别是对厚标本,使得真正焦面上图像的对比度会有所下降。全反射荧光技术利用全反射光透过介质的倏逝波照明,倏逝波只渗透进标本100 nm,可以有效地防止不在焦面的被激发荧光对图像对比度的影响。全反射荧光如图7(b)所示,其技术要求物镜数值孔径在1.45以上,而且只能对粘附性标本成像,否则倏逝波无法照射。
荧光成像在共聚焦显微镜和超分辨率显微镜中也得到广泛的应用。
2 共聚焦显微镜[5]
共聚焦显微镜是为了减少在焦点之外的光晕,仅仅对衍射极限尺寸的点照明进而成像。共聚焦显微原理早在20世纪50年代早期就发明出来了,但是由于激光技术、计算机技术、数码成像算法的制约,直到1987年才出现了第一台商用共聚焦显微镜。到20世纪90年代以后,大容量存储技术、显示增强技术、计算机处理技术的发展给共聚焦显微镜带来更广阔的应用。
2.1 荧光共聚焦成像
共聚焦主要应用在荧光共聚焦成像上。
所谓共聚焦就是发射光源点、焦面上物点和探测器成像像点共同被聚焦。共聚焦显微镜光路见图8。连续激光光源通过小孔光阑,由分光镜会聚样本上,分光镜在X和Y向移动扫描标本上的点,被照射的标本激发出荧光会聚到探测器上。在物镜成像焦面的上下同样会有很多激发荧光产生,这些荧光和探测器上的成像点不共聚焦,这部分不共聚焦的荧光只有一小部分可以通过探测器前小孔光阑,所以大部分不共聚焦的荧光没有被成像。传统的荧光照明中,整个标本都被照明,这样焦面上下产生的荧光就会被探测到,降低了焦面图像的对比度。
共聚焦显微镜中的激光光源经过扩束后,必须准确地照射到物镜的后焦面,这是共聚焦显微镜最严格的要求之一,目的是为了保证照明的均匀和远心。探测器前的小孔光阑作为空间滤波器,其位置必须和物镜焦面的位置完美共轭,这样可以保证焦面的激发荧光被探测器准确接收。小孔光阑有多种尺寸可选,是为了适应不同数值孔径的物镜衍射极限的要求。
共聚焦显微镜的分光镜扫描系统是其关键而复杂的组件之一。其扫描速度和精度直接影响共聚焦成像的效率和像质。分光镜扫描系统不仅起到转折光线的作用,而且需要使聚焦点在X和Y向进行扫描,并且在扫描过程中物镜的光瞳必须准确被照明。扫描标本的原理是在标本的后焦面或者后焦面的共轭面上转动反光镜的角度实现成像点在标本上的二维平移。后焦面上角度的变化对应于成像面上位移的变化。现在商用的共聚焦显微镜中至少有三种扫描装置如图9所示。Olympus采用的是中继透镜加两个扫描镜的方式,Zeiss采用的是两个紧挨的扫描镜旋转的方式,Leica采用的是一个扫描镜二维旋转的方式。以上为串行扫描,速度较慢,有一种采用Nipkow盘配合微透镜的并行扫描方式,在圆盘上刻有很多小孔,可以同时扫描多个成像点,速度大幅提高,但是能量损失较大,商用受限。
共聚焦显微镜是不能像普通光学宽视场显微镜一样从目镜观察标本。其通过对多点扫描所得到的图像进行重构,然后利用计算机完成图像显现。所以要求很大的图像存储空间和复杂的计算机图像处理技术。
2.2 白光共聚焦成像
普通的荧光共聚焦成像需要用到3~5种荧光染色剂来同时探测。不同的荧光染色剂对激发光和发射光都有不同的要求,也就是要有不同光谱的光源。普通显微镜中采用变换滤光片的方法得到不同波段的光源,但是滤光片的机械式转换速度较慢,还可能带来像面偏移,而且滤光片受到潮湿、高温、高能量照射的环境下,还可能改变滤出的波长。白光共聚焦技术就是是利用声光器件的可调光谱技术,波长和强度都可调,几乎可以克服普通滤光片的所有缺点。
白光共聚焦技术中的关键器件之一是切换不同光谱的声光器件,声光器件是一种特殊的双折射晶体,通过对加载在晶体上的声音频率的控制,可以改变晶体的衍射性能,从而实现快速的变换波长。
显微镜中用到的声光器件是在二氧化碲或者石英晶体上粘接一块压电传感器。当无线电频率施加在压电传感器上时,压电传感器产生高频声波,该高频声波在二氧化碲或石英晶体中会引起材料折射率的周期分布。改变压电传感器加在晶体上的频率可以改变折射率变化的周期分布。根据声光晶体的相位匹配条件,出射光的波长由下式决定
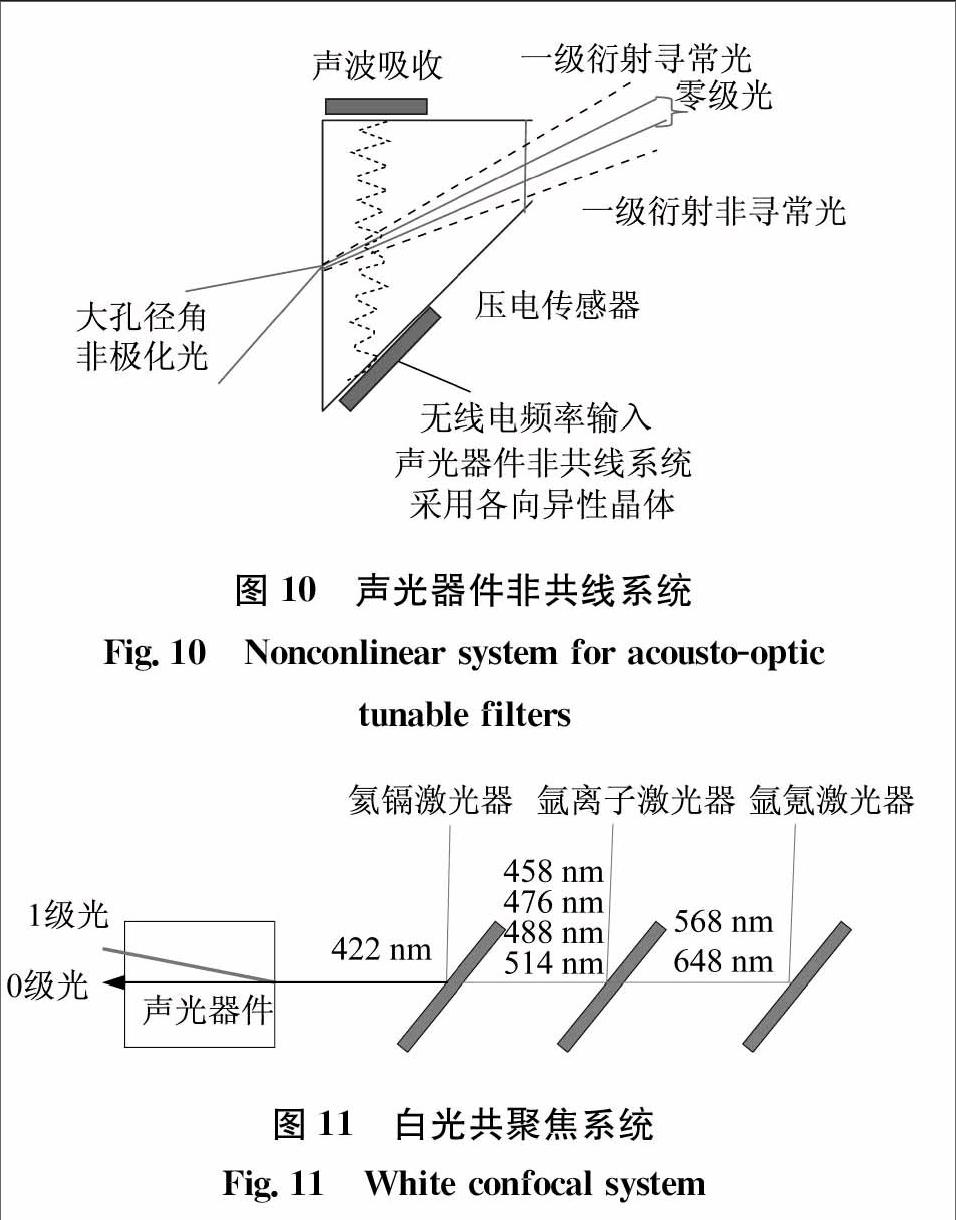
现代显微镜中的声光器件是非共线系统,并且是各项异性的晶体,具体如图10所示。非共线系统相对于共线系统可以使非极化光情况下入射光和出射的1级衍射光分开一定的角度,这样就不需要起偏器。而各项异性晶体相对于各向同性晶体,在入射光孔径较大时仍可以保持较窄的光谱带宽。一定带宽的照明是荧光激发的必要条件之一,所以用各向同性晶体就需要准直光,而用各向异性晶体则不需要。
声光器件在白光共聚焦系统中的应用如图11所示。三种激光光源通过分色片耦合进入声光滤光器。氦镉激光器,氩离子激光器和氩氪激光器通过分色片将422 nm、458 nm、476 nm、488 nm、514 nm、568 nm和648 nm共同入射进声光器件,声光器件通过调节无线电频率调节输出光的波长。声光器件输出的0级光被光陷阱吸收,而1级衍射光由光纤导出照亮样本。
2.3 多光子共聚焦成像[6]
普通共聚焦显微镜中,由于标本受到连续激光直接照射,细胞结构可能受损,特别是很多需要紫外光激发的荧光,对标本的损伤更大。多光子共聚焦技术通过用长波长光子激发标本,而长波长光子的能量比短波长光子低,这样可以减少对标本的损伤。
将共聚焦显微镜中的普通连续激光光源换成长波长的脉冲光源,比如用700 nm的脉冲光源替代350 nm连续激光光源,这样标本需要吸收两个光子才能达到同等350 nm光源所产生的能量,也就是在标本中700 nm光子的能量密度大。而在连续光源系统中,激光激发的几率和光子密度成线性关系;在两个光子的系统中,荧光激发的几率和光子密度成平方关系,也就是说在标本的焦面以外,两个光子的系统比连续光源的系统,光子密度下降的更快。这样两个光子的系统对焦面以外的荧光激发所带来的杂光有更好的抑制作用,得到图像的对比度更好。
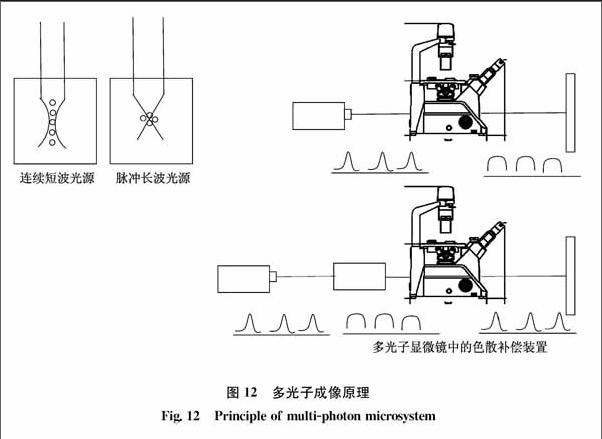
多光子共聚焦显微镜还要配备一个色散补偿器,如图12所示,这是因为光学系统中的光学元件(如衰减片、棱镜、透镜等)对光波有色散作用。一定频率的脉冲光源进入光学系统后会被展宽,能量降低,荧光激发效果变差,这个色散补偿器通过对光学元件色散的补偿使得最终入射到标本上的激光脉冲和光源处的尽量一致。
色散补偿器[7]可以用镀膜反射镜套件来实现。当激光脉冲由不同波长组成时,在其通过光学系统的玻璃器件时,这些介质的折射率的非线性波长相关性,引起了脉冲展宽,对于典型的光学玻璃,波长越短,折射率越高,导致短波比长波的传播速度慢。通过优化反射镜套件的镀膜,可以使长波比短波的群速度延迟的更多,从而使长波和短波具有相同的速度。光波在经过光学膜系反射后的群延迟色散为
式中:φr为反射相位;ω为光波频率。反射相位和膜层厚度、折射率和光束入射角相关,因此通过优化膜系,选择合适的膜层厚度、折射率和光束入射角,就可以得到需要的补偿色散。
当然色散补偿器还可以用光栅或者棱镜实现,但是棱镜补偿色散会引入高阶色散,光栅补偿色散会引起较大损耗,结构不能做的很紧凑。
2.4 CARS共聚焦成像[8]
不管是荧光共聚焦还是多光子共聚焦都需要对标本进行荧光染色或者标记,这都会对标本产生影响。而连续反斯托克斯拉曼散射(CARS)共聚焦成像技术,通过放大标本的拉曼散射光谱并使其成像,不需要进行荧光染色或者标记,对标本有较好的保护。
CARS共聚焦成像和普通共聚焦成像的区别主要是激光光源。CARS共聚焦成像原理见图13,使用一束近红外连续激光和一束斯托克斯激光同时照射标本,受到近红外激光激发的分子跃迁到第一虚拟激发态上,然后立即返回到斯托克斯激光所代表的低能量振动能级上。调节近红外连续激光的波长,可以得到不同的低能量振动能级,但是都比斯托克斯振动能级能量高。这些低能量的振动能级带有标本化学信息,为了能对这些不同的低能量振动能级分子成像,将标本用取样光束照明(取样光束可以和用于激发的近红外连续激光相同),那些在低能量振动能级上的分子又会跃迁到新的虚拟激发态上,由于连续照射低能量振动态能级已满,新跃迁的分子直接返回基态,释放能量发射光子,由于该光子的能量较激发用的近红外连续激光高,所以发出的光谱会往短波移动,这就是反斯托克斯光谱。由于连续激发,CARS信号比传统拉曼散射信号强10万倍,足以成像。
3 超分辨显微成像
以上所有的显微成像方法都受到衍射极限的限制。但是超分辨显微成像从分子级别上改变成像原理,突破了衍射极限。下面介绍两种超分辨显微成像,即受激辐射淬灭(STED)和紧随基态淬灭显微技术的单分子返回(GSDIM)。
3.1 STED[9]
STED成像原理见图14。标本受到第一束激光激发产生荧光,形成具有衍射极限的圆斑,这个位置同时被第二束发散角为圆环的激光激发,第二束激光正好可以激发同一照射位置所形成光斑的非中心区域,产生不能够被探测器收集的光波,而光斑的中心区域由于非中心区域的侵占,直径可以变得无限小,这样就突破了瑞利衍射极限。
3.2 GSDIM[10]
瑞利衍射极限的物理解释为:电子从激发态到基态的跃迁大约为纳秒的量级,而探测器的响应时间一般为毫秒量级,所以所有不同时间发出的荧光都会被探测器接收并显示,而且不同时间发出的荧光的位置会略有不同,这就造成了成像斑点的展宽,也就是衍射极限的由来。也就是说如果探测器能够记录某一时间发射的荧光,而不是所有不同时间的,那么光斑就会很窄,衍射极限就会被突破。
GSDIM成像原理见图15。通常情况下,激光能量越大,发射的荧光也应该越大,但是达到一定极限后,荧光的能量反而减少。这是因为荧光能量和激发光源的能量成线性变化时,电子是在第1激发态和基态之间跃迁。但是如果三重态上反转自旋的电子足够多,导致第1激发态和基态上几乎没有电子,荧光能量就会随着激发能量增大而减少。如果激发能量进一步增大,基态上仅有的几个电子在吸收激发光后会在基态和第1激发态上跃迁几千次,这样就会产生很高能量的受激荧光,即光子爆发。光子爆发就是某一时间发射的荧光的增强,其他不同时间的应该发出的荧光进入了三重态不在发光,也就是说由该增强的荧光形成的光斑突破了衍射极限。
为了增大从三重态上跃迁到基态的电子数目,从而加快光子爆发的时间,还可以用第二束激光(405 nm)照射标本。在GSDIM技术中,强激发光源被反复开关,这样产生三重态发出增加荧光的位置就是随机的,通过记录这些光点的位置,就可以重构标本的GSDIM图像。
如果在GSDIM光路中加入柱面镜[11],就可以形成三维图像。柱面镜可以根据三维图像中的成像位置控制成像光点的PSF,然后通过计算机重建出模拟的三维图像。
GSDIM既可以在共聚焦显微镜中使用也可以在宽视场显微镜中使用。
4 总 结
现代显微镜中以宽视场光学显微镜明场成像技术为基础,衍生出很多对比度增强基础(比如相衬、DIC、调制对比、暗场、偏光),而共聚焦技术将焦面上的物点准确成像,本质上也是一种对比度增加技术。这些技术都受到了衍射极限的限制。超分辨率技术从分子层面突破了衍射极限,通过激发光来调整荧光物质的发光特性,从而缩小了发光点的发光面积。
参考文献:
[1]王莉,蒋洪,孙丽丽.显微镜的发展综述[J].科技信息,2009(11):117118,133.
[2]袁望.面向体式显微镜的立体图像处理方法[D].宁波:宁波大学,2012.
[3]DANZ R,GRETSCHER P.CDIC:a new microscopy method for rational study of phase structures in incident light arrangement[J].Thin Solid Films,2004,462/463:257262.
[4]DANZ R,VOGELGSANG A,KTHNER R,et al.PlasDICeine nützliche modifikation des differentiellen interferenzkontrastes nach Smith/Nomarski in DurchlichtAnordnung[J].Photonik,2004(1):4246.
[5]WEBB R H.Confocal optical microscopy[J].Reports on Progress in Physics,1996,59(3):427471.
[6]ZIPFEL W R,WILLIAMS R M,WEBB W W.Nonlinear magic:multiphoton microscopy in the biosciences[J].Nature Biotechnology,2003,21(11):13691377.
[7]罗震岳.光学色散补偿薄膜的研究[D].杭州:浙江大学,2010.
[8]DOWNES A,MOURAS R,ELFICK A.A versatile CARS microscope for biological imaging[J].Journal of Raman Spectroscopy,2009,40(7):757762.
[9]PUNGE A,RIZZOLI S O,JAHN R,et al.3D reconstruction of highresolution STED microscope images[J].Microscopy Research and Technique,2008,71(9):644650.
[10]DYBA M,SIMONUTTI G A,FLLING J.Recent developments in GSDIM microscopy[J].SPIE,2012,8228:82280R.
[11]ZHANG X W,HUANG B,BAIES W M.Subdfiffraction limit image resolution in three dimensions:US,US 20110002530A1[P].20081209.
(编辑:程爱婕)

