HPLC法测定药材贯叶金丝桃中金丝桃苷和槲皮素的含量
HPLC法测定药材贯叶金丝桃中金丝桃苷和槲皮素的含量
田红林1,成杰2,轩辕欢1*
(1.新疆医科大学附属中医医院药学部,乌鲁木齐830004;2.武警新疆总队医院药局,乌鲁木齐830091)
摘要:目的建立测定药材贯叶金丝桃中槲皮素和金丝桃苷含量的方法。方法采用高效液相色谱法(HPLC)。色谱柱:Hypersil CN(150 mm×4.6 mm,5 μm);流动相:甲醇-4 mL·L-1磷酸(30/70),流速1.0 mL·min-1;检测波长(241,360 nm);柱温30 ℃;进样量20 μL。结果槲皮素和金丝桃苷浓度分别在0.02~10和0.03~8 μg·mL-1质量范围内与峰面积积分分值呈良好线性关系。加样回收率分别为98.0%和98.1%。结论该方法专属性强,灵敏度高,重复性好,可作为该药材测定槲皮素和金丝桃苷质量控制的方法。
关键词:贯叶金丝桃;槲皮素;金丝桃苷
doi:10.3969/j.issn.1004-2407.2015.06.009
中图分类号:R282文献标志码:A
作者简介:田红林,男,副主任中药师
收稿日期:(2015-03-10)
Content determination of hyperoside and quercetin inHypericumperforatumby HPLC
TIAN Honglin1,CHENG Jie2,XUANYUAN Huan1*(1.Department of Pharmacy,the Sixth Hospital Affiliated to Xinjiang Medical University,Urumqi 830004,China;2.Armed Police Xinjiang Hospital Pharmacy,Urumqi 830009,China)
Abstract:ObjectiveTo establish a method for the determination of hyperoside,quercetin in Hypericum perforatum by HPLC. MethodsThe chromatographic conditions were as follows:Hypersil CN (150 mm×4.6 mm,5 μm) column;a mobile phase of methanol -4 mL·L-1 phosphate (30/70),a flow rate of 1 mL·L-1;the detection wavelength 241,360 nm;the column temperature 30 ℃;the sample size 20 μL. ResultsHyperin and quercetin, with in the concentration of 0.02-10 and 0.03-8 μg·mL-1respectively showed a good linear relationship. Recoveries were 98.0% and 98.1% respectively. ConclusionThe method has high specificity,sensitivity,and good reproducibility,and can be used as a method for quercetin and hyperoside determination.
Key words:Hypericumperforatum;quercetin;hyperin
*通信作者:轩辕欢,男,助理中药师
贯叶金丝桃HypericumperforatumL.又名贯叶连翘,为藤黄科Guttiferae金丝桃属HypericumLinn多年生草本植物[1],其味苦、辛、性寒,具有疏肝解郁、清热利湿、消肿通乳之功效[2-4],主治湿寒性或黏液质性关节痛及湿寒创伤久而不愈等[5-6]。现代研究表明,其主要成分有黄酮类、酚类、挥发油等,贯叶金丝桃中的金丝桃素在体内具有抗抑郁、抗病毒、治疗创伤等多种作用[7]。本研究针对贯叶金丝桃采用高效液相色谱法(HPLC)测定金丝桃苷、槲皮素的含量,为贯叶金丝桃药材的质量控制和安全有效提供理论依据。
1仪器与试药
1.1仪器高效液相色谱仪(包括LC-15C泵,SPD-10A检测器)(Shimadzu,日本);岛津高效液相色谱LC工作站;色谱柱:Hypersil CN(50 mm×4.6 mm,5 μm)(大连依利特分析仪器有限公司);XW-80A型漩涡混合器;DSHZ-300型恒温水浴振荡器(江苏实验设备厂)。
1.2试药贯叶金丝桃(购自新疆维吾尔自治区乌鲁木齐维吾尔药市场),经新疆医科大学第六附属医院魏敏助理研究员鉴定为贯叶金丝桃HypericumperforatumL.的干燥地上部分;槲皮素对照品(质量分数>98%,中国食品药品检验所提供,批号20091020);金丝桃苷对照品(质量分数>98%);甲醇(色谱纯);正辛醇、磷酸、二甲亚砜(分析纯,国药集团化学试剂有限公司)。
2方法与结果
2.1色谱条件色谱柱:Hypersil CN(150 mm×4.6 mm,5 μm);流动相:甲醇-4 mL·L-1磷酸(30/70);流速1.0 mL·min-1;检测波长:241 和360 nm;柱温:30 ℃;进样量:20 μL。见图1。

图1HPLC图
A.空白甲醇;B.槲皮素和金丝桃苷混合标准溶液;C.供试品溶液;1.槲皮素;2.金丝桃苷
Fig.1HPLC chromatograms
A.methanol;B.quercetin,hyperin mixed standard solution;C.test sample;1.quercetin;2.hyperin
2.2对照品溶液的制备精密称取金丝桃苷、槲皮素对照品适量,分别加甲醇制成 40.1和44.8 mg·L-1的溶液,摇匀,即得。
2.3供试品溶液的制备取贯叶金丝桃药材适量粉碎,过三号筛,粉末精密称定0.40 g,置于50 mL量瓶中,加甲醇适量,超声处理(功率500 W,频率400 kHz)30 min,用甲醇定容至刻度,摇匀,滤液经0.45 mm微孔滤膜滤过,取续滤液,即得。
2.4阴性液制备及干扰实验按处方制备不含贯叶金丝桃的阴性样品,按2.3项下方法制备贯叶金丝桃空白溶液,依法测定,结果无干扰。
2.5系统适用性实验精密称取槲皮素和金丝桃苷对照品1 mg,用DMSO配制成质量浓度为1 mg·L-1的标准储备液。标准储备液用甲醇配制成质量浓度为0.02,0.10,0.20,1.00,5.00,20.00和50.00 μg·L-1的标准稀释液,置于4 ℃下保存,于上述色谱条件下测定,重复3次。色谱峰面积(Y)与质量浓度(X)呈良好的线性关系,所得线性方程即为标准方程。槲皮素线性方程为:Y=55.078X+2 726.9,r=0.999 9;金丝桃苷线性方程为:Y=39.077X+2 335.5,r=0.999 9。结果表明:槲皮素和金丝桃苷在0.02~10.0和0.03~8.00 μg·mL-1质量浓度范围内,与峰面积积分分值呈良好线性关系。
2.6精密度实验精密吸取供试品溶液连续进样5次,进样体积20 μL,在上述色谱条件下,测定色谱峰面积,实验结果表明,日内及日间精密度均小于2%,精密度较好。
2.7稳定性实验精密吸取同一供试品溶液20 μL,每隔2 h进样1次(4次),在上述色谱条件下,测定槲皮素和金丝桃苷的峰面积,结果供试品在8 h内的RSD分别为1.42%和1.37%,结果稳定。
2.8重复性实验按2.3项下方法制备同一批供试品6份溶液,按上述色谱条件测定槲皮素和金丝桃苷含量,RSD分别为0.32%和0.27%,结果表明重复性良好。
2.9回收率实验按2.3项下方法制备本品,取0.2 g,精密称定6份,置于50 mL量瓶中,第1份作为空白,其余6份精密加入槲皮素和金丝桃苷对照品,在2.1项色谱条件下,进行含量测定,计算回收率,结果见表1。
表1槲皮素和金丝桃苷加样回收率测定
Tab.1 Recovery of quercetin,hyperin
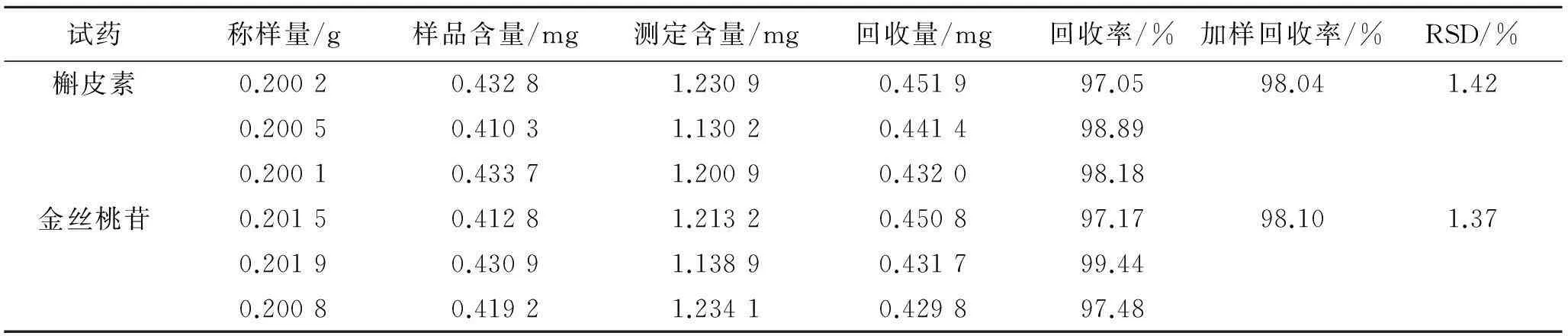
试药称样量/g样品含量/mg测定含量/mg回收量/mg回收率/%加样回收率/%RSD/%槲皮素0.20020.43281.23090.451997.0598.041.420.20050.41031.13020.441498.890.20010.43371.20090.432098.18金丝桃苷0.20150.41281.21320.450897.1798.101.370.20190.43091.13890.431799.440.20080.41921.23410.429897.48
2.10 样品测定取3批样品,按2.3项下方法制备,分别精密吸取供试品溶液20 μL,在2.1项色谱条件下进行测定,记录峰面积,计算样品中槲皮素和金丝桃苷的含量,结果3批贯叶金丝桃中槲皮素含量为7.15,6.79和7.55 mg·g-1,金丝桃苷含量为5.14,5.48和5.01 mg·g-1。
3讨论
本研究中考察了甲醇、无水乙醇超声法提取供试品[8-9],结果发现,无水乙醇提取的供试品分离色谱峰较少,其中只含有槲皮素成分,且杂质峰较多,难以达到实验一测评价2种成分含量的效果。甲醇提取色谱峰分离得较好、提取效率较高。故选用甲醇为溶剂,超声提取法提取。
HPLC测定金丝桃苷测定方法多采用《中国药典》2010年版一部贯叶金丝桃药材项下含量测定方法[2],采用十八烷基硅烷键合硅胶色谱柱,流动相(乙腈-1 mL·L-1磷酸(16∶84)),本研究经过多次实验、重复比较,结果发现,同时测定槲皮素和金丝桃苷的分离效果较差,因此本实验采用甲醇-4 mL·L-1磷酸[8],槲皮素和金丝桃苷色谱峰分离度良好,基线平稳。该方法测定贯叶金丝桃药材中槲皮素和金丝桃苷含量,具有专属性强、灵敏度高、重复性好等优点。本研究组针对贯叶金丝桃专属性成分进一步研究,将提供详实的实验数据和理论依据。
参考文献:
[1]李艳,曹学丽,付鹏,等.贯叶金丝桃活性成分及其分离纯化与检测方法的研究进展[J].药学进展,2007,32(1):15-18.
[2]国家药典委员会.中国药典[S].一部. 北京:中国医药科技出版社,2010:2-15.
[3]吕彩霞,张群.贯叶金丝桃胶囊的制备及临床应用[J].西北药学杂志,2006,21(3):19-24.
[4]张爱均,李峰.益心酮泡腾片中金丝桃苷的含量测定[J].江西中医药,2008,39(1):51-53.
[5]樊敏伟,马能溢,王冰,等.高效液相色谱法测定贯叶金丝桃提取物缓释胶囊中金丝桃苷的含量[J].中国实验方剂学杂志,2007,13(11):9-10.
[6]谭道鹏,桂新,王峥涛.HPLC测定千柏鼻炎片中对羟基桂皮酸和金丝桃苷的含量[J].中国现代应用药学,2010,27(6):532-535.
[7]王峰,高天兵,田金改. RP-HPLC法测定贯叶连翘片剂中有效成分金丝桃素和金丝桃苷的含量[J].药物分析杂志,2000,20 (1):10-14.
[8]李敏芳,李慧,王学美.金丝桃苷药理研究进展[J].中国中医药信息杂志, 2008,15(4):102-104.
[9]曾建国,张胜.HPLC法分析贯叶连翘不同部位中金丝桃素的含量[J].西北药学杂志,2000,15(4):56-59.

