樟脑磺酸催化的2,2-二(1H-吲哚-3-基)-2H-苊-1-酮类化合物的合成研究
宋庆宝,党海波,沈田华,林 燕
(浙江工业大学 化学工程学院,浙江 杭州 310014)
樟脑磺酸催化的2,2-二(1H-吲哚-3-基)-2H-苊-1-酮类化合物的合成研究
宋庆宝,党海波,沈田华,林燕
(浙江工业大学 化学工程学院,浙江 杭州 310014)
摘要:双吲哚甲烷类化合物(BIAs)是一系列具有很好的生物活性的代谢产物.采用苊醌和取代吲哚为原料,合成2,2-二(1H-吲哚-3-基)-2H-苊-1-酮类化合物,对反应条件进行探索研究,得到了合成该类化合物的一种简单有效的方法.以10%的樟脑磺酸(CSA)为催化剂,无水乙醇为溶剂,在回流条件下反应30 min左右,产物收率达到93%以上.产物均经过1H NMR,13C NMR, IR, MS和元素分析表征确认.
关键词:2,2-二(1H-吲哚-3-基)-2H-苊-1-酮;萘醌;吲哚;樟脑磺酸催化剂
在药物学,医学和生物化学领域,吲哚衍生物是一系列重要的杂环化合物[1-2].其中,从许多陆地或海洋天然产物,如被囊动物和海绵[3]中提取的双吲哚烷类化合物(BIAs)表现出多种多样的药物活性,已被广泛应用于治疗纤维性肌痛、慢性疲劳和过敏性肠综合症等[4].研究表明:这类物质还可抑制雌激素依赖性和非依赖性乳腺肿瘤细胞的增殖扩散[5-6].因此,双吲哚烷类化合物(BIAs)的合成一直是有机化学领域的重要研究方向.
查阅资料,发现通过吲哚和醛或酮反应来制备双吲哚烷类化合物(BIAs)的报道已经很多,许多路易斯酸,杂多酸,离子液体都可以很好地催化此类反应[7-10].然而,通过吲哚和苊醌反应来制备双吲哚烷甲烷类化合物的报道不多.最近Feng Guo-liang等[11]报道了在研磨条件下,以固体超强酸SO42-/TiO2为催化剂,通过柱层析法提纯,来制备2,2-二(1H-吲哚-3-基)-2H-苊-1-酮类化合物,该方法操作不便,产率较低.与此相比,采用樟脑磺酸(CSA)催化,在无水乙醇中反应,收率高,时间短,操作简便,具有明显的优越性.
1实验部分
1.1反应方程式
以苊醌,取代吲哚为原料,10%的樟脑磺酸(CSA)为催化剂,无水乙醇为溶剂,在回流条件下搅拌30 min左右,制备2,2-二(1H-吲哚-3-基)-2H-苊-1-酮类化合物,反应方程式为
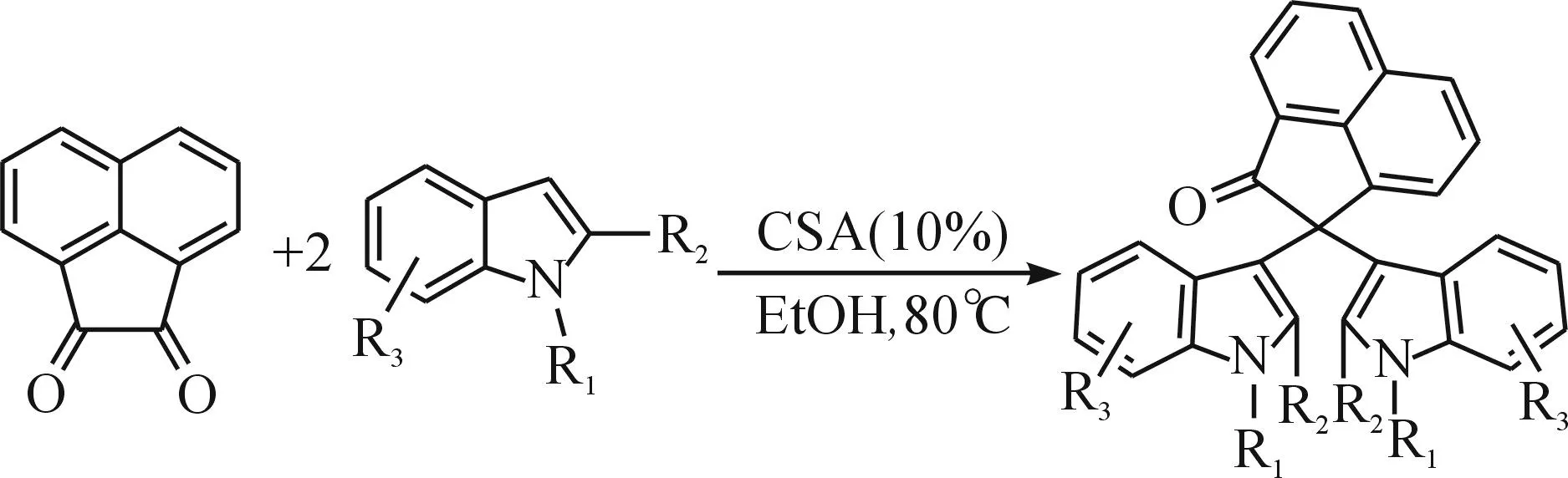
根据相关文献推测机理如下:首先,樟脑磺酸(CSA)解离出质子,质子与苊醌的羰基发生质子化反应,从而活化了羰基碳原子,吲哚3位对苊醌亲核加成形成中间体IV.接着中间体IV发生分子内脱水反应形成中间体V.然后另一分子吲哚与中间体V发生Michael加成反应形成VI,VI发生脱质子化反应,给出最终产物Ⅲa,即

1.2主要药品和试剂
苊醌(CP,阿拉丁试剂(上海)有限公司);取代吲哚(CP,阿拉丁试剂(上海)有限公司);樟脑磺酸(CP,上海思域化工科技有限公司);其他药品及溶剂均为分析纯,均购自国药集团化学试剂有限公司.
1.3实验过程
2,2-二(1H-吲哚-3-基)-2H-苊-1-酮类化合物合成通法:
在50 mL圆底烧瓶中,加入0.5 mmol苊醌, 1.0 mmol取代吲哚,0.05 mmol樟脑磺酸(CSA),5 mL无水乙醇,反应液在回流条件下搅拌30 min左右(反应进程用TLC跟踪监测).反应完全后,将反应液冷却到室温,加入5 mL蒸馏水,析出黄色固体粉末,抽滤,用1 mL冷的无水乙醇洗涤2次,真空干燥得产物,无需进一步纯化,收率93%~98%.
产物分析数据:
产物Ⅲa: 黄色粉末; IR (KBr,v, cm-1): 3 417, 3 359, 3 121, 3 057, 1 684, 1 621, 1 600, 1 492, 1 457, 1 414, 1 384, 1 339, 1 242, 1 102, 1 014;1H NMR (500 MHz, DMSO-d6): δ 10.98 (s, 2H, NH), 8.37 (d,J=8.0 Hz, 1H), 8.04~7.97 (m, 2H), 7.91~7.88 (m, 1H), 7.71~7.68 (m, 1H), 7.55 (d,J=6.7 Hz, 1H), 7.35 (d,J=8.0 Hz, 2H), 7.02~6.99 (m, 4H), 6.85 (s, 2H), 6.74 (t,J=7.4 Hz, 2H);13C NMR (125 MHz, DMSO-d6): δ 202.6, 143.9, 139.6, 137.0, 132.0, 131.5, 130.5, 129.0, 128.8, 125.8, 124.6, 124.1, 122.2, 121.7, 121.0, 120.6, 118.3, 114.9, 111.7, 57.7; MSm/z398 (M+). Anal. Calcd. for C28H18N2O: C, 84.40; H, 4.55; N, 7.04. Found: C, 84.52; H, 4.57; N, 7.06%.
产物Ⅲb: 黄色粉末; IR (KBr,v, cm-1): 3 418, 3 044, 2 932, 2 881, 2 821, 1 714, 1 614, 1 536, 1 465, 1 422, 1 364, 1 329;1H NMR (500 MHz, DMSO-d6): δ 8.37 (d,J=8.1 Hz, 1H), 8.06~7.96 (m, 2H), 7.90 (t,J=7.5 Hz, 1H), 7.70 (t,J=7.6 Hz, 1H), 7.56 (d,J=6.9 Hz, 1H), 7.37 (d,J=8.2 Hz, 2H), 7.11~7.00 (m, 4H), 6.88 (s, 2H), 6.79(t,J=7.5 Hz, 2H), 3.68 (s, 6H, CH3);13C NMR (125 MHz, DMSO-d6): δ 202.4, 143.7, 137.4, 132.1, 131.4, 130.5, 129.0, 128.8, 128.7, 126.1, 124.1, 122.3, 121.7, 121.1, 120.7, 118.5, 113.9, 109.8, 57.4, 32.3; MSm/z426 (M+). Anal. Calcd. for C30H22N2O: C, 84.48; H, 5.20; N, 6.57. Found: C, 84.62; H, 5.23; N, 6.59%.
产物Ⅲc: 黄色粉末; IR (KBr,v, cm-1): 3 384, 3 343, 3 049, 1 718, 1 685, 1 621, 1 600, 1 491, 1 459, 1 428, 1 385, 1 022;1H NMR (500 MHz, DMSO-d6): δ 10.90 (s, 1H, NH), 10.88 (s, 1H, NH), 8.33 (d,J=8.1 Hz, 1H), 8.07~7.99 (m, 2H), 7.87 (t,J=7.6 Hz, 1H), 7.65 (t,J=7.7 Hz, 1H), 7.43 (d,J=6.9 Hz, 1H), 7.21 (t,J=7.0 Hz, 2H), 6.87(dt,J=11.1, 7.5 Hz, 2H), 6.59 (t,J=7.5 Hz, 1H), 6.56~6.50 (m, 2H), 6.33 (d,J=8.1 Hz, 1H), 1.84 (s, 3H, CH3), 1.79 (s, 3H, CH3);13C NMR (125 MHz, DMSO-d6): δ 202.0, 144.0, 140.0, 135.0, 134.9, 133.6, 133.3, 132.7, 131.6, 130.3, 128.9, 128.7, 127.6, 127.3, 124.0, 122.2, 121.8, 119.7, 119.6, 119.5, 119.4, 118.0, 117.9, 110.9, 110.3, 110.1, 57.5, 13.4, 13.3; MSm/z426 (M+). Anal. Calcd. for C30H22N2O: C, 84.48; H, 5.20; N, 6.57. Found: C, 84.63; H, 5.22; N, 6.59%.
产物Ⅲd: 黄色粉末; IR (KBr,v, cm-1): 3 396, 3 371, 3 134, 2 932, 2 825, 1 699, 1 620, 1 581, 1 483, 1 456, 1 436, 1 259, 1 215;1H NMR (500 MHz, DMSO-d6): δ 10.82 (s, 2H, NH), 8.37 (d,J=8.1 Hz, 1H), 8.01 (t,J=7.0 Hz, 2H), 7.92~7.87 (m, 1H), 7.74~7.68 (m, 1H), 7.54 (d,J=6.9 Hz, 1H), 7.24 (d,J=8.8 Hz, 2H), 6.86 (s, 2H), 6.67 (dd,J=8.7, 2.1 Hz, 2H), 6.41 (s, 2H), 3.40 (s, 6H, OCH3);13C NMR (125 MHz, DMSO-d6): δ 202.8,152.5, 143.8, 139.7, 132.2, 132.0, 131.7, 130.4, 129.0, 128.8, 126.2, 125.4, 124.0, 122.0, 121.7, 114.2, 112.1, 110.4, 103.2, 57.6, 54.9; MSm/z458 (M+). Anal. Calcd. for C30H22N2O3: C, 78.59; H, 4.84; N, 6.11. Found: C, 78.72; H, 4.86; N, 6.13%.
产物Ⅲe: 黄褐色粉末; IR (KBr,v, cm-1): 3 430, 3 331, 3 049, 2 967, 2 851, 1 708, 1 620, 1 581, 1 461, 1 336, 1 283, 1 239;1H NMR (500 MHz, DMSO-d6): δ 11.25 (s, 2H, NH), 8.39 (d,J=8.1 Hz, 1H), 8.07~8.02 (m, 2H), 7.92 (t,J=7.5 Hz, 1H), 7.74 (t,J=7.6 Hz, 1H), 7.55 (d,J=6.9 Hz, 1H), 7.40 (d,J=8.6 Hz, 2H), 7.03 (d,J=8.6 Hz, 2H), 7.00~6.93 (m, 4H);13C NMR (125 MHz, DMSO-d6): δ 202.3, 142.9, 139.5, 135.5, 132.4, 131.0, 130.5, 129.1, 129.0, 126.7, 126.4, 124.4, 123.1, 122.6, 121.7, 121.2, 119.4, 114.4, 113.4, 57.2; MSm/z467 (M+). Anal. Calcd. for C28H16Cl2N2O: C, 71.96; H, 3.45; N, 5.99. Found: C, 71.84; H, 3.43; N, 6.01%.
产物Ⅲf: 棕黄色粉末; IR (KBr,v, cm-1): 3 380, 3 049, 2 967, 2 851, 1 712, 1 598, 1 493, 1 458, 1 434, 1 104;1H NMR (500 MHz, DMSO-d6): δ 10.95 (s, 2H, NH), 8.36 (d,J=8.0 Hz, 1H), 8.00 (t,J=7.6 Hz, 2H), 7.89 (t,J=7.4 Hz, 1H), 7.69 (t,J=7.5 Hz, 1H), 7.53 (d,J=6.7 Hz, 1H), 6.86~6.77 (m, 6H), 6.65 (t,J=7.4 Hz, 2H), 2.42 (s, 6H, CH3);13C NMR (125 MHz, DMSO-d6): δ 202.6, 144.0, 139.6, 136.4, 132.0, 131.6, 130.4, 128.9, 128.8, 125.5, 124.3, 124.0, 122.1, 121.6, 121.5, 120.6, 118.5, 118.3, 115.3, 57.8, 16.7; MSm/z426 (M+). Anal. Calcd. for C30H22N2O: C, 84.48; H, 5.20; N, 6.57. Found: C, 84.59; H, 5.22; N, 6.59%.
产物Ⅲg: 棕黄色粉末; IR (KBr,v, cm-1): 3 429, 3 339, 3 122, 3 051, 1 708, 1 683, 1 601, 1 564, 1 493, 1 456, 1 333, 1 282, 1 094;1H NMR (500 MHz, DMSO-d6): δ 11.26 (s, 2H, NH), 8.40 (d,J=8.1 Hz, 1H), 8.07~8.03 (m, 2H), 7.97~7.89 (m, 1H), 7.77~7.72 (m, 1H), 7.54 (d,J=6.9 Hz, 1H), 7.35 (d,J=8.6 Hz, 2H), 7.17~7.10 (m, 4H), 6.93 (d,J=2.5 Hz, 2H);13C NMR (125 MHz, DMSO-d6): δ 202.3, 142.8, 139.5, 135.7, 132.3, 131.0, 130.5, 129.1, 129.0, 127.3, 126.3, 124.4, 123.7, 122.6, 122.4, 121.7, 114.2, 113.9, 111.1, 57.2; MSm/z556 (M+). Anal. Calcd. for C28H16Br2N2O: C, 60.46; H, 2.90; N, 5.04. Found: C, 60.58; H, 2.93; N, 5.06%.
产物Ⅲh: 棕黄色粉末; IR (KBr,v, cm-1): 3 429, 3 373, 3 010, 3 051, 1 714, 1 626, 1 497, 1 456, 1 345, 1 237, 1 135;1H NMR (500 MHz, DMSO-d6): δ 11.07 (s, 2H , NH), 8.37 (d,J=8.1 Hz, 1H), 8.02 (dd,J=7.6, 2.5 Hz, 2H), 7.90 (t,J=7.6 Hz, 1H), 7.71 (t,J=7.6 Hz, 1H), 7.55 (d,J=6.9 Hz, 1H), 7.13 (dd,J=9.9, 2.0 Hz, 2H), 6.99 (dd,J=8.7, 5.6 Hz, 2H), 6.85 (d,J=2.2 Hz, 2H), 6.65 (td,J=9.6, 2.1 Hz, 2H);13C NMR (125 MHz, DMSO-d6): δ 202.4, 159.5, 157.7, 143.4, 139.5, 136.9, 136.8, 132.1, 131.2, 130.5, 129.0, 128.9, 125.2, 125.1, 124.2, 122.5, 122.4, 121.6, 121.5, 121.4, 114.9, 107.1, 106.9, 97.6, 97.4, 57.4; MSm/z434 (M+). Anal. Calcd. for C28H16F2N2O: C, 77.41; H, 3.71; N, 6.45. Found: C, 77.55; H, 3.69; N, 6.47%.
实验结果如表1所示.
1.4分析方法
1H NMR使用Bruker Avance Ⅲ型核磁共振仪测定(500 MHz,溶剂DMSO-d6),13C NMR使用Bruker AvanceⅢ型核磁共振仪测定(125 MHz,溶剂DMSO-d6),IR使用TENSOR 27型红外光谱仪测定,质谱使用VARIAN1200型质谱仪以EI为离子源测定,熔点使用SGW X-4型数字显示熔点测定仪测试,元素分析使用Costech ECS 4010 CHNSO型元素分析仪测定.
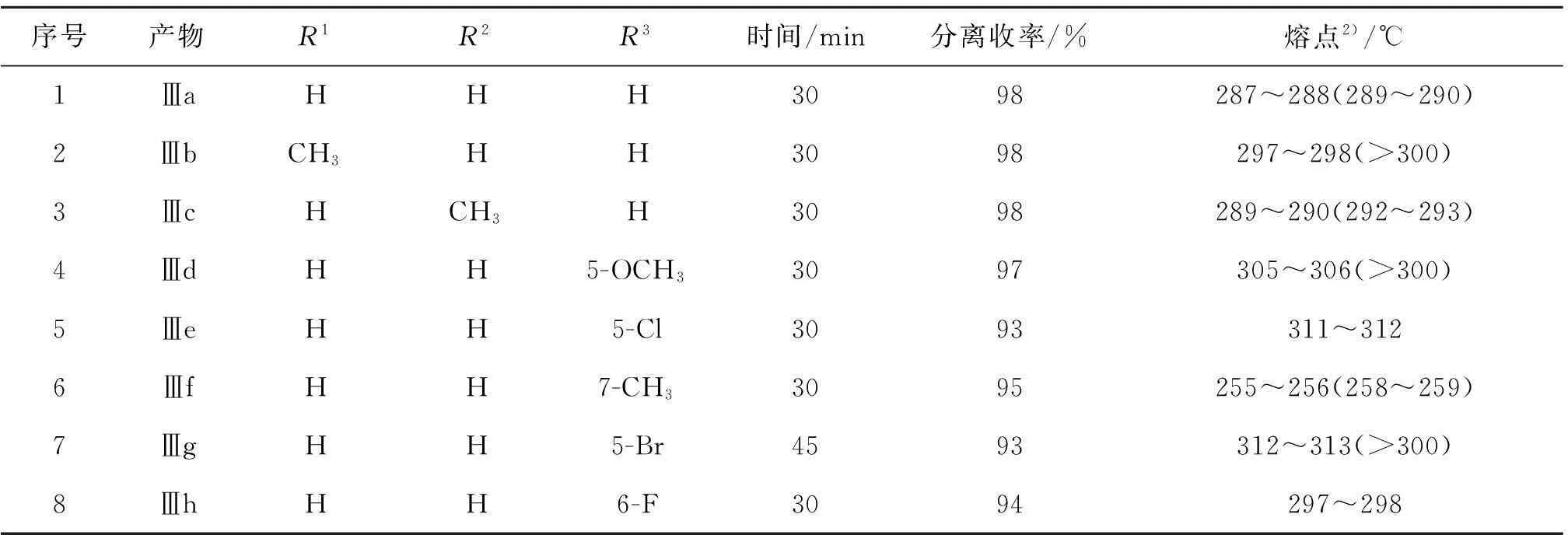
表1 2,2-二(1H-吲哚-3-基)-2H-苊-1-酮衍生物的合成1)
注:1) 反应条件:苊醌(0.5 mmol),取代吲哚(1.0 mmol),樟脑磺酸(CSA)(0.05 mmol)在无水乙醇(5 mL)中回流搅拌30 min左右; 2) 括号内为文献报道的熔点.
2结果与讨论
模板反应式为

2.1催化剂和添加量对反应的影响
首先,选择苊醌(0.5 mmol),吲哚(1.0 mmol)作为模板底物,无水乙醇为溶剂,在回流条件下,加入10%的不同催化剂,来探索催化剂对反应的影响.当使用L-脯氨酸,硼酸,七水合硫酸亚铁,二水合醋酸铜,三氧化二铝(中性)为催化剂时,需要12 h才能反应完全,而且产率都不理想,只有49%~67%;当使用六水合氯化镍,氯化锌为催化剂时,反应时间明显缩短,产率明显提高, 在6~7 h内可反应完全,产率分别达到69%,76%;当使用硝酸铈铵(CAN),单质碘为催化剂时,反应时间进一步缩短,在2 h内可以反应完全,但是产率没有进一步提高,分别为65%, 77%;当使用苯磺酸,对甲基苯磺酸催化该反应时,在2 h内可以反应完全,产率分别为82%, 84%.令人惊喜的是,当使用樟脑磺酸(CSA)催化该反应时,30 min内便可反应完全,产率也达到了令人满意的98%.因此,樟脑磺酸(CSA)为较佳催化剂,如表2所示.
接着考察了樟脑磺酸(CSA)的用量对反应的影响.通过对比试验发现:当樟脑磺酸(CSA) 的添加量为10%时,产率达到了最高的98%,在此基础上减少樟脑磺酸(CSA) 的添加量,反应时间有所延长,产率有所降低.而增加樟脑磺酸(CSA) 的添加量,反应时间没有缩短,产率反倒略有降低.因此,10%为樟脑磺酸(CSA)的最佳添加量.
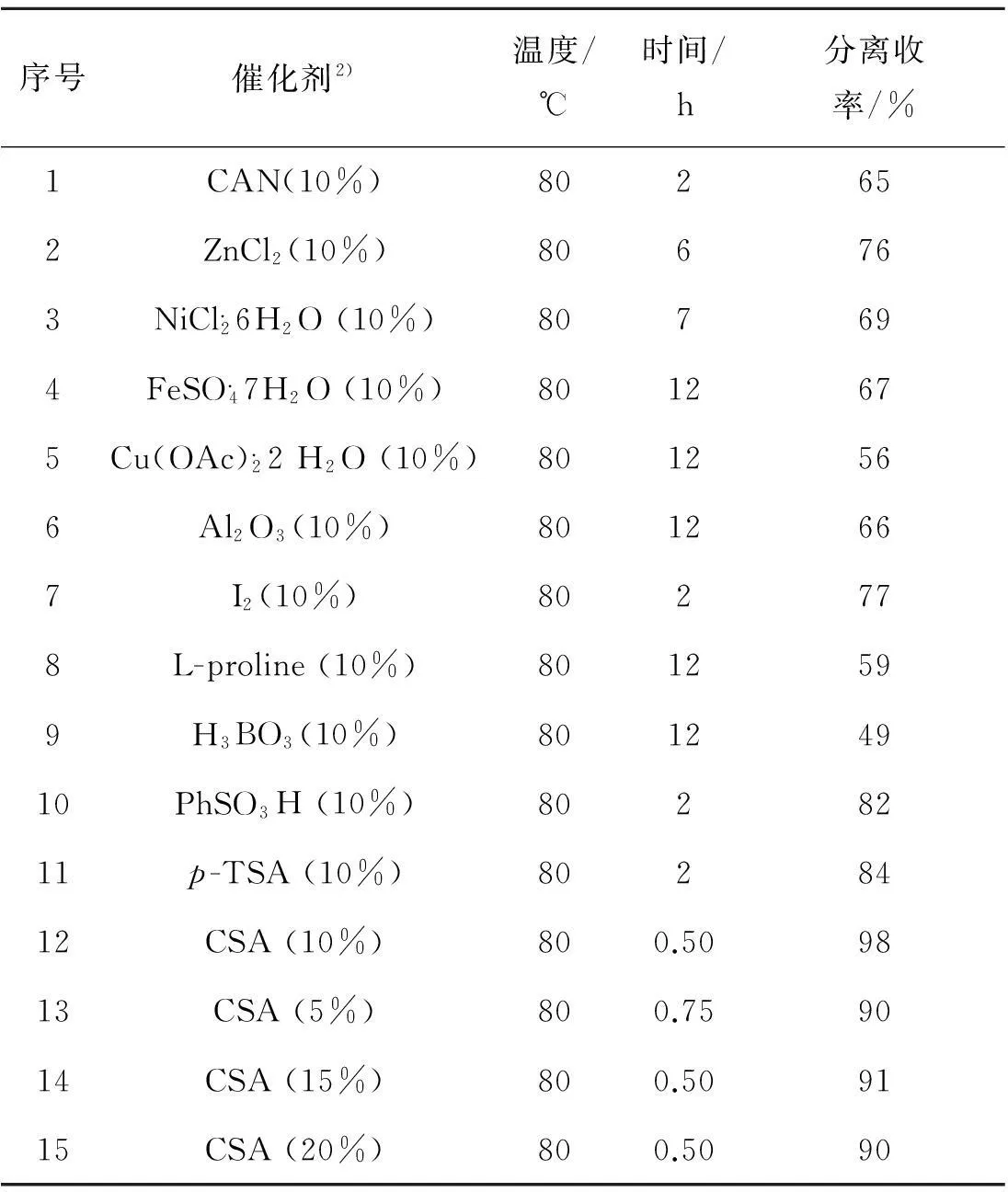
表2 催化剂对反应的影响1)
注:1) 反应条件:苊醌(0.5 mmol),吲哚(1.0 mmol) 在无水乙醇(5 mL)中回流搅拌;2) 括号内为催化剂的摩尔分数.
2.2溶剂对反应的影响
接下来,探索了溶剂对该反应的影响.与甲醇、异丙醇、乙酸乙酯、二氯甲烷和乙腈相比,无水乙醇做溶剂具有明显的优越性.反应时间明显缩短,仅仅需要30 min便可反应完全,产率也显著提高,达到了98%.因此,无水乙醇为较佳溶剂,如表3所示.

表3 溶剂对反应的影响1)
注:1) 反应条件: 苊醌(0.5 mmol),吲哚(1.0 mmol),樟脑磺酸(CSA)(0.05 mmol)在溶剂(5 mL)中回流搅拌.
2.3温度对反应的影响
最后,探索了温度对该反应的影响.由表4可以看到:随着反应温度的不断升高,反应所需时间在不断缩短,产率在不断提高.因此,选择在回流的条件下反应,以获得最短的反应时间和最高的收率.
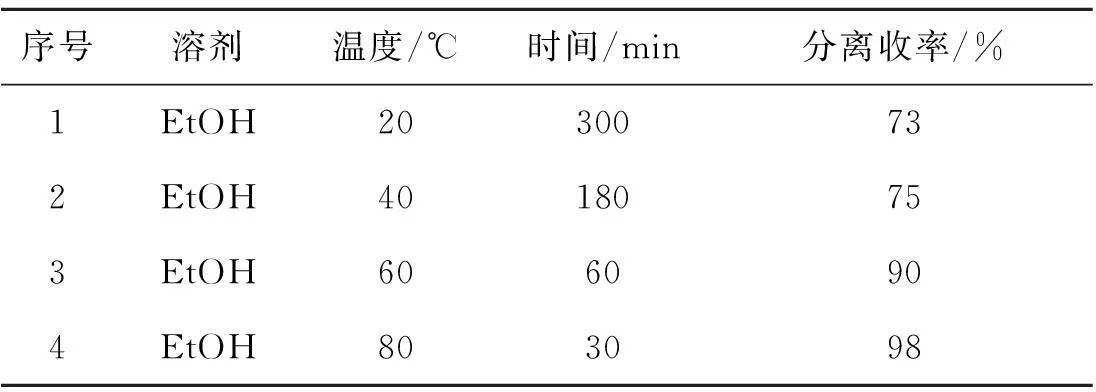
表4 温度对反应的影响1)
注:1) 反应条件: 苊醌(0.5 mmol),吲哚(1.0 mmol),樟脑磺酸(CSA)(0.05 mmol)在无水乙醇中搅拌反应.
3结论
通过一系列的实验, 找到了合成2,2-二(1H-吲哚-3-基)-2H-苊-1-酮类化合物的最佳催化剂樟脑磺酸,优化了反应条件. 在较优条件下合成了8种该类化合物,其中Ⅲe, Ⅲh是未见报道的新化合物. 其较优反应条件: 10%的樟脑磺酸(CSA)为催化剂, 无水乙醇为溶剂, 在回流条件下反应30~45 min.
参考文献:
[1]SUNDBERG R J. The chemistry of indoles [M]. New York: Academic Press, 1996.
[2]HIBINO S, CHOSHI T. Simple indole alkaloids and those with a nonrearranged monoter penoid unit [J]. Natural Product Reports, 2001, 18: 66-87.
[3]BIFULCO G, BRUNO I, RICCIO R. Further brominated bis- and tris-indole alkaloids from the deep-water New Caledonian marine sponge Orina Sp. [J]. Journal of Natural Products, 1995, 58(8): 1254-1260.
[4]BRADFIELD C A, BJELDANES L F. Structure-activity relationships of dietary indoles: a proposed mechanism of action as modifiers of xenobiotic metabolism [J]. Journal of Toxicology and Environmental Health, 1987, 21(3): 311-323.
[5]CHANG Yuchen, JACQUES R, Grace H F C, et al. Cytostatic and antiestrogenic effects of 2-(indol-3-ylmethyl)-3,39-diindolylmethane, a major In Vivo product of dietary indole-3-carbinol [J]. Biochemical Pharmacology, 1999, 58: 825-834.
[6]SHILLING A D, CARLSON D B, KATCHAMART S, et al. 3,3'-diindolylmethane, a major condensation product of indole-3-carbinol, is a potent estrogen in the rainbow trout [J]. Toxicology and Applied Pharmacology, 2001, 170 (3): 191-200.
[7]YADAV J S, REDDY B V S, MURTHY C V S R, et al. Lithium perchlorate catalyzed reactions of indoles: an expeditious synthesis of bis(indolyl)methanes [J]. Synthesis, 2001(5): 783-787.
[8]DEB M L, BHUYAN P J. An efficient and clean synthesis of bis(indolyl)methanes in a protic solvent at room temperature [J]. Tetrahedron Letters, 2006, 47: 1441-1443.
[9]FIROUZABADI H, IRANPOOR N, ABBAS A J. Aluminumdodecatungstophosphate (AlPW12O40), a versatile and a highly water tolerant green Lewis acid catalyzes efficient preparation of indole derivatives [J]. Journal of Molecular Catalysis A: Chemical, 2006, 244: 168-172.
[10]JI Shunjun, ZHOU Minfeng, GU Dagong, et al. Efficient synthesis of bis(indolyl)methanes catalyzed by Lewis Acids in ionic liquids [J]. Synlett, 2003, 13: 2077-2079.
[11]FENG Guo-liang. An efficient synthesis of 2,2-bis(1H-indol-3-yl)-2H-acenaphthen-1-one catalyzed by recyclable solid superacid SO42-/TiO2under grinding condition [J]. Chinese Chemical Letters, 2010, 21:1057.
(责任编辑:陈石平)
Synthesis of 2,2-bis(1H-indol-3-yl)-2H-acenaphthen-1-one
catalyzed by camphorsulfonic acid (CSA)
SONG Qingbao, DANG Haibo, SHEN Tianhua, LIN Yan
(College of Chemical Engineering , Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:Bisindolylalkanes (BIAs) are an important class of bioactive metabolite. The 2,2-bis (1H-indol-3-yl)-2H-acenaphthen-1-one derivatives were synthesized from acenaphthenequinone and substituted indoles. The reaction conditions were explored, and a novel and efficient synthesis protocol was obtained. The reactions were carried out in the prensence of 10%of camphorsulfonic acid (CSA) in ethanol under reflux for about 30 minutes, the yields of products could be over 93%. The structures of all products were established on the basis of1H NMR spectral data,13C NMR spectral data, IR, MS and elemental analysis.
Keywords:2,2-bis(1H-indol-3-yl)-2H-acenaphthen-1-one; acenaphthenequinone; indole; camph-orsulfonic acid (CSA)
文章编号:1006-4303(2015)04-0364-05
中图分类号:O626.13
文献标志码:A
作者简介:宋庆宝(1959—),男,吉林磐石人,教授,博士,主要从事有机合成研究,E-mail:qbsong@zjut.edu.cn.
基金项目:浙江省自然科学基金资助项目(LY12B02016)
收稿日期:2014-04-22