锂/亚硫酰氯电池高温贮存性能
马 苓徐 强∗桑 林丁 飞刘兴江
(1.天津大学化工学院,天津300072;2.中国电子科技集团公司第十八研究所,化学与物理电源重点实验室,天津300384)
锂/亚硫酰氯(Li-SOCl2)电池是一种高比能的一次锂电池。其中亚硫酰氯(SOCl2)既是正极活性物质,又是电解液的一种组分。Li-SOCl2电池的表达式为:

负极反应:

正极反应:

总的电池反应为:

Li/SOCl2电池反应的中间产物包括 S2Cl2、SO、S2O、SO2和 SO2Cl2等[1-3]。
Li/SOCl2电池主要有以下特点[4-6]:1)放电电压高,Li/SOCl2电池的开路电压为一般为3.6~3.7 V,实际工作电压在3 V以上;2)放电电压平稳,在放出90%的容量之前,电池的工作电压几乎保持不变;3)高比能量,Li/SOCl2电池是一种比能量最高的一次锂电池,其比能量高达590 Wh·kg-1和1 100 Wh·L-1;4)工作温度范围宽,由于电解液的冰点低(-110℃以下)、沸点高(78.8℃),电池的工作温度范围一般为-60~85℃。由于具备上述优点,Li/SOCl2电池已经在航天、交通、智能仪器仪表等领域得到了广泛应用。特别是从20世纪70年代开始,Li/SOCl2电池开始作为引信电源在导弹发射、鱼雷推进等军事领域得到大规模应用[7]。虽然Li/SOCl2电池具有很多的优点,但也存在许多的不足之处。如安全稳定性低、低温放电时容量下降较大、贮存后使用时常伴有电压滞后现象以及大电流放电能力差等缺点,从而限制了该电池的应用范围[8-9]。由于在 Li/SOCl2电池的实际使用过程中,不可避免地需要在使用前储存一段时间,而在这一储存过程中,特别是在高温储存条件下,电池的性能如放电容量、电池阻抗、安全性能等会出现一定程度的下降,而这些下降会不同程度地影响到Li/SOCl2电池的使用效果。
为了研究Li/SOCl2电池在不同储存条件下放电性能的变化规律,利用商品化的Li/SOCl2电池作为研究对象,在相同储存温度(60℃)的条件下研究了不同储存时间对Li/SOCl2电池放电性能的影响规律。然后在储存相同时间(21 d)的条件下,研究了不同储存温度对Li/SOCl2电池放电性能的影响规律。
1 实验方法
实验采用的测试电池为商品化的ER17505M型Li/SOCl2电池,电池的标称容量为2 800 mAh。为了研究不同储存时间对电池放电性能的影响,将50只Li/SOCl2电池分成5组(每组10只电池)分别进行放电性能试验。实验时,5组电池被平放在60℃的恒温烘箱中,分别储存7、14、25、35和45 d。 储存实验结束后,取出1组电池并在室温下静置6 h后,在开路电压下进行电化学阻抗测试。然后,将各组电池再分成2个小组(每小组各5只电池))分别进行恒流放电测试,恒流放电的测试电流分别为28 mA(0.01C)和84.85 mA(0.03C),放电的截止电压均为2 V。恒流放电结束后,静置约4 h,在开路电压下重复测试电池的交流阻抗。
为了研究不同储存温度对Li/SOCl2电池放电性能的影响,将40只Li/SOCl2电池分成4组(每组10只电池)分别平放在40、50、60和70℃的恒温烘箱中储存21 d。实验结束后,将各组电池分别从烘箱中取出。室温下静置大约6 h后,在开路电压下进行电化学阻抗测试。然后,将每组电池再分成2个小组(每小组各5只电池))分别进行恒流放电测试,放电的电流分别为28 mA(0.01C)和84.85 mA(0.03C),放电的截止电压均为2 V。恒流放电结束后,静置约4 h,在开路电压下重复测试电池的交流阻抗。为了研究电池的开路电压随储存时间的变化情况,在电池恒流放电开始前设置1min的静置步骤,并记录电池的开路电压。
采用输力强阻抗测试仪(Solartron Instruments Model 1400/1470E)进行电化学阻抗谱测试,施加的正弦电位信号幅值为5 mV,测试的频率范围为10~1 000 kHz。恒流放电测试在武汉LANDCT2001A型电池测试仪上进行。
2 结果与讨论
2.1 储存时间对电池放电性能的影响
图1为在60℃温度下储存不同时间后的Li/SOCl2电池在0.01C倍率下的放电曲线。从图1中可以发现,不同储存时间后的放电曲线形状几乎相同,均是经历一段水平段后突然地下降。这表明在放电过程中,Li/SOCl2电池的工作电压非常平稳,直到放电临近终止时,电池的工作电压才开始迅速下降。由于作为正极活性物质的亚硫酰氯呈液体状态储存在比表面积很大的多孔碳集流体内,在放电过程中所产生的电化学极化和浓差极化均比较小。在小电流放电条件下,电极反应在放电过程中比较平缓,所以放电电压具有稳定的工作平台。随着储存时间的延长,电池的放电电压和放电容量均有所降低。这是由于金属锂负极非常活泼,会持续地与电解液发生反应造成电池发生自放电[10]。电池储存的时间越长,电池的自放电也越严重。
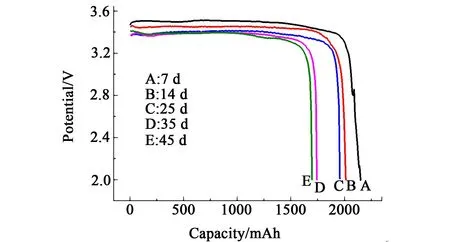
图1 在60℃储存不同时间后在0.01C下的放电曲线Fig.1 The discharge curves of cells at 0.01C after storage at 60℃for different storage time
图2为在60℃温度下储存不同时间后的Li/SOCl2电池在0.03C倍率下的放电曲线。从图2中可以发现,Li/SOCl2电池储存不同时间后的放电曲线形状与图1基本相似,均是经历一段水平段后突然地下降。电池的放电电压和放电容量也是随着储存时间的延长而有所降低,而且下降的幅度比0.01C放电时有所增加。与图1不同的是,图2中的B、C、D、E 4条曲线的电压平台在放电初期均出现了短暂的下降现象。这表明随着放电电流的增加,Li/SOCl2电池的放电出现了明显的“滞后效应”[11-12]。放电平台越低,电压滞后现象越明显。这是因为锂负极与电解液接触时在锂表面上形成了一层LiCl钝化膜的缘故。电池的储存时间越长,放电电流越大,电压滞后现象越明显。
表1列出了Li/SOCl2电池在两种不同倍率下的放电容量。从表1可以看出,在60℃下储存相同时间后,Li/SOCl2电池在0.03 C倍率下的放电容量均低于在0.01 C倍率下的放电容量。这是由于随着放电电流的增加,电极的极化也会增大,进而导致电池内阻升高的缘故。

图2 在60℃下储存不同时间后在0.03C下的放电曲线Fig.2 The discharge curves at 0.03C after storage at 60℃for different storage time
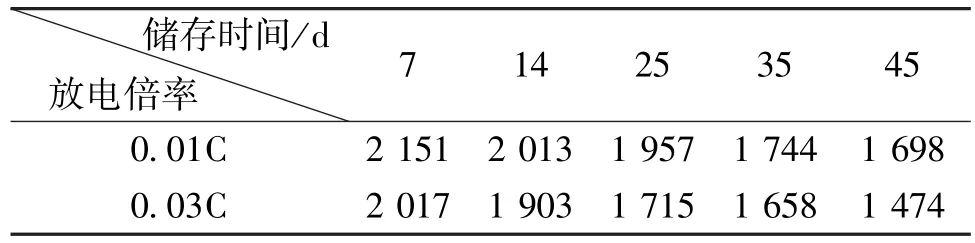
表1 不同时间储存后2种倍率放电的容量对比(mAh)Table 1 The discharge capacities at different currents after storage for different time (mAh)
图3为Li/SOCl2电池在60℃下储存不同时间后放电前(荷电态)的交流阻抗谱图。
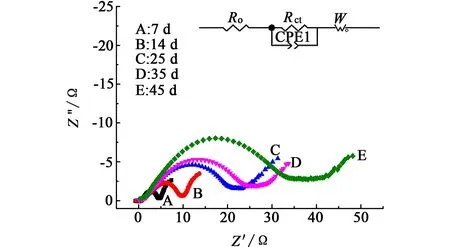
图3 不同储存时间的电池放电前的交流阻抗图谱Fig.3 Nyquist plots of cells storaged for different times before discharge
从图3中可以发现,所有曲线均是由1个半圆弧和1条直线所组成。其中高频区的半圆弧代表正极与电解液界面的电荷转移阻抗Rct,低频区的直线代表离子传输的Warburg阻抗[13]。阻抗谱的等效电路如图3中所示。从图3中可以发现,随着储存时间的延长,Li/SOCl2电池正极与电解液界面的电荷转移阻抗Rct不断增大。这是因为随着储存时间的延长,Li/SOCl2电池的自放电反应所生成的固态LiCl和未溶解的S会在正极多孔碳骨架的表面发生沉积,造成电解液在孔内传输困难,使得正极与电解液的界面阻抗增加[14]。
图4为Li/SOCl2电池在60℃下储存不同时间后于0.01C和0.03C放电后(放电态)的交流阻抗谱图。与图3不同,图4中的所有曲线均是由2个半圆和1条斜线所组成。其中,高频段的半圆弧代表电池正极界面钝化膜的传输阻抗Rsei,中频段的半圆弧代表正极与电解液界面的电子转移阻抗Rct,低频段的直线代表离子传输的Warburg阻抗。阻抗谱的等效电路如图4中所示。

图4 不同储存时间的电池放电后的交流阻抗图谱Fig.4 Nyquist plots of cells storaed for different times after discharge
从图4中可以发现,与图3相比,图4中的所有阻抗谱均多出1个高频段阻抗弧。这是由于放电前,Li/SOCl2电池的正极表面没有界面膜,所以在阻抗谱中几乎看不到正极钝化膜的阻抗弧。而在放电后,电池正极多孔碳的表面和内孔逐渐被放电产物LiCl和未溶解的S所覆盖和堵塞,形成一层绝缘的钝化膜的缘故[9]。此外,电池放电后的钝化膜阻抗Rsei和电子转移阻抗Rct均是随着储存时间的增加而增大。值得注意的是,图4b)中各条阻抗谱的钝化膜阻抗Rsei和电子转移阻抗Rct均小于图4a)中对应的阻抗谱中的Rsei和Rct,这是由于在小电流放电条件下得到的放电产物比在大电流放电条件下得到的放电产物更加致密的缘故[15]。表2和表3列出了放电前后电池阻抗谱等效电路的Rsei和Rct值。
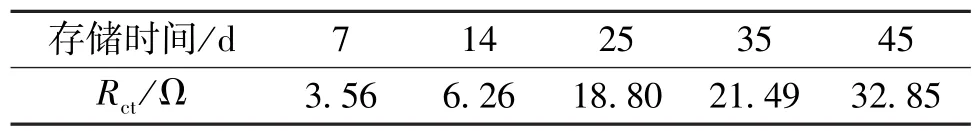
表2 电池放电前的RctTable 2 Charge transfer impedance of Rctbefore discharge

表3 放电后的Rsei和RctTable 3 The Rseiand Rctafter discharge
2.2 储存温度对电池放电性能的影响
图5和图6分别为Li/SOCl2电池在不同温度下储存21 d后,分别在0.01C和0.03C倍率下的放电实验结果。

图5 在不同温度下储存21 d后0.01C放电曲线Fig.5 Discharge curves at 0.01C after storage for 21 d at different temperature
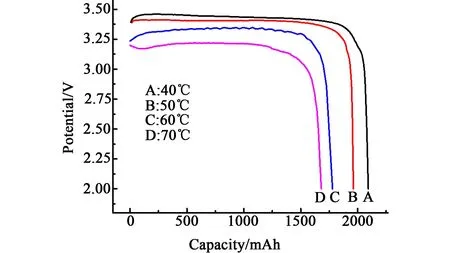
图6 不同温度下储存21 d后在0.03C下的放电曲线Fig.6 The discharge curves at 0.03C after storagefor 21 d at different temperature
从图5和图6中可以发现,在相同的放电条件下,储存温度越高,电池的放电容量越低。
按照阿伦尼乌斯方程[16],

式(1)中:k为反应速率常数,min-1;k0为频率因子常数,min-1;Ea为反应活化能,J·mol-1;R为气体常数,8.314 J·mol-1·K-1;T为绝对温度,K。
储存温度升高,会使负极锂与电解液的化学反应速度加快,造成Li/SOCl2电池的自放电加剧,导致电池的容量下降。此外,随着储存温度的升高,自放电反应的放电产物的扩散速度也会加快,会有更多的固态产物LiCl和未溶解的S在正极多孔碳表面发生沉积,进而堵塞多孔碳的内部扩散通道,这也会导致电池的容量降低。
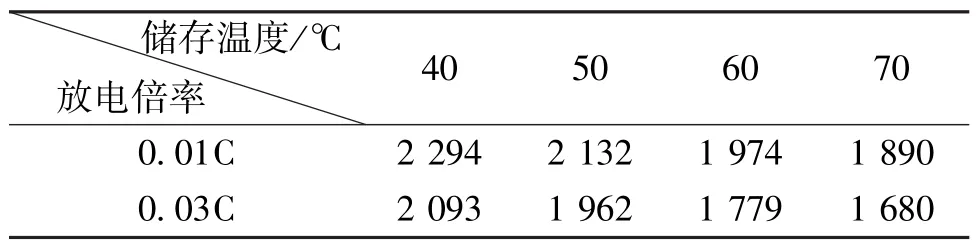
表4 电池在不同温度储存21 d后的放电容量(mAh)Table 4 Discharge capacities at different current after storage for 21 d (mAh)
表4列出了Li/SOCl2电池在2种倍率下的放电容量。从表4中可以看出,在相同的储存时间和温度条件下,Li/SOCl2电池在0.03C倍率下的放电容量均低于在0.01C倍率下的放电容量。这是由于放电电流的增加会导致电极极化的增大,进而造成电池内阻升高的缘故[15]。
图7为Li/SOCl2电池在不同温度下储存21 d后放电前的交流阻抗谱图。
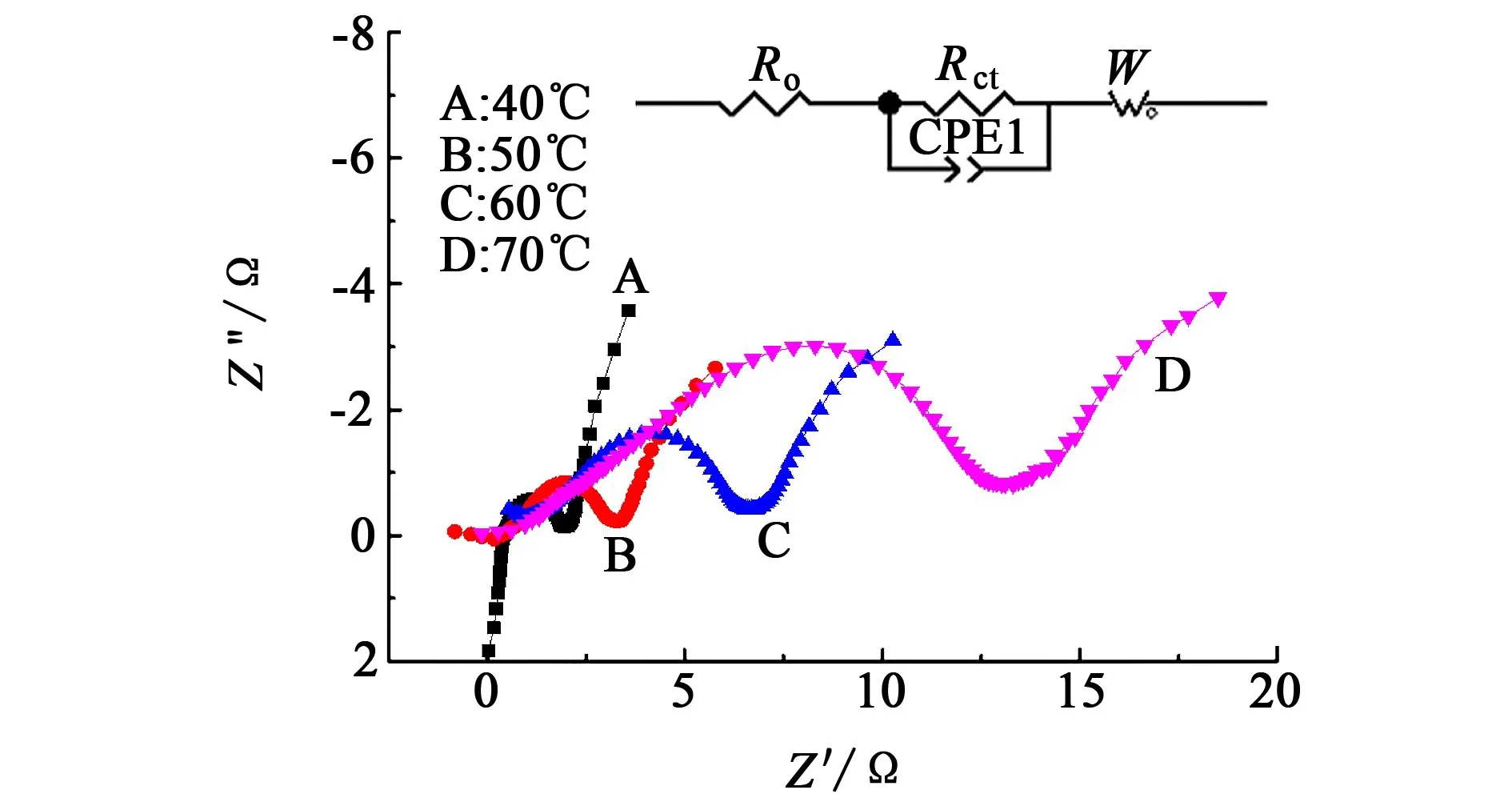
图7 电池在不同温度下储存21 d后放电前的交流阻抗图谱Fig.7 Nyquist plots before discharge for 21 d at different temperature
与图3相同,图7中所有的阻抗谱曲线均是由1个半圆弧和1条直线所组成,阻抗谱的等效电路如图7中所示。随着储存温度的升高,Li/SOCl2电池正极与电解液界面的电荷转移阻抗Rct不断地增大。这是因为随着储存温度的升高,Li/SOCl2电池的自放电速度加快,反应生成更多的固态LiCl产物和未溶解的S,并在正极多孔碳骨架的表面发生沉积,造成正极与电解液的界面阻抗增加的缘故[17]。
图8为Li/SOCl2电池在不同温度下储存21 d后,分别在0.01C和0.03C倍率放电后的电化学阻抗图谱。
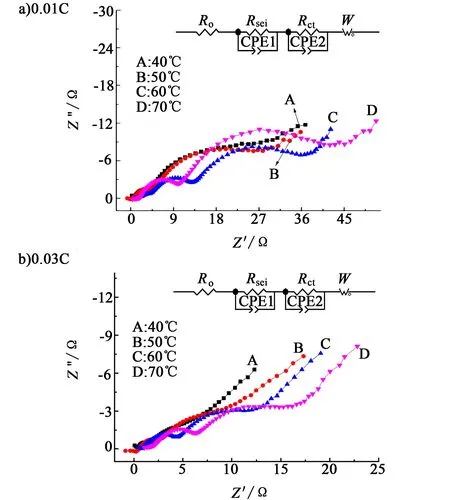
图8 电池在不同温度下储存21 d放电后阻抗图谱Fig.8 Nyquist plots after discharge for 21 d at different temperature
与图4相同,图8中的所有交流阻抗谱均是由2个半圆和1条斜线所组成。与放电前(图7)阻抗谱相同的是,放电后(图8)的钝化膜阻抗Rsei和电子转移阻抗Rct均是随着电池储存温度的升高而增大[18]。与图7不同的是,图8中的所有阻抗谱均多出1个高频段阻抗弧。另外,图8b)中所有阻抗谱的Rsei和Rct均小于图8a)中对应阻抗谱的Rsei和Rct,这是由于在小电流放电的产物比在大电流的放电产物更加致密的缘故。表5和表6列出了放电前后电池阻抗谱等效电路的Rsei和Rct值。

表5 储存不同温度后放电前的RctTable 5 Charge transfer impedance of Rctbefore discharge at different temperature
2.3 电池开路电压在储存期间的变化
图9为Li/SOCl2电池的开路电压在不同温度下随储存时间的变化曲线。

表6 储存不同温度后放电后阻抗的Rsei和RctTable 6 The Rseiand Rctafter discharge at different temperature
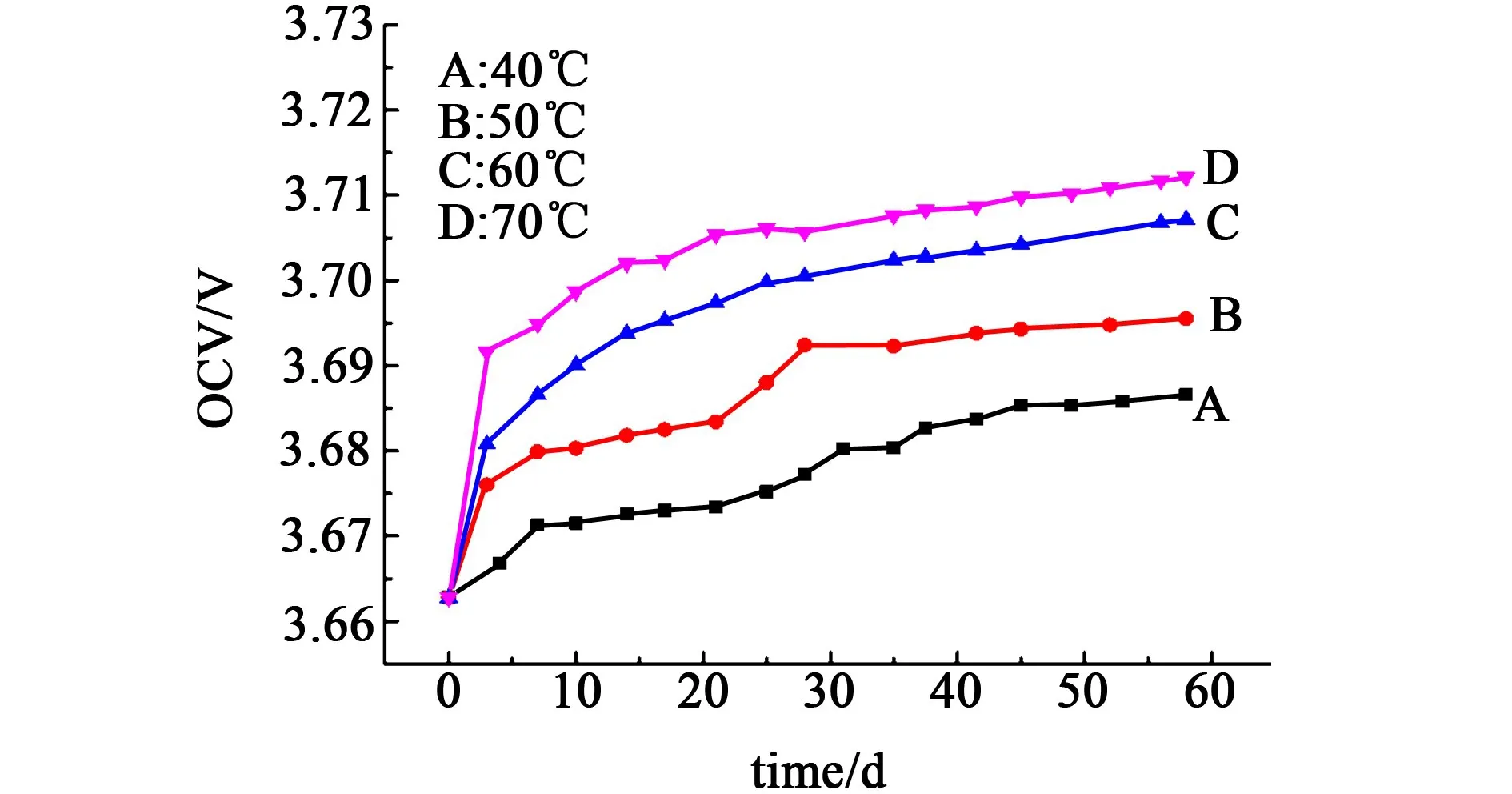
图9 电池的开路电压在不同温度下随储存时间的变化Fig.9 The dependence of OCV of cells on storage time at different temperature
从图9中可以看出,Li/SOCl2电池在固定温度下储存时,随着储存时间的延长,电池的开路电压也随之升高。而且储存的温度越高,电池的开路电压也越大。造成这种现象的原因是:Li/SOCl2电池在储存过程中,Li和SOCl2发生反应生成S2Cl2和SO2[19]。 反应式如(2):

当电池放电时,S2Cl2会被还原成S和LiCl,即:
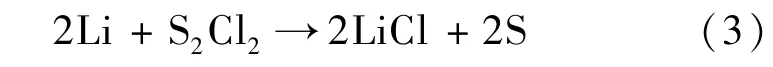
通过上述分析可知,随着储存时间的增长和储存温度的升高,Li/SOCl2电池中的S2Cl2和SO2的浓度会增大。 Li/S2Cl2电池体系的电势大约为 3.92 V[19],比Li-SOCl2电池体系的电势高,所以Li/SOCl2电池的开路电压会随着S2Cl2浓度的升高而缓慢增大。
3 结论
储存时间对Li/SOCl2电池的放电性能有较大的影响,储存时间越长,储存后电池的放电平台越低,电池的容量衰减得就越多。60℃下储存25 d后,0.03C放电只能放出1 715 mAh的容量,已经低于电池的初始容量的80%。另外,储存温度对电池性能有很大的影响,在40、50、60和70℃储存后的电池,容量差异很大,储存相同时间时,储存温度越高,电池的容量衰减得越多,放电电压平台就越低,尤其在60℃下储存21 d后,0.03C放电时电池放出的容量为1 779 mAh,已经低于电池初始容量的80%。此外,Li/SOCl2电池在高温下储存一段时间后,其开路电压也会升高。综上考虑,Li/SOCl2电池不宜在60℃及其以上高温下进行长期储存,储存时间不宜超过25 d。
[1]Treptow R S.Lithium batteries:A practical application of chemical principles[J].Journal of Chemical Education,2003,80(9):1 015-1 020
[2]Istone W K,Bodd R J.The mechanism of thionyl chloride reduction at solid electrodes[J].Journal of the Electrochemical Society,1984,11:2 467-2 470
[3]Schlaiker C R,Goebel F,Marincic N.Discharge reaction mechanisms in Li/SOCl2cells[J].Journal of Electrochemical Society,1979,126(4):513-522
[4]Arora P,Zhang Z.Battery separators[J].Chemical Reviews,2004,104:4 419-4 462
[5]Xu Z,Zhang G,Cao Z,et al.Effect of N atoms in the backbone of metal phthalocyanine derivatives on their catalytic activity to lithium battery[J].Journal of Molecular Catalysis A:Chemical,2010,318:101-105
[6]Xu Z,Zhao J,Li H,et al.Influence of the electronic configuration of the central metal ions on catalytic activity of metal pathalocyanines to Li/SOCl2battery[J].Journal of Power Sources,2009,194:1 081-1 084
[7]Beyle G H,Goebel F.Development and characterization of a high capacity lithium thionyl chloride battery[J].Journal of Power Sources,1995,54(2):186-191
[8]Tian J,Liu S.Study of sealing quality of small Li/SOCl2cells[J].Journal of Power Sources,1995,55(1):107-109
[9]Guo Y,Ge H,Zhou G,et al.Comparative study on carbon cathodes with and without cobalt phthalocyanine in Li/(SOCl2+BrCl)cells[J].Journal of Power Sources,2009,194:508-514
[10]Spotnitz R M,Yeduvaka G S,Jungst R,et al.Modeling self-discharge of Li/SOCl2cells[J].Journal of Power Sources,2006,163:578-583
[11]Ko Y O,Lee C T.Effects of the structural characteristics of carbon cathode on the initial voltage delay in Li/SOCl2battery[J].Journal of Industrial and Engineering Chemistry,2012,18(2):726-730
[12]Chung K I,Lee J S,Ko Y O.Electrical analysis of Li/SOCl2cell connected with electrochemical capacitor[J].Journal of Power Sources,2005,140:376-380
[13]Lee S B,Lee E J.Effect of the compactness of the lithium chloride layer formed on the carbon cathode on the electrochemical reduction of SOCl2electrolyte in Li-SOCl2batteries[J].Electrochimica Acta,2001,47:855-864
[14]Su X,Li J,Yao G,et al.The synthesis and catalytic activity to Li/SOCl2battery of two new porphyrins[J].Catalysis Communications,2013,37:23-26
[15]Kim C H,Pyun S I.Growth kinetics of lithium chloride layer formed on porous carbon cathodes during discharge of Li/SOCl2batteries[J].Journal of the Electrochemical Society,2003,150(9):A1 176-A1 181
[16]Catti M,Ghaani M R,Pinus I.Overpressure role in isothermal kinetics of H2desorption-absorption: The 2LiBH4-Mg2FeH6system[J].The Journal of Physical Chemistry C,2013,117:26 460-26 465
[17]Bodenes L,Naturel R,Martinez H,et al.Lithium secondary batteries working at very high temperature:Capacity fade and understanding of aging mechanisms[J].Journal of Power Sources,2013,236:265-275
[18]Fey G T,Liu W K,Chang Y C.Temperature and concentration effects on the conductivity of LiAlCl4/SOCl2electrolyte solutions[J].Journal of Power Sources,2001,97/98:602-605
[19]Bailey J B.Investigation of thionyl chloride decomposition and open circuit potential in lithium-thionyl chloride cells[J].Journal of the Electrochemical Society,1989,136(10):2 794-2 797

