犬血浆中特比萘芬的高效液相色谱检测方法
王东亮,聂巧,李宇琛,吴天兴,卜仕金*
(1.扬州大学兽医学院,江苏扬州 225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
犬血浆中特比萘芬的高效液相色谱检测方法
王东亮1,2,聂巧1,2,李宇琛1,2,吴天兴1,2,卜仕金1,2*
(1.扬州大学兽医学院,江苏扬州 225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
建立并优化一种简单、快速、灵敏、高选择性的HPLC方法测定犬血浆中特比萘芬血药浓度,并考察方法的稳定性。特比萘芬血浆样品经提取剂乙腈-异丙醇(用磷酸调pH至3.0)(40:60,V/V)液-液萃取后,提取液经40 ℃氮气吹干,用流动相复溶后离心过滤,取上清液20 μL进样分析,对血样处理后及标准溶液保存不同时间后的稳定性进行了考察。色谱柱Agilent 5 HC-C18(2)柱(250 mm×4.6 mm,5 μm);流动相甲醇-0.1%磷酸水(59:41,V/V);流速0.8 mL/min;紫外检测波长223 nm;柱温35 ℃。色谱峰分离良好,无干扰。特比萘芬最低检测浓度为0.01 μg/mL,线性范围是0.02 ~ 5 μg/mL,相关回归方程:y=356.28x-2.0311(r2=0.99989)。低、中、高血浆质控样品日内RSD均小于5%,日间RSD均小于7%,方法平均回收率分别为108.9%,100.4%,102.1%。血样处理后8 h内样品能保持较好稳定性,血样处理后3次循环冻融能保持较好稳定性。血样处理后于-20 ℃条件下冻存能够保持稳定2个月,标准溶液有效保存期同样为2个月。本研究建立的特比萘芬血样浓度测定方法有较高的准确度和灵敏度,适用于候选化合物的体内药代动力学研究。
特比萘芬;血药浓度测定;稳定性;高效液相色谱法
盐酸特比萘芬是第二代丙烯胺类广谱抗真菌药,能够高选择性地抑制真菌细胞中的角鲨烯环氧化酶,抑制真菌细胞膜的形成,从而达到杀菌和抑菌的双重作用,尤其能够有效地对抗入侵角质化组织(如趾甲、毛发、皮肤)的丝状真菌[1],已在人医临床广泛应用,而在动物方面的研究较少。犬猫局部真菌感染的治疗通常倾向于口服药物,事实上,如果能够保证药物良好的渗透性与释放性,在局部给药能够达到更好的治疗效果[2]。在欧美,盐酸特比萘芬已经研制出了指甲油、乳膏剂、片剂等剂型,用以口服和局部使用[3]。目前国内外对盐酸特比萘芬在血浆中的检测方法正向着高选择性、高灵敏度及整体多功能性研究,高效液相色谱法由于可靠性和准确性受到了极大的关注[4]。本试验参照相关文献,建立了更稳定灵敏的特比萘芬血药浓度HPLC测定方法,并考察了该方法在各种条件下的稳定性,旨在为系统开展犬体内特比萘芬药代动力学研究奠定必要的方法学基础。
1 材料
1.1 仪器 Agilent 1260型高效液相色谱仪,包括Agilent G1311C四元泵带脱气机,G1330B柱温箱,G1315D检测器及手动进样器,Agilent OpenLAB CDS化学工作站,Agilent公司;色谱柱Agilent 5 HC-C18(2)(250×4.6 mm,5 μm),Agilent公司;UPH-11-20T型优普超纯水制造系统,成都超纯科技有限公司;N-EVAPTM112型干浴氮吹仪,美国Organomation公司;电子分析水平,感量0.0001 g,德国塞多利斯天平公司;PB-10型PH计,德国塞多利斯天平公司;KS-250D超声仪,宁波科生仪器厂;WH-1微型漩涡混合仪,上海沪西分析仪器厂有限公司;5810-R型高速冷冻离心机,德国eppendorf股份公司。
1.2 药品与试剂 甲醇为色谱纯,购自美国TEDIA公司,磷酸为色谱纯,购自德国CNW公司,乙腈、异丙醇为色谱纯,购自国药集团化学试剂有限公司。盐酸特比萘芬对照品购自中国兽医药品监察所,纯度99.8%,批号100563-201402。
1.3 动物 成年健康比格犬,体重12 kg,购自四方动物科技有限公司。
2 方法
2.1 溶液的配制
2.1.1 对照品的配制 精密称取盐酸特比萘芬对照品(0.0280±0.0001) g,用甲醇溶解并定容于50 mL容量瓶中,配成500 μg/mL的特比萘芬储备液,-20 ℃冻存。
2.1.2 提取剂的配制 将色谱纯乙腈和异丙醇按40∶60(V/V)的比例混匀,用磷酸调pH至3.0,现配现用。
2.2 色谱条件 色谱柱:Agilent 5 HC-C18(2)(250×4.6 mm,5 μm);流动相:甲醇-0.1%磷酸水(59∶41,V/V);流速0.8 mL/min;柱温35 ℃;进样量20 μL;紫外检测波长:λ=223 nm。
2.3 血浆样品处理 准确吸取室温下冻融后的血浆样品200 μL置于2 mL指形管中,加入1 mL提取液涡旋振荡3 min后,离心20 min(4 ℃,12000 r/min),将上清液移至5 mL指形管中。残渣加1 mL提取液涡旋振荡3 min,离心20 min(4 ℃,12000 r/min),合并上清液。取上清液于40 ℃干浴氮气吹干,用200 μL流动相复溶吹干残渣,涡旋振荡5 min。将复溶后的溶液移至2 mL指形管内,离心20 min(4 ℃,12000 r/min),取上清液经0.22 μm滤膜过滤,滤液供HPLC分析。
3 结果与分析
3.1 标准曲线及线性范围 分别配制特比萘芬质量浓度为0.02,0.05,0.10,0.50,1.00,2.50,5.00 μg/mL的血浆样品,按2.3项血浆样品处理方法处理后,进行HPLC分析。采用外标法计算,以特比萘芬峰面积(As)对血药浓度(C)进行线性回归,
得回归方程:As= 356.28C-2.0311(r2= 0.99989)。表明特比萘芬于本方法在0.02~5.00 μg/mL线性关系良好。血浆最低检测浓度为0.01 μg/mL(S/N≥3),定量限浓度为0.02 μg/mL(S/N≥10)。标准曲线如图1所示。

图1 特比萘芬标准曲线图
3.2 精密度和准确度 分别平行配制低、中、高3个浓度,分别为0.02,1.00,5.00 μg/mL血浆质控各5份,同日萃取测定,计算日内RSD分别为4.699%,1.348%,2.892%;在5个不同日进行萃取测定,计算得日间RSD分别为6.598%,6.482%,3.564%,结果见表1所示。

表1 特比萘芬血浆浓度HPLC方法的精密度和准确度(n=5)
注:n:样本数;RSD:变异系数
3.3 回收率 分别平行配制低、中、高3个浓度,分别为0.02,1.00,5.00 μg/mL血浆质控各5份,同日萃取测定,计算得方法平均相对回收率分别为108.866%,100.406%,102.120%,结果见表2所示。

表2 血浆中空白添加特比萘芬HPLC方法的相对回收率(%)(n=5)
注:RSD:变异系数;a:基于检出的平均浓度进行计算
3.4 稳定性
3.4.1 室温放置下的稳定性 制备浓度为0.1,1.0,5.0 μg/mL的5个空白血浆添加平行样品,立刻对样品进行分析,得到第0时数据,之后在室温(约22 ℃)下分别放置2、6、8 h后进行样品分析。通过与0时测定的数据比较,考察室温下放置时血样中特比萘芬的稳定性。计算得8 h 的RSD分别为3.471%,3.729%,3.967%,结果见表3所示。表明在本试验建立的处理方法下,样品中特比萘芬在室温条件下(+22 ℃)能够保持稳定达8 h。
表3 室温放置8 h后犬血浆中特比萘芬测定的稳定性

储存时间(温度)加标浓度/(μg·mL-1)检出的平均浓度/(μg·mL-1)RSD/%样本数n检出加标浓度回收率/%a0h0.10.1043.5805104.11.00.9892.201598.95.05.2823.9735105.62h(室温,+22℃)0.10.1011.6035100.81.00.9975.073599.75.05.2454.0985104.96h(室温,+22℃)0.10.1032.8855103.01.00.9992.483599.95.05.2002.8795104.08h(室温,+22℃)0.10.1053.4715104.81.00.9793.729597.95.05.1183.9675102.4
注:RSD为变异系数; a: 基于检出的平均浓度进行计算
3.4.2 冻融稳定性考察 制备浓度为0.1,1.0,5.0 μg/mL的5个空白血浆添加平行样品,立刻对样品进行分析,得到第0时数据。在-20 ℃下至少储存1 d后取出解冻,之后再次冷冻、解冻,反复共进行3次冻融循环处理。两次冻融间隔时间至少为5 h。通过与0时测定的数据比较考察反复冻融下血样中特比萘芬的稳定性。计算得最终浓度RSD分别为4.999%,2.215%,0.561%,结果见表4所示。表明特比萘芬样品在三个冻融循环后,仍然保持稳定。
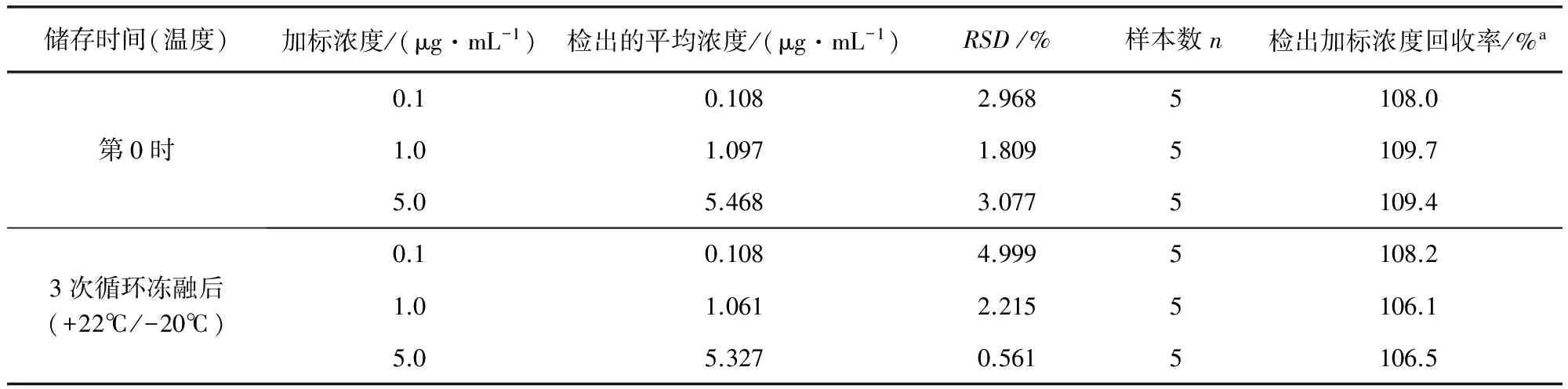
表4 三个冻融循环后犬血浆中特比萘芬测定的稳定性
注:RSD:变异系数;a:基于检出的平均浓度进行计算
3.4.3 样品存储期间的稳定性 制备浓度为0.1,1.0,5.0 μg/mL的5个空白血浆添加平行样品,立刻对样品进行分析,得到第0时数据。之后分别于冻存(约-20 ℃)1周和2个月后进行样品分析。通过与0时测定的数据比较考察样品贮存期间的稳定性。计算得2个月浓度RSD分别为9.697%,1.360%,3.601%,结果见表5所示。表明特比萘芬样品在-20 ℃条件下冻存,可保持稳定达2个月。
3.4.4 储备液的稳定性 制备2 mL浓度为0.1,1.0,5.0 μg/mL的标准液,立刻对样品进行分析,每个浓度重复5次,得到第0时数据。之后分别于冻存(约-20 ℃)1个月和2个月后进行样品分析。通过与0时测定的数据比较考察储备液贮存期间的稳定性。2个月浓度RSD分别为1.514%,3.097%,1.809%,结果见表6所示。表明特比萘芬储备液稀释后的标准溶液,在-20 ℃条件下冻存可保持2个月稳定。

表5 -20 ℃条件下冻存后血浆中特比萘芬测定的稳定性
注:RSD:变异系数;a:基于检出的平均浓度进行计算

表6 -20 ℃条件下冻存后储备液中特比萘芬测定的稳定性
注:RSD:变异系数;a:基于检出的平均浓度进行计算
3.5 分离效果 由特比萘芬对照品、空白添加样品、空白血浆色谱峰的分离图谱可知,特比萘芬的色谱峰分离效果良好,空白血清及其他杂质对其无影响,保留时间为14.1 min左右(图2 ~ 图6)。

图2 特比萘芬(0.02 μg/mL)对照品色谱图

图3 空白血浆添加特比萘芬标准品(0.02 μg/mL)对照品色谱图

图4 特比萘芬(1 μg/mL)对照品色谱图

图5 空白血浆添加特比萘芬标准品(1 μg/mL)对照品色谱图

图6 空白血浆色谱图

图7 特比萘芬紫外全波长扫描图
4 讨论与小结
本试验对特比萘芬血药浓度测定方法进行了大量的研究。在色谱条件方面,用安捷伦1260进行DAD全波长扫描,发现在223 nm紫外检测波长处有最大吸收,其他波段吸收皆较低(图7)。通过参考文献发现特比萘芬在较强的无机酸性环境下溶解性及稳定性较好[5],经多次尝试,最终流动相选用甲醇-0.1%磷酸水;而用乙腈-0.1%磷酸水,则无法经该色谱设备检测到。由于紫外检测波长较低,杂质峰较多,多次调试发现当流动相比例为甲醇-0.1%磷酸(59∶41,V/V)时,出峰时间为14.1 min,能够在图谱上呈现较好的峰形,并能与其他杂质峰分离开。当柱温为室温或者30 ℃时,发现药物峰有前沿峰,经试验调试,当柱温升为35 ℃时,前沿峰消失。考虑缓冲剂因素时[6-8],试验中发现加入磷酸二氢钾或乙酸铵等缓冲液时,均会造成增加较多杂质峰,故流动相未添加缓冲液。
在提取方法中,试验先后用1 mL纯正己烷、甲醇、乙腈、异丙醇三种方法进行两次重复萃取药物,发现正己烷组回收率不足10%,甲醇组回收率不足15%,乙腈组为25%左右,异丙醇组为58%~65%,乙腈组和异丙醇组增大剂量均未见回收率明显提高,正己烷组剂量增大至4 mL时,重复提取两次回收率在20%左右。有大量研究在对血样进行处理时主要使用正己烷[9-11],本试验发现药物在正己烷中的回收率低于甲醇,低于乙腈,低于异丙醇,并且与其他提取剂混合后没有明显更高效果,故提取剂中未添加正己烷。参考文献[12-13],试验设计了用磷酸将提取剂酸化和萃取后加入磷酸酸化萃取液两种方案,试验发现两种方案三组回收率均达85%以上,分析特比萘芬在酸性条件下能够被HPLC稳定测出,但是酸性条件并不能提高萃取率。考虑到检测的便捷性,最终选用酸化提取剂方法对样品进行药物提取。有些报道[14]通过加入大量盐酸进行酸化,考虑到盐酸量过多不易被氮气吹干,会增加检测周期,故未选用。为进一步提高药物回收率及检测的精确度,试验尝试酸化混合提取剂进行药物提取,最终选用提取剂乙腈-异丙醇(40∶60,V/V)(用磷酸调pH至3.0)的提取剂,能够极大的提高药物的回收率。
在稳定性研究方面,特比萘芬血样处理前于-20 ℃冰箱避光保存2个月能保持相对稳定,经处理后室温下血样在8 h内保持相对稳定。血样经反复冻融后,特比萘芬也能保持相对稳定性;标准溶液在-20 ℃冰箱避光保存2个月无明显变化。
在本试验所建立的HPLC条件下,待测药物特比萘芬峰形良好,出峰时间为14.1 min左右,在223 nm处有最大紫外吸收峰,并且能够准确定量。空白血浆添加不同浓度的特比萘芬在0.02~5.00 μg/mL范围内回收率在95%~110%之间,批内和批间变异系数分别小于5%和7%,方法的检测限和定量限分别为0.01 μg/mL和0.02 μg/mL。特比萘芬在0.02~5.00 μg/mL浓度范围内,药物浓度与检测器响应值之间相关性良好(r2= 0.99989)。本试验所建立的反相高效液相色谱-紫外检测法,分析成本低,操作便捷,方法的灵敏度、准确性和重现性均能满足特比萘芬血药浓度检测的需求,能够为进一步的特比萘芬药动学研究和生物利用度研究提供依据。
[1] Peter M, Iva V, Emil H. Determination of terbinafine in pharmaceuticals and dialyzates by capillary electrophoresis[J]. Talanta, 2005, 65(4):1031-1037.
[2] Alberti I, Kalia Y N, Naik A,etal. Effect of ethanol and isopropyl myristate on the availability of topical terbinafine in human stratum corneum, in vivo.[J]. International Journal of Pharmaceutics, 2001, 219(1/2):11-19.
[3] Felix F S, Ferreira L M C, Rossini P D O,etal. Quantification of terbinafine in pharmaceutical tablets using capillary electrophoresis with contactless conductivity detection and batch injection analysis with amperometric detection[J]. Talanta, 2012, 101(22):220-225.
[4] Cardoso S G, Schapoval E E S. High-performance liquid chromatographic assay of terbinafine hydrochloride in tablets and creams.[J]. Journal of Pharmaceutical & Biomedical Analysis, 1999, 19(5):809-812.
[5] Dukes M N G, Aronson J K. Meyler's side effects of drugs: the international encyclopedia of adverse drug reactions and interactions(fifteenth edition)[J]. Rittenhouse, 2006:3316-3322.
[6] 王昂, 丁焕中, 高艳,等. 盐酸特比萘芬胶囊在比格犬体内的药物动力学及生物利用度研究[J]. 华南农业大学学报, 2012, 4:556-560.
[7] 欧阳冬生, 史卉妍, 谭志荣,等. 盐酸特比萘芬片的人体生物等效性研究[J]. 中国新药杂志, 2008, 14:1261-1263.
[8] 罗世英, 陈华萍. 高效液相色谱法测定克霉舒搽剂中盐酸特比萘芬含量[J]. 中国医院药学杂志, 2006, 3(3):353-355.
[9] 陈红, 孙艳伏, 蔡丽伟,等. 盐酸特比萘芬片在健康人体中的相对生物利用度及生物等效性试验[J]. 中国新药杂志, 2012, 21(9): 1016-1019.
[10]王灵杰, 王娜, 田媛,等. 盐酸特比萘芬片人体药动学和生物等效性研究[J]. 中国现代应用药学, 2008, 3:217-220.
[11]张洛, 陈新, 刘利锋,等. 犬口服盐酸特比萘芬片的生物利用度研究[J]. 江苏农业科学, 2011, 5:306-308.
[12]L. Matysova, P. Solich, P. Marek,etal. Separation and determination of terbinafine and its four impurities of similar structure using simple RP-HPLC method[J]. Talanta, 2006,(3):713-720.
[13]丁莉坤, 杨静, 陈苏宁,等. LC-MS/MS法测定人血浆中特比萘芬浓度及其生物等效性评价[J]. 中国药师, 2012, 8:1118-1121.
[14]龚志成. 人血浆中特比萘芬的HPLC测定及药动学[J]. 中国医药工业杂志, 2008, 8:603-605.
(编辑:侯向辉)
Development of HPLC Method for the Determination of Terbinafine in Dog Plasma
WANG Dong-liang1,2,NIE Qiao1,2,LI Yu-chen1,2,WU Tian-xing1,2,BU Shi-jin1,2*
(1.VeterinaryMedicineCollege,YangzhouUniversity,Yangzhou,Jiangsu225009,China; 2.JiangsuCo-innovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonoses,Yangzhou,Jiangsu225009,China)
To establish and improve a simple, rapid,sensitive and high selective high-performance liquid chromatographic (HPLC) method for the determination of terbinafine in canine plasma, and study the stability of terbinafine in different condition, The plasma sample containing terbinafine was extracted by the extracting of acetonitrile/isopropanol (phosphoric acid adjusting to pH 3.0, 40:60,V/V), and dried by nitrogen at 40 ℃, then dissolved in mobile phase and centrifuged, and 20 μL of the upper phase was injected into the sampler. The stability of the samples in different condition was studied. Separation was performed on a reversed-phase Agilent 5 HC-C18(2) column (250 mm×4.6 mm, 5 μm). The isocratic mobile phase was methyl alcohol and 0.1% phosphoric acid with the rate of (59:41,V/V), and the run rate was 1 mL·min-1. The detective UV wavelength was 223 nm and the column temperature was 35 ℃. The chromatography condition good and not interfered by the components of the plasma. The limit of quantity was 0.01 μg·mL-1. The HPLC method had a linearity over the range of 0.02 ~ 5 μg·mL-1. The linear equation was y=356.28x-2.0311(r2=0.99989). The intra-assay precision did not exceed 5% and inter-assay precision did not exceed 7% for low, medium, high quality samples, respectively. The average recovery of the described method was 108.9%, 100.4% and 102.1%, respectively. The samples in 8 h or 3 times of freezing and thawing cycles after processing can maintain good stability. The samples after processing and the standard solution of terbinafine were stabilized for 2 months. A sensitive and accurate method for determining terbinafine has been established, which may be used in futureinvivopharmacokinetic studies of this antifungal drug.
terbinafine; determination of plasma concentration; stability:HPLC
江苏高校优势学科建设工程(PAPD)
王东亮,硕士,从事兽医药理及毒理学研究。
卜仕金。E-mail:pushijin@aliyun.com
2016-04-24
A
1002-1280 (2016) 07-0034-07
S859.83

