一种快速测定灵芝孢子粉抗氧化性的方法
钟亚平,刘潇,何瑜,葛伊利,宋功武
(有机功能分子合成与应用教育部重点实验室(湖北大学),
有机化工新材料湖北省协同创新中心(湖北大学),湖北 武汉 430062)
一种快速测定灵芝孢子粉抗氧化性的方法
钟亚平,刘潇,何瑜,葛伊利,宋功武
(有机功能分子合成与应用教育部重点实验室(湖北大学),
有机化工新材料湖北省协同创新中心(湖北大学),湖北 武汉 430062)
摘要:采用紫外分光光度法,以Fenton反应为基础,建立灵芝孢子粉抗氧化性快速准确测定的新方法.以水杨酸与Fenton 反应产生的羟基自由基反应生成的二羟基苯甲酸在530 nm处有最大吸收的原理,确立最佳反应条件.在此条件下,以抗坏血酸作为羟基自由基的清除剂,获得了标准曲线和标准对照图,为灵芝孢子粉抗氧性的快速检测提供了标准思路.在此最佳条件下,采用超声波提取法对灵芝孢子粉进行多糖的提取,将多糖提取液或者灵芝孢子粉颗粒加入反应体系中,反应后测其在530 nm 处的吸光度,即可快速获知其抗氧化性.同时,比较了破壁和未破壁孢子粉提取液和孢子粉颗粒的抗氧化性差异,结果表明破壁后的抗氧化性较未破壁高10%.证明此快速测定方法的实用性.本方法操作简单,所用试剂均无毒副作用,为灵芝孢子粉抗氧化性的快速测定提供一个较快速且准确的方法.
关键词:灵芝孢子粉;抗氧化性;分光光度法;Fenton 反应
0引言
灵芝为担子菌纲多孔菌科,属真菌,作为中国传统的珍贵药材,有很高的药用价值.灵芝孢子是灵芝生长成熟期从菌盖弹射出来的极其细小的颗粒.它是灵芝的生殖细胞,具有灵芝的全部遗传活性物质,富含蛋白质和氨基酸类、糖肽类、三萜类[1]物质.科学研究表明,灵芝孢子粉具有保肝护肝[2-3]、抗肿瘤[4-6]、降血糖血脂[7-9]、免疫调节[9-11]、抗氧化[12]等多种药理作用.由于其丰富的化学成分和多种药理活性,灵芝孢子粉逐渐受到人们的重视,有关灵芝孢子粉的研究也越来越多,且主要集中于两个方向:一个是关于灵芝孢子粉破壁的方法技术,另一个方面是关于灵芝孢子粉的各种药理作用.
目前,灵芝子实体提取物的抗氧化活性已有部分研究[13-16],其中具备抗氧化能力的物质基本确定为水提多糖和醇提物等[17-18].从灵芝孢子粉中提取的活性物质也分为醇溶性和水溶性两种.醇溶性物质为灵芝孢子油,其中70%为脂肪酸,大部分是不饱和脂肪酸,三萜类物质占20%左右.三萜类物质因化学结构多样而具有广泛的生理活性.王杉等人研究菌草灵芝孢子油,测得孢子油中三萜类物质含量为30.25%,不饱和脂肪酸为61.15%[19].水溶性物质主要为多糖.鲍幸峰等人研究了破壁前后灵芝孢子粉多糖的提取,研究表明破壁比未破壁孢子的多糖释放能力强[20].然而灵芝孢子粉的抗氧化性研究涉及体外的抗氧化鲜有报道.
本文中采用分光光度法,对未破壁的灵芝孢子粉和超声法制备的破壁灵芝孢子粉的水提物进行了抗氧化研究.用Fenton反应来产生羟基自由基(·OH),以水杨酸作为羟基自由基(·OH)的捕捉剂,通过实验确定了反应体系的最佳条件:FeSO4溶液(0.018 mol/L)0.50 mL,水杨酸溶液(0.01 mol/L)2.00 mL,H2O2溶液(0.3%)0.50 mL,并以此作为筛选羟基自由基的有效方法.通过此方法获得的标准比色图可以用来快速检测灵芝孢子粉的抗氧化性,为灵芝孢子粉的应用提供理论参考.
1实验部分
1.1仪器与试剂DTC-8型超声波清洗机(鼎泰(湖北)生化科技设备制造有限公司);液质联用仪(美国Agilent);紫外分光光度计(美国Perkin-Elmer公司).30%过氧化氢(分析纯),抗坏血酸(分析纯),水杨酸(分析纯)和无水乙醇(分析纯)均为国药集团化学试剂有限公司生产,硫酸亚铁(分析纯)为沔阳化学试剂二厂生产,水为二次水.
1.2实验方法
1.2.1羟基自由基的测定向10 mL比色管中加入水杨酸溶液2.00 mL,FeSO4溶液0.50 mL,最后加入H2O2(0.3%)溶液0.50 mL,用水定容至10 mL,常温振荡混合5 min,在530 nm处测定其吸光度值.
1.2.2抗坏血酸对羟基自由基清除率的测定向10 mL比色管中加入一系列不同浓度的抗坏血酸溶液,加入FeSO4溶液0.50 mL,水杨酸溶液2.00 mL,最后加入H2O2溶液0.50 mL,用水定容至10 mL,常温振荡混合5 min,在530 nm处测定各自的吸光度值.自由基清除率公式为:
D=[(A0-AS)/A0]×100%,
式中,D为自由基清除率,A0为空白管的吸光度,AS为加入抗坏血酸或样品提取物后的吸光度.
1.2.3灵芝孢子粉多糖的提取分别准确称取灵芝未破壁孢子粉及破壁孢子粉3.0 g,以料液比1∶15加入蒸馏水45.0 g,在37 ℃下超声提取35 min[14],超声结束后将提取液进行离心,取上层清液进行浓缩,浓缩至10 mL.
1.2.4灵芝孢子粉对羟基自由基清除率的测定分别准确吸取灵芝孢子粉多糖提取液0.2、0.4、0.6、0.8、1.0、1.2 mL加入到1.2.1的反应体系中,充分振荡反应,测其吸光度.
准确称取灵芝未破壁孢子粉、破壁孢子粉0.02、0.04、0.06、0.08、0.10、0.12 g加入到1.2.1的反应体系中,常温振荡混合5 min,离心,取上层清液测其吸光度.
2结果与讨论
2.1机理探究Fenton反应是以过氧化氢为氧化剂,以Fe2+为催化剂的反应体系,其反应机理如下:
Fe2++H2O2——Fe3++OH-+·OH

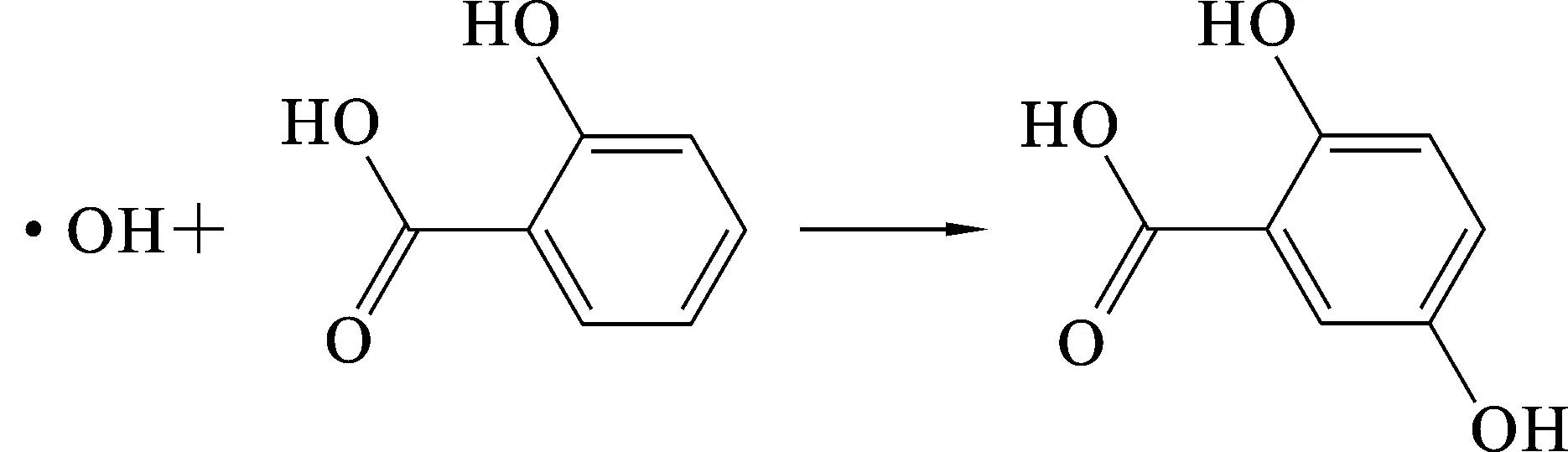
所产生的羟基自由基与水杨酸反应后生成的2,3-二羟基苯甲酸和2,5-二羟基苯甲酸显紫色,在530 nm处有吸收峰.当在体系中加入羟基自由基清除剂后,吸光度值降低,利用吸光度的差值便可快速计算出羟基自由基清除剂对自由基的清除率.
2.1.1吸收光谱我们测定了水杨酸-乙醇-水溶液在波长200~800 nm范围内的吸收光谱(如图1),还测定了反应体系在200~800 nm范围内的吸收光谱(如图2),结果表明反应体系在500~550 nm波长范围内有吸收,说明水杨酸捕捉羟基自由基反应后的产物在500~550 nm波长范围内有特征吸收,最大吸收波长为530 nm.
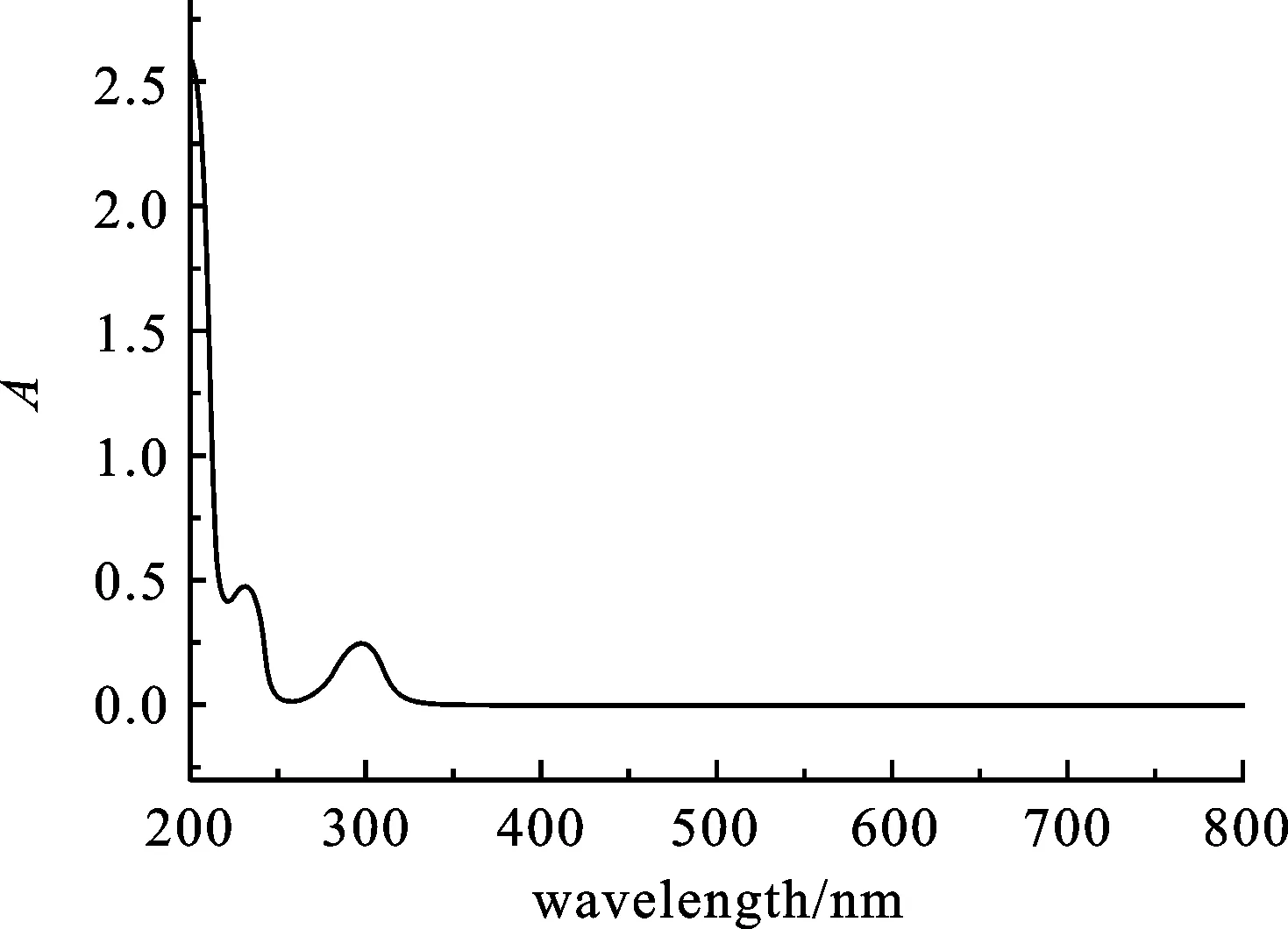
图1 水杨酸溶液的紫外吸收光谱

图2 反应体系的紫外吸收光谱
2.1.2飞行时间质谱我们对反应体系做了进一步的研究,测定了反应体系的质谱图(如图3所示),分析图3可知,在2.146 min 时,139.039 9处的峰归属于水杨酸,在8.027 min时,155.054 1处的峰归属于二羟基水杨酸,表明反应体系反应后生成了二羟基水杨酸,而二羟基水杨酸溶液显紫色,其紫外吸收光谱在530 nm 处有特征吸收峰,进而证明了此反应体系比较可靠.

图3 反应体系质谱
2.2FeSO4用量对体系吸光度的影响在1.2.1所述体系中,拟定水杨酸的用量为2.00 mL,其他反应条件不变,改变FeSO4的用量,其结果如图4所示.实验结果发现,随着FeSO4溶液用量的增加,体系的吸光度增大,当用量达到0.50 mL时,体系的吸光度值变化不大,因此确定FeSO4溶液的用量为0.50 mL.
2.3H2O2用量对体系吸光度的影响在2.2实验结果的基础上,确定了FeSO4溶液的用量为0.50 mL,其他反应条件不变,改变H2O2溶液的用量,其结果如图5所示.实验结果发现,随着H2O2溶液用量的增加,体系的吸光度增大,当用量达到0.50 mL时,体系的吸光度值变化不大,因此,确定了H2O2溶液的用量为0.50 mL.

图4 FeSO4浓度对体系吸光度的影
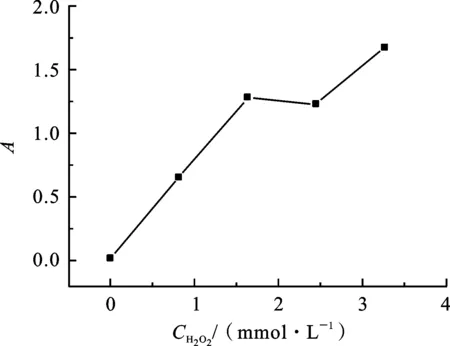
图5 H2O2浓度对体系吸光度的影
2.4稳定性实验根据实验已确定的体系中各溶液的用量,即FeSO4溶液为0.50 mL,水杨酸溶液为2.00 mL,H2O2溶液为0.50 mL,定容至10 mL,考查体系的稳定性,其结果如下表(表1),表中的数据表明,反应体系在60 min 内吸光度变化值很小,可见此方法稳定性较好.
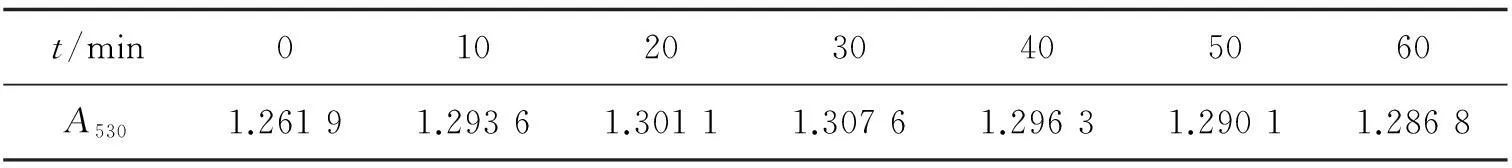
表1 稳定性实验结果
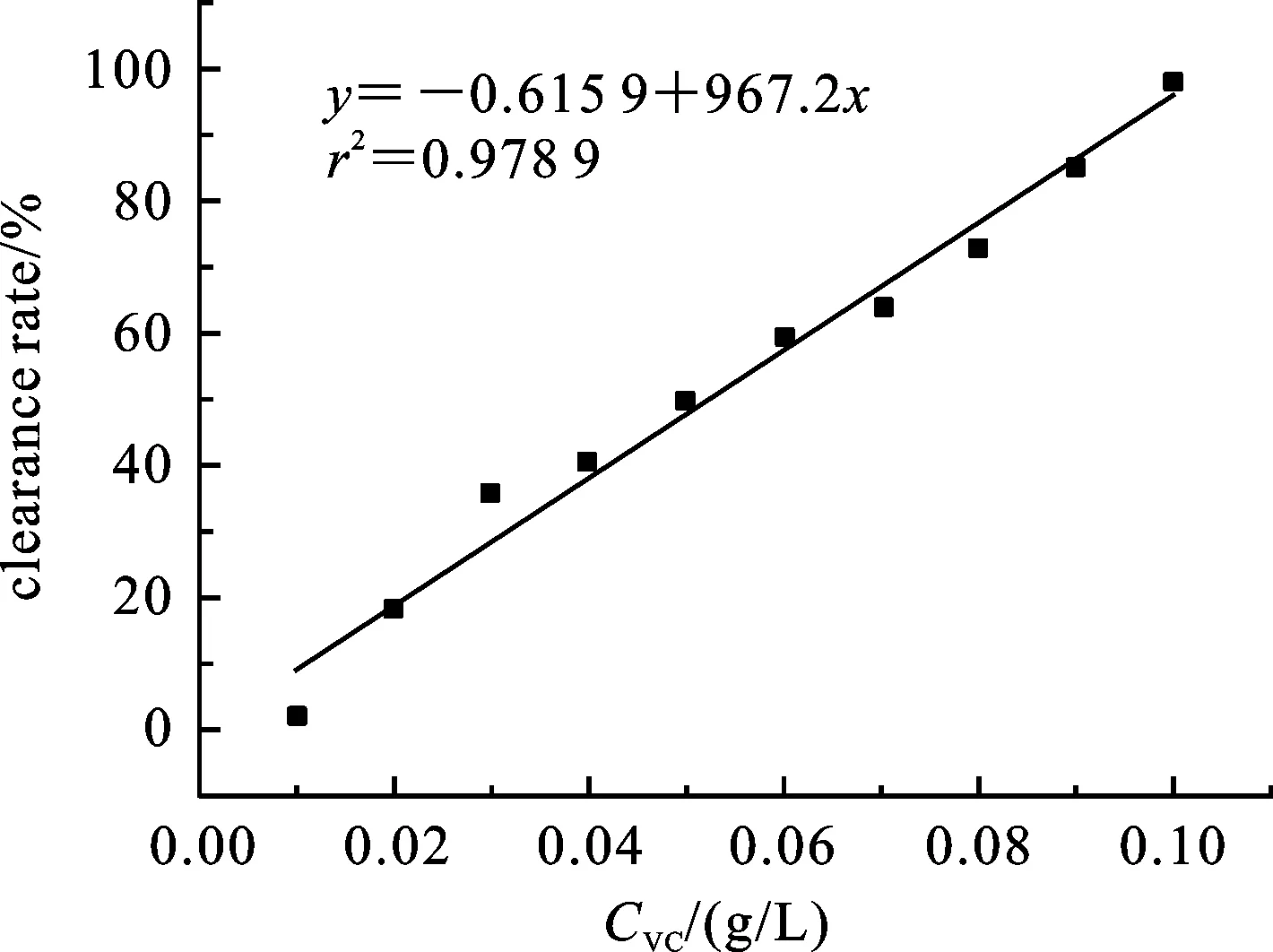
图6 不同浓度的抗坏血酸对羟基自由基的清除率
2.5抗坏血酸对羟基自由基的清除率在10 mL比色管中加入一系列不同浓度的抗坏血酸溶液,根据实验已经确定的体系中各试剂的用量,即加入FeSO4溶液0.50 mL,水杨酸溶液2.00 mL,最后加入0.50 mL H2O2溶液启动反应,常温振荡混合5 min,在530 nm处其吸光度值,计算其对羟基自由基的清除率如图6所示.由实验结果可知,抗坏血酸对羟基自由基的清除能力成明显的量效关系,即当抗坏血酸用量增加的时候,对羟基自由基的清除率也增加,且基本成线性.
对反应后的各溶液拍照,得到颜色渐变的一系列图片,将其按抗坏血酸溶液浓度由小到大从左到右排列得到如图7所示的标准比色图,此比色图可作为灵芝孢子粉抗氧性检测的标准对照,可用于快速对照(抗坏血酸的浓度从左右依次为0.01,0.02,0.03,0.04,0.05,0.06,0.07,0.08,0.09,0.10 g/L).

图7 不同浓度抗坏血酸对羟基自由基清除的标准化色
2.6灵芝孢子粉多糖提取液对羟基自由基的清除率分别准确移取灵芝未破壁孢子粉及灵芝破壁孢子粉多糖提取液0.2、0.4、0.6、0.8、1.0、1.2 mL加入到10 mL比色管中,根据实验已经确定的体系中各溶液的用量,再加入FeSO4溶液0.50 mL,水杨酸溶液2.00 mL,最后加入0.50 mL H2O2溶液启动反应,常温振荡混合5 min,在530 nm处测其吸光度值,计算其对羟基自由基的清除率如图8和图9所示.
由实验结果可知,灵芝未破壁孢子粉多糖提取液和灵芝破壁孢子粉多糖提取液对羟基自由基的清除能力成明显的量效关系,即当多糖提取液用量增加的时候,对羟基自由基的清除率也增加.且由图可知,灵芝破壁孢子粉多糖提取液对羟基自由基的清除率比未破壁孢子粉多糖提取液对羟基自由基的清除率在相同用量是高10% 左右.分析其原因应该是由于未破壁孢子粉的孢子壁在超声提取多糖的时候影响了多糖的产率,进而导致在进行羟基自由基清除的时候清除率相较破壁孢子粉多糖提取液较低.

图8 未破壁孢子粉提取液对羟基自由基的清除率
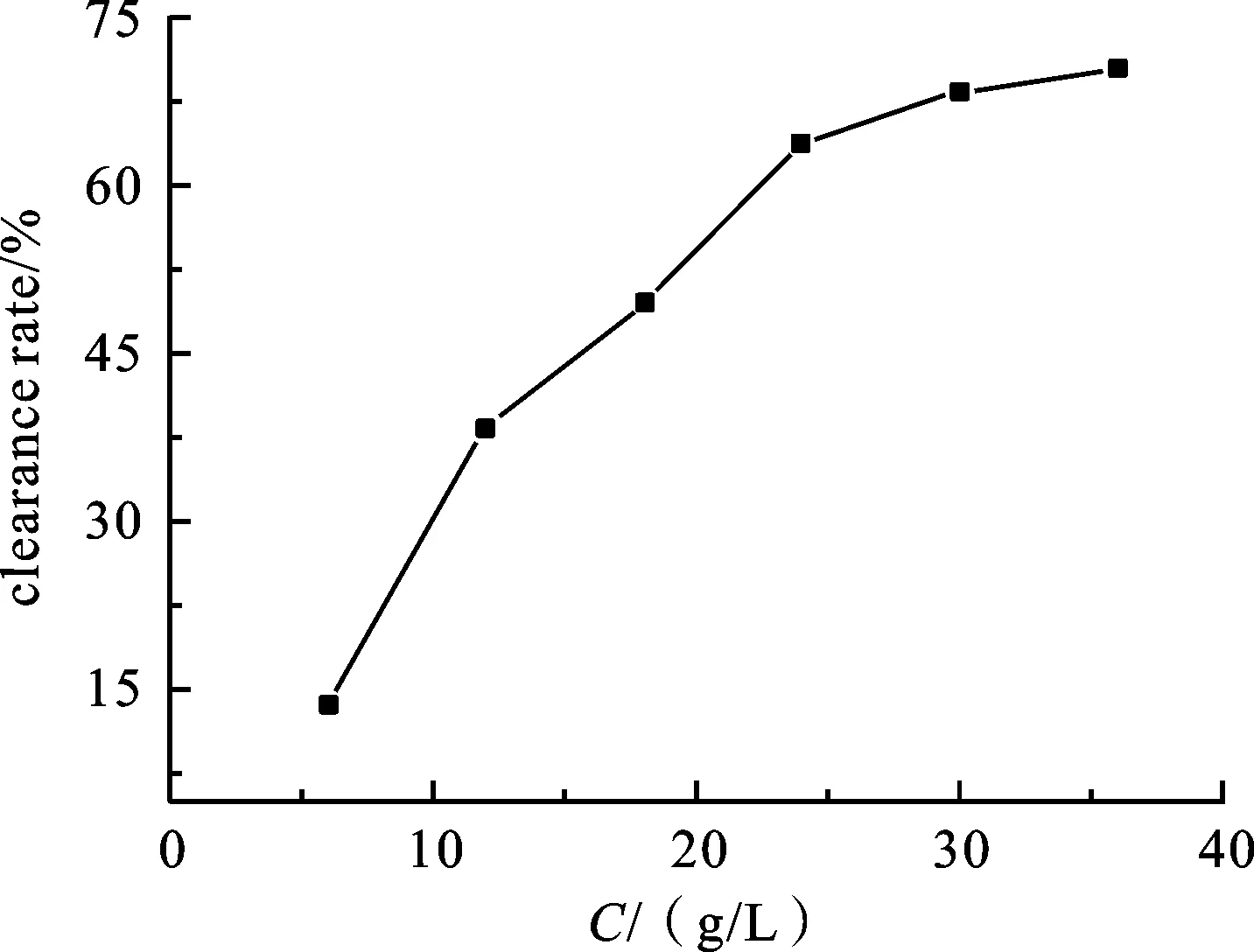
图9 破壁孢子粉提取液对羟基自由基的清除率
2.7灵芝孢子粉颗粒对羟基自由基的清除率分别准确称取灵芝未破壁孢子粉、破壁孢子粉0.02、0.04、0.06、0.08、0.10、0.12 g加入到10 mL比色管中,根据实验已经确定的体系中各溶液的用量,再加入FeSO4溶液0.50 mL,水杨酸溶液2.00 mL,最后加入0.50 mL H2O2溶液启动反应,充分振荡反应,离心,取上层清液在530 nm处测其吸光度,计算其对羟基自由基的清除率如图10和图11所示.
由实验结果可知,灵芝未破壁孢子粉和灵芝破壁孢子粉对羟基自由基的清除率同样呈现出量效的关系,破壁孢子粉对羟基自由基的清除率比未破壁孢子粉的清除率高10%左右.

图10 未破壁孢子粉对羟基自由基的清除率

图11 破壁孢子粉对羟基自由基的清除率
3结论
本文中采用分光光度法,以水杨酸作为Fenton 反应产生的羟基自由基的捕捉剂,确定了反应体系的最佳条件:FeSO4溶液(0.018 mol/L)0.50 mL,水杨酸溶液(0.01 mol/L)2.00 mL,H2O2溶液(0.3%)0.50 mL.在此基础上,以抗坏血酸作为羟基自由基的清除剂,获得了标准曲线和标准对照图,并对灵芝孢子粉抗氧化性作了评价,实验结果表明本方法简便快速,可以作为快速检测灵芝孢子粉抗氧化性的有效方法.同时本文还对未破壁灵芝孢子粉和破壁灵芝孢子粉,未破壁灵芝孢子粉提取液和破壁灵芝孢子粉提取液的抗氧化能力进行比较,结果表明破壁后较未破壁的抗氧化能力高10%.本文中对灵芝孢子粉抗氧化性能的探究为灵芝孢子粉的应用提供了理论参考.
参考文献4
[1] 赵东旭,杨新林,朱鹤孙,等.灵芝孢子研究进展[J].中草药,1999,30(4): 305-307.
[2] 杨丽丽,邓志钦,黄维渊,等.灵芝孢子粉对抗亚急性酒精肝损伤的实验研究[J].时珍国医国药,2013,24(3):513-514.
[3] 刘刚,雷立,张晓喻,等.赤灵芝及其孢子粉提取物缓解小鼠肝脏CCl4损伤的研究[J].西南师范大学学报:自然科学版,2009,34(5):117-120.
[4] 孙丽华,赵明耀,黄幼田,等.灵芝孢子粉对荷瘤小鼠树突状细胞的影响及其抗瘤效应[J].山西医药杂志,2006,35(8):698-700.
[5] 刘伟.灵芝孢子粉对Lewis肺癌小鼠腹腔巨噬细胞功能及血清IL-2的影响[J].现代中医药,2010,30(5):85-86.
[6] Liu R M,Li Y B,Liang X F,et al.Structurally related ganoderic acids induce apoptosis in human cervical cancer HeLa cells: Involvement of oxidative stress and antioxidant protective system[J].Chemi-co-Biological Interactions,2015,240: 134-144.
[7] 张亚光,董晓红,唐状,等.灵芝孢子粉对青春期糖尿病大鼠耐糖量和肠道菌群的影响[J].中华微生物学和免疫学杂志,2008,28(6):519-520.
[8] Chang C J,Lin C S,Lu C C,et al.Ganoderma lucidum reduces obesity in mice by modulating the composition of the gut microbiota[J].Nature Communications,2015(6): 7489.
[9] 宋柏捷,朱孝娟,魏丽娜.灵芝孢子粉对小鼠的免疫调节及抑瘤作用研究[J].哈尔滨医科大学报,2010,44(5):464-466.
[10] 彭亮,赵鹏,李彬,等.破壁灵芝孢子粉对小鼠免疫调节作用的实验研究[J].应用预防学,2011,17(4):241-243.
[11] Ubaidillah N N,Abdullah N,Sabaratnam V.Isolation of the intracellular and extracellular polysaccharides of Ganoderma neojaponicum (Imazeki) and characterization of their immunomodulatory properties[J].Electronic Journal of Biotechnology,2015,18(3):188-195.
[12] 盖玉红.灵芝多糖抗氧化活性研究[D].长春:吉林农业大学,2007:3-8.
[13] 王淑秋,李晓捷,姜志梅,等.灵芝孢子粉对癫痫大鼠脑组织细胞色素C、线粒体钙、HSP70和BDNF的影响[J].中国病理生理杂志,2011,27(6):1053-1058.
[14] 游育红,林志斌.灵芝多糖肽对小鼠巨噬细胞自由基的清除作用[J].中国临床药理学治疗学,2004,9(1):52-55.
[15] Smin T P,Maury D K,Devasagayam T P A,et al.Protection of radiation induced DNA and membrane damages by total triterpenes isolated from Ganoderma lucidum?(Fr.) P.Karst[J].Chemico-Biological Interactions,2015,233(25):1-7.
[16] Peng X R,Liu J Q,Wang C F,et al.Unusual prenylated phenols with antioxidant activities from Ganoderma cochlear[J].Food Chemistry,2015,171(15):251-257.
[17] Yi C,Xie M Y,Nie S P,et al.Purification,composition analysis and antioxidant activity of a polysac charide from the fruit ing bodies of Gano-derma atrum[J].Food Chemistry,2008,107(1):231-241.
[18] Mau J L,Tsai S Y,Tseng Y H,et al.Antioxidant properties of metha-nolic extracts form Ganoderma tsugae[J].Food Chemistry,2005,93(4): 641-649.
[19] 王杉,周科勤,范青生,等.超临界CO2萃取菌草灵芝孢子油中三萜类物质和脂肪酸的测定[J].食品与机械,2006,22: 74-76.
[20] 鲍幸峰,方积年.赤芝孢子粉破壁前后多糖释放能力比较研究[J].中国中药杂志,2001,26: 326-328.
(责任编辑胡小洋)
A rapid determination method for antioxidant capacity ofGanodermalucidumspore powder
ZHONG Yaping,LIU Xiao,HE Yu,GE Yili,SONG Gongwu
(Ministry-of-Education Key Laboratory for the Synthesis and Application of Organic Functional Molecules(Hubei
University),Materials Collaborative Innovation Center in Hubei Province(Hubei University),Wuhan 430062,China)
Abstract:A new method for the rapid determination of the antioxidant capacity of Ganoderma lucidum spore powder was established based on Fenton reaction through the ultraviolet spectrophotometric method.The optimum experimental conditions of the reaction was obtained through varying the concentration of each reactants to get the maximum identifiable absorption of the produced dihydroxybenzoic acid at 530 nm.The standard curve and standard color chart was obtained under the optimum experimental conditions by using ascorbic acid as the hydroxyl radical scavengers,and this provided a standard method for the rapid detection of the antioxidant capacity of ganoderma spore powder.We can rapidly get the antioxidant capacity through the measured absorbance at 530 nm by adding the polysaccharide extraction of the Ganoderma lucidum spore powder which produced by ultrasonic extraction of Ganoderma lucidum spore powder or directly adding the Ganoderma lucidum spore powder into the reaction system under the optimum experimental conditions.Furthermore,we compared the difference of antioxidant capacity between the Ganoderma lucidum spore powder/polysaccharide extraction and Reishi mushroom powder/polysaccharide extraction in the experiments,and the results showed that the antioxidant capacity of Reishi mushroom powder were 10% higher than that of Ganoderma lucidum spore powder which further validated the practicability of this method.This method was simple and all reagents used had no toxic side effect which provided a rapid and accurate determination method for antioxidant capacity of Ganoderma lucidum spore powder
Key words:Ganoderma lucidum spore powder,antioxidation capacity,spectrophotometry Fenton reaction
中图分类号:TB324.1
文献标志码:ADOI:10.3969/j.issn.1000-2375.2016.01.016
文章编号:1000-2375(2016)01-0085-06
通信作者
作者简介:钟亚平(1991-),女,硕士生;宋功武,,教授,E-mail:songgw@hubu.edu.cn
收稿日期:2015-06-12

