细菌群落组成对微囊藻水华分解过程的响应*
国家水体污染控制与治理科技重大专项(2012ZX07101-010)和淡水生态与生物技术国家重点实验室项目(2014FBZ02)联合资助.2015-02-11收稿;2015-04-20
收修改稿.谢丽娟(1990~),女,硕士研究生;E-mail:ncuskxielijuan@163.com。
谢丽娟1,2,余得昭1,2,曾 诚3,沈 宏1
细菌群落组成对微囊藻水华分解过程的响应*
*国家水体污染控制与治理科技重大专项(2012ZX07101-010)和淡水生态与生物技术国家重点实验室项目(2014FBZ02)联合资助.2015-02-11收稿;2015-04-20
收修改稿.谢丽娟(1990~),女,硕士研究生;E-mail:ncuskxielijuan@163.com。
谢丽娟1,2,余得昭1,2,曾诚3,沈宏1
(1:中国科学院水生生物研究所东湖湖泊生态系统试验站,武汉 430072)
(2:中国科学院大学,北京 100049)
(3:华中农业大学,武汉 430070)
摘要:为探究细菌群落组成对微囊藻水华腐败分解过程的响应,在太湖梅梁湾沿岸进行为期11d的原位围隔实验,模拟蓝藻水华聚集分解过程,并监测了此过程中水体环境因子和细菌群落组成.结果表明,水体理化因子和细菌群落组成在微囊藻水华分解的过程中发生了显著变化.冗余分析显示细菌的群落组成与水体氧化还原环境(溶解氧或氧化还原电位)、pH值、浮游植物生物量和营养盐浓度(总磷、硝态氮浓度)密切相关.研究还发现了某些与微囊藻水华分解密切相关的特殊细菌类群,其中隶属于黄杆菌科(拟杆菌门)的一个类群在微囊藻厌氧分解的阶段占据显著优势,其功能有待于进一步研究。
关键词:细菌群落组成;微囊藻水华;腐败分解;黄杆菌科;太湖
由于水体富营养化的加剧,蓝藻水华成为世界水体所面临的共同威胁[1-2].微囊藻是富营养化湖泊蓝藻水华常见优势属[3-4].微囊藻水华聚集腐烂会消耗水体中大量的氧气,恶化水质(如pH值下降、营养盐升高),引起水生生物死亡[2,5].蓝藻水华堆积腐败过程还会产生恶臭异味,甚至导致诱发黑臭水体“湖泛”的产生[6-7].这些不仅影响环境美观,还使水质安全面临新的威胁。
对微囊藻水华腐败过程中物质循环转化进行研究能帮助我们更好地应对微囊藻水华对水体造成的威胁.在富营养湖泊中,细菌,尤其是非自养细菌,在水体的物质循环和能量转化中起到至关重要的作用[8-10].因此,了解微囊藻水华腐败过程中细菌群落组成的响应能为我们进一步了解其在湖泊物质循环中的作用提供理论基础.有研究运用原位围隔,向其中添加蓝藻,模拟蓝藻水华的发生,并研究围隔中真核微生物群落和细菌群落短期内对蓝藻腐败分解过程的响应[5,11].Shao等[12]利用围隔实验研究了附着细菌群落对微囊藻水华降解的响应.尽管相关研究证实微囊藻水华会显著影响水体微生物的组成[13-15],但是仍然缺乏对微囊藻分解完整过程中细菌群落组成特征的研究。
太湖是我国典型的富营养化浅水湖泊,每年夏季都暴发严重的微囊藻水华[16].大量蓝藻水华在东南季风或者水生植物阻留的情况下在西部或北部岸边发生聚集腐败[16].在太湖梅梁湾设置原位围隔,通过添加大量微囊藻模拟蓝藻聚集腐败的过程,进而研究细菌群落组成对蓝藻聚集腐败的的响应和此过程中特殊细菌类群的变化。
1 材料与方法
1.1 实验设计
于2013年8月21-31日在太湖梅梁湾沿岸进行原位围隔实验.实验期间天气情况为:8月21-25日有断续小雨,微风;8月26日大雨;8月27-31日晴,微风.共设6个围隔(2.0m×2.5m),位于梅梁湾沿岸,平均水深0.8m.实验前一天从梅梁湖孟湾藻水分离站收集微囊藻浆.8月21日进行围隔水体本底理化指标测定(第0d),8月22日向围隔中添加微囊藻,添加后立即进行现场指标测定和样品采集.实验共设2个处理,C组(对照组)围隔不添加藻浆,H组(实验组)添加藻浆后叶绿素a(Chl.a)浓度达378μg/L,每组设置3个平行,实验持续10d。
1.2 生物样品采集
实验期间每天采样监测(其中,第5d即8月26日,因下大雨未采样),水样取自表层水以下0.5m.100~200ml水样先经5μm孔径滤膜(47mm直径,Millipore,Germany)过滤,然后过滤于0.2μm孔径滤膜上,分别收集浮游细菌与附着细菌.滤膜保存于-80℃冰箱直至分析使用.采集1L水样用1%鲁哥试剂固定,用于浮游植物定性定量分析。
1.3 理化指标测定

1.4 浮游植物鉴定及计数
浮游植物样品沉淀48h后,吸取上清液,浓缩至50ml保存.鉴定前,充分摇匀,取0.1ml至计数框,在10×40倍视野下进行种类鉴定和计数.微囊藻群体经超声分离成单细胞后再计数.浮游植物种类的鉴定主要参照文献[18],浮游植物生物量采用体积法进行估算,假定1mm3的浮游植物体积相当于1mg浮游植物鲜重。
1.5 细菌群落结构分析
1.5.1 DNA提取及PCR扩增方法参照细菌提取试剂盒(Omega,USA)的标准程序提取细菌的基因组DNA,之后使用带40 bp GC夹的细菌特异性引物357F(5’-CCTACGGGAGGCAGCAG-3’)和通用引物518R(5’-ATTACCGCGGCTGCTGG-3’)[19]扩增模板DNA.采用50μl PCR体系,降落PCR方法,程序如下:94℃预变性5min;94℃变性1min,65℃退火1min,然后每个循环降低1℃进行10个循环;72℃延伸1min;55℃退火进行20个循环,72℃延伸10min.用1.2%的琼脂糖凝胶电泳检测PCR产物量及扩增特异性。
1.5.2 DGGE及克隆测序基因组DNA扩增产物通过DGGE(Dcode system,BioRad)进行变性梯度凝胶电泳(8%(w/v)聚丙烯酰胺凝胶(丙烯酰胺∶双丙烯酰胺=37.5∶1)),分析微生物群落多样性.聚丙烯酰胺的变性梯度范围为40%~60%,缓冲液为1×TAE,电泳参数为:60℃,150V,7h.电泳结束后用核酸染料GelRed(用1×TAE进行1∶10000稀释)避光染色30min,然后用UV成像系统(Gene,Hongkong)成像、拍照。
对感兴趣的条带进行切胶测序.首先切胶回收DNA,以此为模板使用不带GC夹的引物进行扩增,采用纯化试剂盒(Omega,USA)对PCR产物进行纯化回收,之后连接到pMD18-T载体(Takara,Japan)质粒上.连接产物转化入感受态DH5α大肠杆菌,之后挑选阳性克隆进行测序.利用BLAST和FASTA进行序列信息比对.本研究得到的序列提交至DDBJ,序列号为LC018357~LC018398。
1.6 统计分析
DGGE图谱聚类分析使用NTSYS软件(版本2.10.e).通过记下每个条带的有无(分别标记为1和0)建立二元矩阵.样本之间的相似性系数计算公式为:SD=(2NAB)/(NA+NB),其中NAB代表样本A和B的公共条带数,NA和NB分别代表样本A和B的条带数.根据相似性系数,利用非加权组平均法(UPGMA)构建系统树图(SHAN法则)。
软件CANOCO 4.5(Microcomputer,Ithaca,New York,USA)用来分析细菌群落组成与环境变量的关系.当趋势对应分析(DCA)的第1长轴<2时,采用冗余分析(RDA);当第1长轴>2时,采用典范对应分析(CCA)[20-21].采用蒙特卡罗置换检验筛选与细菌群落组呈显著相关的环境变量。
环境变量的统计分析均使用SPSS软件(版本13.0),显著水平设定为0.05(P<0.05)。
2 结果与分析
2.1 环境变量分析

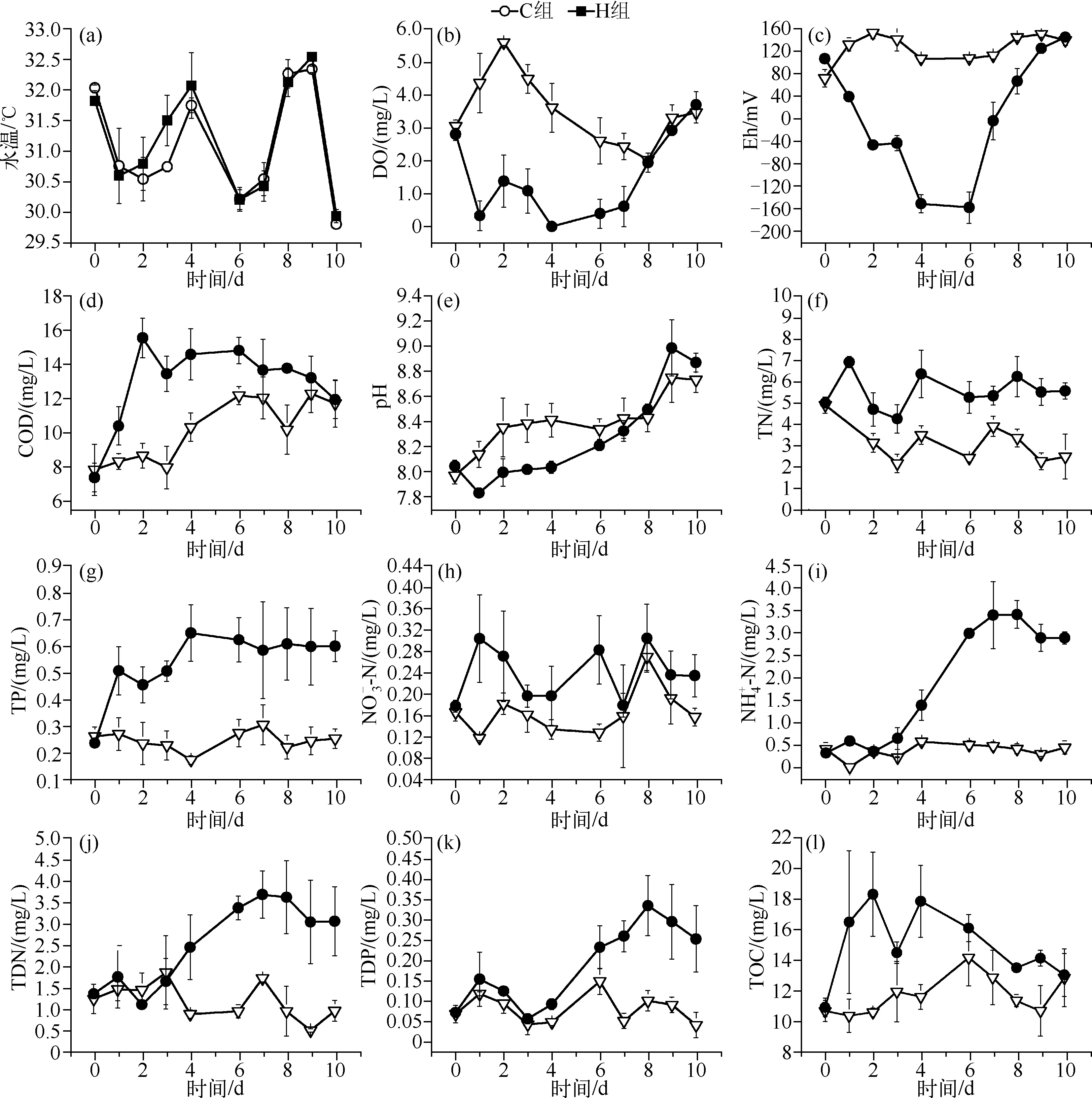
图1 实验期间主要环境因子的变化Fig.1 Temporal variations in the main environmental factors during the course of experiment
2.2 浮游植物生物量的变化
在第1d添加微囊藻后,H组围隔浮游植物生物量达到60.84mg/L,Chl.a浓度达到378.1μg/L,其中微囊藻生物量为58.58mg/L,占浮游植物总生物量的95.7%,H组围隔中微囊藻生物量相当于严重水华水平(图2).H组在添加微囊藻后,1~5d内浮游植物生物量不断下降,第6d直到实验结束,H组围隔的藻类生物量与C组无显著差异(图2a),微囊藻生物量的变化规律相似(图2b);而H组围隔Chl.a浓度则在添加藻后的第2d就迅速下降到与对照组相近的水平(图2c),这表明H组围隔中的微囊藻在1~4d发生快速厌氧死亡。
2.3 细菌群落组成分析
DGGE图谱显示了两组围隔中浮游细菌与附着细菌群落组成的变化(图3a、b).聚类分析结果(图3c、d)显示,浮游细菌的群落组成可聚为两大类:其中C组所有样品与添加微囊藻前和刚添加微囊藻后的H0和H1聚为一大类,而剩下的H组样品聚为另一大类.其中H2单独聚为一类,H3和H4聚为一类,第5d之后的样品(H6~H10)聚为一类;而C组中0~6d的样品与H0和H1聚为一类,7~10d的样品聚为一类(图3c).附着细菌的群落组成可聚为4类:H组添加微囊藻之前的样品H0与C组0~4d的样品(C0~C4)聚为一类,C组6~10 d的样品与H组7~10 d的样品聚为一类,H组中添加微囊藻后1~6 d的样品聚为一类(图3d)。

图2 浮游植物生物量(a)、微囊藻生物量(b)和Chl.a浓度(c)随时间的变化Fig.2 Temporal variations in biomass of phytoplankton (a), biomass of Microcystis spp.(b) and Chl.a concentration (c)


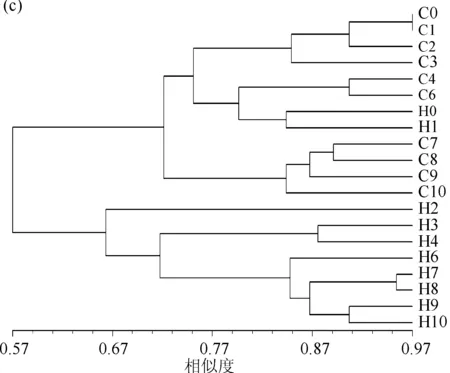

图3 DGGE图谱:浮游细菌群落(a)和附着细菌群落(b);UPGMA聚类分析结果:
图3a和图3b所示编号为已进行回收测序的条带,与条带序列同源性最高的序列信息列于右侧.在浮游细菌群落中,H组出现多个隶属于黄杆菌科(Flavobacteriaceae)(拟杆菌门)的条带(条带2、3、4、6),且明显占优势地位,而这些条带未在C组中出现.特别是条带4(隶属于黄杆菌科,与培养类群Cloacibacteriumnor-manense的相似度为100%),在H组添加微囊藻后第2~10d的样品中均占显著优势.与条带4隶属于相同属的分类单元条带3出现在H1中,条带2出现在H组2~10d的样品中,隶属于黄杆菌属Flavobacterium(相似度99%),而隶属于同一属的条带6(与培养类群Flavobacteriumcucumis(T)的相似度为100%)在H组1~2d的样品中占据优势地位.而在H组2~3d的样品中占明显优势的分类单元条带5隶属于β-变形菌门(Betaproteobacteria).而放线菌门(Actinobacteria)是C组样品中的一个重要门类,在C组样品中占明显优势,如条带8、13、21.在附着细菌群落中,所测条带序列有一半隶属于蓝藻门,由于本研究的重点关注细菌,蓝藻序列在此不做讨论.在附着细菌中,我们发现,条带3与浮游细菌群落中条带4序列相同(与Cloacibacteriumnormanense的相似度为100%),且在H组第2~4d的样品中占绝对优势。

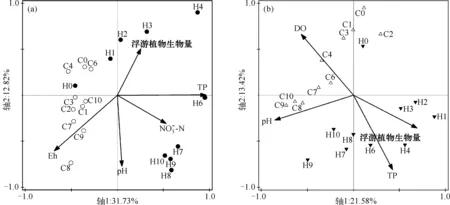
图4 基于DGGE和环境变量的RDA分析结果:浮游细菌群落(a);附着细菌群落(b)Fig.4 Biplots diagram of the redundancy analysis (RDA) on free-living bacterial community (a), particle-attached bacterial community (b) (DGGE profiles of 16S rRNA genes) constrained by environmental variables
3 讨论
3.1 微囊藻水华对水体环境的影响
有研究表明,当水体中出现蓝藻水华堆积时,其厌氧分解过程便占主导地位,耗竭水体中的氧气,危害其他生物生存[16].而微生物厌氧分解蓝藻的过程会产生大量有机酸和CO2,使水体pH值降低[5].蓝藻细胞内的N、P伴随着其厌氧分解大量释放到水中[22],从本研究中可看出,整个实验期间H组的TN、TP浓度都显著高于对照组,至厌氧蓝藻分解后仍持续维持较高的水平,此结果说明水体富营养化与蓝藻水华暴发之间的物质循环过程是值得关注的科学问题。
3.2 细菌群落组成对蓝藻水华分解的响应

3.3 微囊藻水华分解过程中影响细菌群落组成的重要理化因子
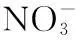
3.4 参与微囊藻水华分解过程的重要细菌群落
目前,有多个细菌类群被认为与微囊藻水华分解有关.Li等[11]通过蓝藻堆积的围隔模拟实验研究细菌的早期响应,发现微球菌亚目可能与微囊藻降解有关.Xing等[35]在室内实验中发现梭菌属类群在微囊藻的厌氧分解中起着重要作用.而在本研究中最引起关注的是隶属于黄杆菌科(拟杆菌门)的一个类群(浮游细菌条带4和附着细菌条带3,与培养类群Cloacibacteriunormanense的相似度为100%),这个类群在微囊藻厌氧分解阶断占显著优势.通过同源性比对发现,与其相似性100%的类群多出现在污水或厌氧污泥中,而Cloacibacteriumnormanense最早也是从污水中分离鉴定而来的,属于兼性厌氧菌[36].对这类细菌进一步的分离、培养及其生态生理特性的研究将有助于阐明其在微囊藻降解过程中的确切作用。
4 结论
本研究通过原位围隔实验模拟微囊藻水华分解过程,研究了此过程中细菌群落组成的动态变化.结果表明,细菌群落组成随着微囊藻分解的不同阶段发生显著变化.微囊藻厌氧分解过程伴随着水体氧化还原环境的改变(DO浓度和Eh降低),pH值、藻类生物量的下降和营养盐(N、P)释放,细菌群落组成与这些理化因子密切相关.研究中发现微囊藻分解阶段的特殊细菌群落,其中隶属于黄杆菌科(拟杆菌门)的类群在微囊藻厌氧分解阶段占显著优势,其功能有待于进一步研究。
致谢:感谢朱荣在围隔实验采样中给予的帮助。
参考文献5
[1]Lehma EM. Seasonal occurrence and toxicity ofMicrocystisin impoundments of the Huron River, Michigan, USA.WaterResearch, 2007, 41(4): 795-802。
[2]Paerl H, Fulton RS, Moisander PHetal. Harmful freshwater algal blooms, with an emphasis on cyanobacteria.TheScientificWorldJournal, 2001, (1): 76-113。
[3]Chen Y, Qin B, Teubner Ketal. Long-term dynamics of phytoplankton assemblages:Microcystis-domination in Lake Taihu, a large shallow lake in China.JournalofPlanktonResearch, 2003, 25: 445-453。
[4]Conley DJ, Paerl HW, Howarth RWetal. Controlling eutrophication: nitrogen and phosphorus.Science, 2009, 323: 1014-1015。
[5]Chen M, Chen F, Xing Petal. Microbial eukaryotic community in response toMicrocystisspp. Bloom, as assessed by an enclosure experiment in Lake Taihu, China.FEMSMicrobiologyEcology, 2010, 74: 19-31。
[6]Ma Z, Niu Y, Xie Petal. Off-flavor compounds from decaying cyanobacterial blooms of Lake Taihu.JournalofEnvironmentalSciences, 2013, 25: 495-501。
[7]Zhang XJ, Chen C, Ding JQetal. The 2007 water crisis in Wuxi, China: analysis of the origin.JournalofHazardousMaterials, 2010, 182: 130-135。
[8]Cole JJ, Likens GE, Strayer DL. Photosynthetically produced dissolved organic carbon: an important carbon source for planktonic bacteria.LimnologyandOceanography, 1982, 27(6): 1080-1090。
[9]Cole JJ, Findlay S, Pace ML. Bacterial production in fresh and saltwater ecosystems: a cross-system overview.MarineEcologyProgress, 1988, 43(1/2): 1-10。
[10]Paerl H, Pinckney J. A mini-review of microbial consortia: their roles in aquatic production and biogeochemical cycling.MicrobialEcology, 1996, 31: 225-247。
[11]Li H, Xing P, Chen Metal. Short-term bacterial community composition dynamics in response to accumulation and breakdown ofMicrocystisblooms.WaterResearch, 2011, 45: 1702-1710。
[12]Shao K, Zhang L, Wang Yetal. The responses of the taxa composition of particle-attached bacterial community to the decomposition ofMicrocystisblooms.ScienceoftheTotalEnvironment, 2014, 488/489: 236-242。
[13]Xing P, Kong F. Intra-habitat heterogeneity of environmental factors regulating bacterioplankton community composition in Lake Taihu, China.AquaticMicrobialEcology, 2007, 48: 113-122。
[14]Niu Y, Shen H, Chen Jetal. Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu, China.WaterResearch, 2011, 45: 4169-4182。
[15]Tian C, Tan J, Wu Xetal. Spatiotemporal transition of bacterioplankton diversity in a large shallow hypertrophic freshwater lake, as determined by denaturing gradient gel electrophoresis.JournalofPlanktonResearch, 2009, 31: 885-897。
[16]Qin B, Xu P, Wu Qetal. Environmental issues of lake Taihu, China.Hydrobiologia, 2007, 581: 3-14。
[17]金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990。
[18]胡鸿钧, 魏印心. 中国淡水藻类——系统, 分类及生态. 北京: 科学出版社, 2006。
[19]Muyzer G, De Waal EC, Uitterlinden AG. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA.AppliedandEnvironmentalMicrobiology, 1993, 59: 695-700。
[21]terBraak CJ, Verdonschot PF. Canonical correspondence analysis and related multivariate methods in aquatic ecology.AquaticSciences, 1995, 57: 255-289。
[22]Ye L, Wu X, Tan Xetal. Cell lysis of cyanobacteria and its implications for nutrient dynamics.InternationalReviewofHydrobiology, 2010, 95: 235-245。
[23]Shade A, Kent AD, Jones SEetal. Interannual dynamics and phenology of bacterial communities in a eutrophic lake.LimnologyandOceanography, 2007, 52: 487-494。
[24]Yannarell AC, Triplett EW. Geographic and environmental sources of variation in lake bacterial community composition.AppliedandEnvironmentalMicrobiology, 2005, 71: 227-239。
[25]Langenheder S, Jürgens K. Regulation of bacterial biomass and community structure by metazoan and protozoan predation.LimnologyandOceanography, 2001, 46: 121-134。
[26]Van Hannen E, Veninga M, Bloem Jetal. Genetic changes in the bacterial community structure associated with protistan grazers.ArchivfürHydrobiologie, 1999, 145: 25-38。
[27]Höfle MG, Haas H, Dominik K. Seasonal dynamics of bacterioplankton community structure in a eutrophic lake as determined by 5S rRNA analysis.AppliedandEnvironmentalMicrobiology, 1999, 65: 3164-3174。
[28]Rooney-Varga JN, Giewat MW, Savin MCetal. Links between phytoplankton and bacterial community dynamics in a coastal marine environment.MicrobialEcology, 2005, 49: 163-175。
[29]Berdjeb L, Ghiglione JF, Domaizon Ietal. A 2-year assessment of the main environmental factors driving the free-living bacterial community structure in Lake Bourget (France).MicrobialEcology, 2011, 61: 941-954。
[30]Wu QL, Zwart G, Wu Jetal. Submersed macrophytes play a key role in structuring bacterioplankton community composition in the large, shallow, subtropical Taihu Lake, China.EnvironmentalMicrobiology, 2007, 9: 2765-2774。
[31]Crump BC, Kling GW, Bahr Metal. Bacterioplankton Community Shifts in an Arctic Lake Correlate with Seasonal Changes in Organic Matter Source.AppliedandEnvironmentalMicrobiology, 2003, 69: 2253-2268。
[32]Pérez MT, Sommaruga R. Differential effect of algal- and soil-derived dissolved organic matter on alpine lake bacterial community composition and activity.LimnologyandOceanography, 2006, 51: 2527-2537。
[33]Judd KE, Crump BC, Kling GW. Variation in dissolved organic matter controls bacterial production and community composition.Ecology, 2006, 87: 2068-2079。
[34]Baines SB, Pace ML. The production of dissolved organic matter by phytoplankton and its importance to bacteria: patterns across marine and freshwater systems.LimnologyandOceanography, 1991, 36: 1078-1090。
[35]Xing P, Guo L, Tian Wetal. Novel Clostridium populations involved in the anaerobic degradation ofMicrocystisblooms.IsmeJournal, 2011, 5(5): 792-800。
[36]Allen TD, Lawson PA, Collins MDetal.Cloacibacteriumnormanensegen. nov. , sp. Nov. , a novel bacterium in the family Flavobacteriaceae isolated from municipal wastewater.InternationalJournalofSystematicandEvolutionaryMicrobiology, 2006, 56: 1311-1316。
J.LakeSci.(湖泊科学), 2016, 28(1): 22-30
©2016 byJournalofLakeSciences
The response of bacterial community composition to the decomposition ofMicrocystisblooms
XIE Lijuan1,2, YU Dezhao1,2, ZENG Cheng3& SHEN Hong1**
(1:DonghuExperimentalStationofLakeEcosystems,InstituteofHydrobiology,ChineseAcademyofSciences,Wuhan430072,P.R.China)
(2:UniversityofChineseAcademyofSciences,Beijing100049,P.R.China)
(3:HuazhongAgriculturalUniversity,Wuhan430070,P.R.China)
Abstract:To explore the response of bacterial community composition (BCC) to the decomposition of Microcystis blooms, we conducted an eleven-day in situ enclosure experiment to simulate the aggregation and decomposition of cyanobacterial bloom near the shoreline of Meiliang Bay, Lake Taihu. The water quality parameters and the BCC in enclosures were monitored. The results showed that the physicochemical factors and the BCC significantly changed during course of the decomposition of Microcystis blooms. Redundancy analyses induated that the redox state of environment (showed by dissolved oxygen or oxidation reduction potential), pH, biomass of phytoplankton and nutrient elements (total phosphorus and nitrate nitrogen) were closely related to the variation of the BCC. We also found that specific taxons in response to the decomposition of Microcystis blooms appeared in our experiment. A taxon, which affiliated to Flavobacterium (Bacteroidetes), significantly dominated during the period of anerobic decomposition of Microcystis blooms. The functions of the bacteria group need further exploration。
Keywords:Bacterial community composition; Microcystis blooms; decomposition; Flavobacterium; Lake Taihu
通信作者*;E-mail:hongshen@ihb.ac.cn。
DOI10.18307/2016.0103

