籼稻资源WD15515中抗褐飞虱QTL的定位研究
邓 钊 石少阶 王卉颖 上官欣欣 刘丙芳 荆胜利 杜 波陈荣智 祝莉莉 何光存武汉大学生命科学学院杂交水稻国家重点实验室, 湖北武汉430072
籼稻资源WD15515中抗褐飞虱QTL的定位研究
邓钊**石少阶**王卉颖上官欣欣刘丙芳荆胜利杜波陈荣智祝莉莉何光存*
武汉大学生命科学学院杂交水稻国家重点实验室, 湖北武汉430072
摘要:褐飞虱是我国水稻生产上最严重的虫害之一, 培育和种植抗褐飞虱水稻品种是控制褐飞虱的有效途径。WD15515是一份高抗褐飞虱的籼稻种质资源。利用9311与WD15515杂交培育了F2群体, 对F2代100个植株进行SSR分子标记分析, 测定植株上褐飞虱的蜜露分泌量、虫体增重量和增重比, 作为抗虫性指标。通过QTL IciMapping 3.0进行作图分析, 在第2、第4、第9染色体上共检测到4个抗褐飞虱QTL。其中第2染色体上检测到2个QTL, 以蜜露分泌量检测到的qBph2-1位于SSR标记RM71–RM6911之间, LOD值为3.68, 表型贡献率为11.08%; 以虫体增重量和增重比检测到的qBph2-2位于标记RM6911–RM521之间, LOD值分别为3.31、4.05, 表型贡献率分别为7.81%、9.38%。以蜜露分泌量、虫体增重量和增重比为指标, 在第4染色体上检测到qBph4, 定位于标记RM16996–RM17075之间, LOD值分别为11.11、13.81、15.41, 表型贡献率达到44.38%、45.24%、52.40%。同样, 以蜜露分泌量、虫体增重量和增重比在第9染色体上检测到qBph9, 定位于标记RM219–RM6444之间, LOD值分别为2.59、4.04、3.63, 表型贡献率分别为10.91%、12.39%、10.01%。上述结果表明, qBph4是一个抗褐飞虱主效基因。本项研究结果为抗褐飞虱水稻育种提供了新的基因资源。
关键词:水稻; 抗性; 褐飞虱; 数量性状基因座; 遗传图谱
本研究由国家自然科学基金项目(31230060)和国家重点基础研究发展计划(973计划)项目(2013CBA01403)资助。
This study was supported by the National Natural Science Foundation of China (31230060) and the National Basic Key Research Program (973 Program) (2013CBA01403).
**同等贡献(Contributed equally to this work)
第一作者联系方式: 邓钊, E-mail: dengzhao@lpht.com.cn; 石少阶, E-mail: 724054008@qq.com
褐飞虱(Nilaparvata lugens Stal, 简称BPH)属同翅目飞虱科昆虫, 是水稻的主要害虫。褐飞虱通过针状口器吸食水稻维管束鞘汁液, 造成稻株发黄、倒伏甚至枯死。褐飞虱在取食时传播水稻草状丛矮病和齿叶矮缩病, 同时也促使水稻纹枯病、小球菌核病的传播。随着高产不抗虫水稻品种的推广, 以及水稻种植方式和耕种制度的改变, 褐飞虱发生频次增加, 危害程度加大, 已经成为我国和世界上水稻生产的首要虫害, 对粮食生产安全造成严重威胁[1-2]。实践表明, 选育和推广具有抗虫能力的水稻品种是防治褐飞虱最为经济、有效的方法。因此, 发掘新的抗源和抗性基因对于培育具有持久抗虫性的品种、防治褐飞虱具有重要意义。
迄今为止, 国内外已报道定位30个抗褐飞虱主效基因[3], 其中Bph14、Bph26和Bph3等已被克隆[4-6]。多个抗褐飞虱基因已广泛用于水稻育种并在水稻生产中推广应用。据国际水稻研究所报道, 一些只含单一主效抗虫基因的品种在推广种植几年后, 会因褐飞虱种群变化而逐渐丧失原有的抗性, 具有多个抗虫位点或微效位点的品种, 抗性则更为持久。水稻品种IR64含有主效抗虫基因Bph1, 但在生产应用中较其他含Bph1的品种抗性更为持久。深入分析发现, IR64除含Bph1外, 还含多个抗虫QTL[7]。到目前为止, 已利用不同的水稻材料鉴定了多个抗褐飞虱QTL, Huang等[8]研究抗性材料B5, 定位了2个主效QTL Qbp1和Qbp2和3个微效QTL。Xu等[9]以Lemont/Teqing的RIL群体材料, 定位了7个抗褐飞虱QTL; 苏昌潮等[10]应用Nipponbare/Kasalath// Nipponbare回交重组自交系群体定位了3个抗褐飞虱QTL。上述研究结果, 为水稻抗褐飞虱育种提供了丰富的基因资源。
我们的前期研究结果表明, 籼稻品种资源WD15515对褐飞虱表现高抗(石少阶, 未发表资料)。本研究构建了9311/WD15515 F2群体, 检测并分析抗褐飞虱的基因位点, 并用BC1F1群体验证了定位结果。研究结果为水稻抗褐飞虱分子辅助育种, 并为精细定位和克隆抗褐飞虱新基因打下了基础。
1 材料与方法
1.1试验材料
以对褐飞虱敏感的品种9311为母本, 以WD15515为父本, 通过杂交和自交得到了F2群体, 选取其中的100株进行抗性鉴定和分子标记分析。与此同时, 以F1与9311回交得到BC1F1群体, 用于F2群体QTL定位结果的验证。于2006年在武汉田间采集褐飞虱, 在TN1稻株上饲养繁殖。
1.2水稻的褐飞虱抗性评定
通过测定褐飞虱在稻株上的表现值, 评价抗虫性。于塑料桶中种植供试水稻的亲本、F2及BC1F1,生长至40 d左右进行抗虫性评价。收集新近羽化的褐飞虱短翅雌虫, 制作30 mm × 30 mm蜡袋并放入雌虫1头, 然后将蜡袋绑定至水稻茎秆上, 由褐飞虱取食水稻(图1), 48 h后, 终止取食, 取下蜡袋。在褐飞虱取食前和取食后, 在十万分之一精度天平上分别称取蜡袋重量和虫体重量。取食前后蜡袋的重量差即为褐飞虱蜜露分泌量, 取食前后虫体重量之差即为虫体增重量, 用虫体增重量除以取食前虫体重量即为虫体增重比。每个单株上的放虫实验重复3次以上, 确保取得精确、可重复的结果。以蜜露分泌量、虫体增重量和虫体增重比的多重复平均值来评价每个水稻植株的抗虫性水平。

图1 水稻抗褐飞虱性能鉴定示意图Fig. 1 Schematic diagram showing BPH-resistance evaluation A: 每个水稻茎秆上绑定3个放虫蜡袋。B: 鉴定结束后从蜡袋中取出待称重的褐飞虱。A: three parafilm bags with BPH were bound in each stem of rice. B: BPH insects taken from parafilm bags.
1.3DNA抽提
以CTAB法制备水稻DNA。取新鲜水稻叶片200~300 mg至2 mL离心管, 于植物组织研磨仪中破碎, 加入800 μL CTAB提取液, 于65℃水浴30 min, 每5 min摇匀一次; 加入800 μL氯仿, 12 000×g离心10 min; 转移上清液至另一1.5 mL离心管, 加600 μL异丙醇, 12 000×g离心10 min; 弃上清液, 加800 μL 70%的乙醇, 12 000×g离心5 min; 弃70%乙醇, 于真空干燥机中烘干; 加100~200 μL 0.1×TE,溶解后于4℃保存备用。
1.4SSR标记分析
根据GRAMENE网站(http://www.gramene.org/ markers/index.html)公布的水稻SSR引物信息, 合成引物。10 μL的PCR反应体系含ddH2O 5.8 μL、10×
buffer 1.0 μL、dNTP (10 mmol L–1) 0.8 μL、PrimerF 0.15 μL、PrimerR 0.15 μL、Taq DNA聚合酶(5 U μL–1) 0.1 μL、DNA 2 μL。在ABI PCR仪中进行扩增反应, 95℃预变性5 min, 94℃变性30 s, 56℃退火30 s, 72℃延伸40 s, 32个循环, 72℃延伸8 min。扩增反应完成后加入6×lodding buffer 4 μL备用。PCR产物以8%非变性聚丙烯酰胺凝胶进行电泳分析。利用荧光灯箱分析DNA条带, 选取在亲本间有明显多态性的标记用于F2群体的分析。
1.5连锁图谱构建与QTL的分析
选择覆盖水稻全基因组的1000对SSR引物检测WD15515与9311之间的多态性。再利用筛到的多态引物检测WD15515/9311 F2群体中各单株的基因型, 按照QTL IciMapping软件的要求, 将与WD15515相同的带型记为“2”, 与9311相同的带型记为“0”, 与F1杂种带型相同的记为“1”, 其他或缺失带型记为“-1”。
使用QTL IciMapping 3.0分析QTL[11-12], 使用Map功能构建遗传图谱, 先用“Group”命令进行连锁分群, 再用“Ordering”命令确定各连锁群中各标记的最佳顺序, 最后以“Rippling”命令确定各标记在染色体上的排列顺序及间距。将LOD值定为3.0, 作图时以Kosambi函数将重组率转换为遗传距离[13]。随后使用bip功能, 以LOD值2.5为阈值, 进行QTL扫描, 遵循McCouch等[14]原则命名QTL。
2 结果与分析
2.1SSR遗传图谱的构建
利用覆盖水稻基因组的1000对SSR引物检测亲本WD15515与9311间的多态性, 共筛选到多态性引物320对。选取其中带型清晰、差异明显、均匀分布在12条染色体上的135对引物进行分子标记连锁图谱的构建。
以100个F2个体构建了包含135个SSR标记的遗传连锁图谱(图2)。该图覆盖水稻基因组的1194.35 cM, 每2个标记间平均距离为9.71 cM, 标记的顺序与已发表的连锁图谱基本一致[15]。
2.2亲本和F2群体的抗褐飞虱表型评价
在抗褐飞虱亲本WD15515植株上取食48 h后,褐飞虱单头雌虫的蜜露分泌量为1.87 mg, 虫体增重量为-0.04 mg, 表明在抗虫植株上褐飞虱的取食受到严重抑制, 生长发育受阻。在感虫亲本9311植株上, 褐飞虱单头雌虫的蜜露分泌量达到4.94 mg, 体重增加1.88 mg, 虫体增重比为0.86, 表明褐飞虱的取食和生长发育均正常。在F2群体中单株的抗虫性变异较广, 蜜露分泌量最小值为0.03 mg, 最大值为13.78 mg, 平均值为2.97 mg; F2群体虫体增重量最小值为-0.43 mg, 最大值为2.60 mg, 平均值为0.71 mg; 虫体增重比最小值为-0.17, 最大值为1.15, 平均值为0.32 (表1)。3种表型值在F2群体中表现为连续分布(图3), 提示在抗性材料WD15515中可能存在多个抗性位点。相关性分析发现, 蜜露分泌量、虫体增重和虫体增重比在0.01水平上显著相关(表2)。用QTL扫描分析结果中LOD值最高的分子标记RM16996分析F2群体各单株的基因型, F2群体的基因型和表型频率分布如图3, 从图中可知, 基因型为纯合和杂合WD15515的单株表现出较低的蜜露分泌量, 较低的增重量和增重比, 并且增重量和增重比出现了负增长的情况。
2.3F2群体中抗褐飞虱QTL分析
基于F2群体基因型和3种表型值结果, 应用QTL IciMapping 3.0软件进行完备区间作图分析, 共检测到4个QTL (图4), 分别位于水稻第2、第4、第9染色体上, 其中在第2染色体上以蜜露分泌量为指标检测到抗性位点qBph2-1, 位于分子标记RM71–RM6911之间, LOD值为3.68, 表型贡献率为11.08%。以虫体增重量和增重比为指标检测到位于RM6911–RM521之间的抗性位点qBph2-2, 其LOD值分别为3.31、4.05, 表型贡献率分别为7.81%、9.38%。以蜜露分泌量、虫体增重量和增重比在第4染色体上检测到QTL qBph4位于分子标记RM16996–RM17075之间, LOD值分别为11.11、13.81、15.41, 表型贡献率分别达到44.38%、45.24%、52.40%。表明qBph4是一个对褐飞虱取食和生长均有显著效应的主效位点。以蜜露分泌量、虫体增重和增重比为指标在第9染色体分子标记RM219~ RM6444之间检测到qBph9, 其LOD值分别为2.59、4.04、3.63, 表型贡献率分别为10.91%、12.39%、10.01% (表3)。4个QTL来源于WD15515的等位基因均能增强对褐飞虱的抗性。
2.4主效抗性位点的确认

图2 利用9311/WD15515 F2群体构建的水稻分子标记连锁图谱Fig. 2 Molecular linkage map constructed by SSR markers based on 9311/WD15515 F2population

表1 亲本及F2群体的性状表现Table 1 Performance of observed traits in the parents and F2population

表2 3种抗褐飞虱表型之间的相关系数Table 2 Correlation coefficient between observed traits in the F2population
为了进一步验证主效抗性位点qBph4, 构建了9311/WD15515//9311 BC1F1群体, 该群体共有94个单株。测定了在BC1F1各植株上褐飞虱的蜜露分泌量、虫体增重量和增重比值3种表型值, 用标记RM16996对群体各单株进行基因型检测, 得到
BC1F1群体的基因型和表型频率分布图(图5)。结果表明, qBph4位于RM16996–RM17075之间, 这一结果和F2群体得到的结论一致。含有WD15515基因来源的杂合基因型单株表现出较低的蜜露分泌量,较低的增重量和增重比, 证明该抗性位点在杂合情况下也有较好的抗性水平。

图3 9311/WD15515 F2群体的RM16996基因型和抗虫性表型频率分布图Fig. 3 Frequency distributions of BPH-resistance phenotypes and genotypes in F2population derived from the cross of 9311/WD15515黑色a、白色b和灰色h分别表示WD15515、9311和杂合的基因型。The black a, white b, and gray h bars denote the genotypes of WD15515 homozygotes, 9311 homozygotes and heterozygotes, respectively.
3 讨论
目前, 报道的褐飞虱抗性鉴定方法较多, 如水稻苗期抗性鉴定、水稻分蘖盛期抗性鉴定、褐飞虱存活率测定以及水稻分蘖期蜜露量测定等。水稻苗期集团法作为标准的褐飞虱抗性鉴定方法, 具有速度快、可以大批量筛选等优点, 但用虫量大, 不能做F2分离群体的单株抗虫性鉴定。刘光杰等[16]采用苗期群体筛选, 苗期单株接虫鉴定, 分蘖期单株鉴定以及蜜露量测定等对12个水稻品种进行褐飞虱抗性鉴定表明, 水稻分蘖期蜜露分泌量测定的结果与水稻分蘖期抗性鉴定以及苗期抗虫鉴定的结果一致。该研究是以测定褐飞虱取食水稻后, 滴落在滤纸上经茚三酮染色后蜜露所呈现面积大小评价水稻品种的抗性, 测定蜜露分泌量相对较为繁琐。本研究中, 利用称重法测定褐飞虱的蜜露量, 同时测定褐飞虱虫体重量的变化和增重比值来综合评价稻株的抗性水平, 具有更好的准确性和可重复性。我们前期研究结果表明, 这种以褐飞虱的表现来衡量水稻植株抗性, 与苗期集团法鉴定结果有高度一致性。

图4 水稻抗褐飞虱QTL在染色体上的分布Fig. 4 Distribution of the rice brown planthopper resistance QTLs on chromosome HW: 蜜露分泌量; WB: 虫体增重; WRB: 虫体增重比。HW represents honeydew weight; WB represents weight increment of BPH; WRB represents BPH weight increased ratio.
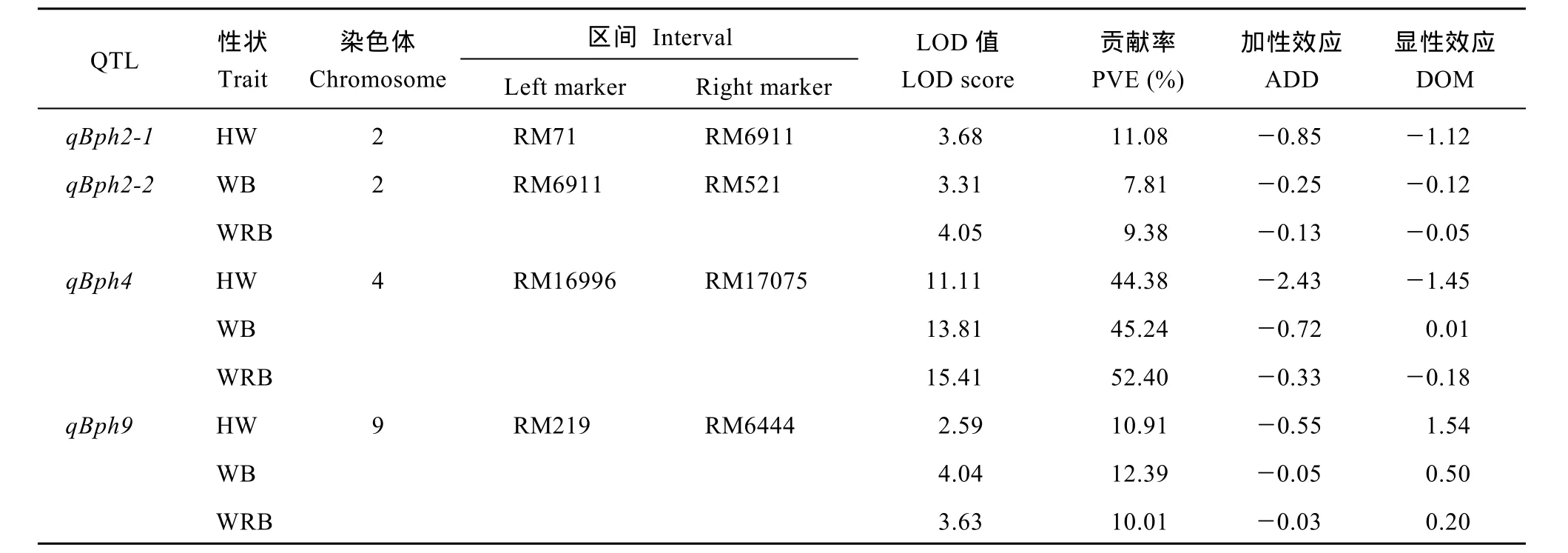
表3 水稻9311/WD15515 F2群体中抗褐飞虱QTL检测结果Table 3 Brown planthopper resistance QTLs detected in 9311/WD15515 F2population
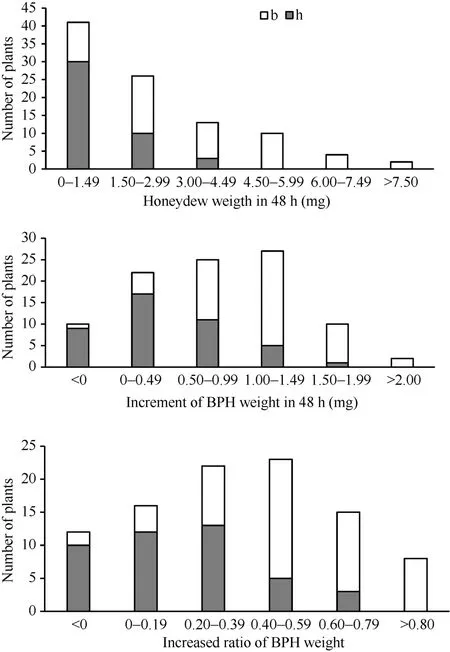
图5 WD15515/9311//9311 BC1F1群体中抗褐飞虱表型和RM16996基因型频率分布图Fig. 5 Frequency distributions of BPH-resistance phenotypes and genotypes of RM16996 in the BC1F1population derived from the cross of WD15515/9311//9311图示为SSR标记RM16996在BC1F1群体中的基因型。白色b和灰色h柱子分别表示9311和杂合的基因型。Genotypes for the SSR marker RM16996 in the BC1F1population is shown. The white b and gray h bars denote the genotypes of 9311 homozygotes and heterozygotes, respectively.
本研究测定褐飞虱在F2植株上的蜜露分泌量、虫体增重量和增重比值作为表型值, 定位了4个抗褐飞虱QTL, 即qBph2-1、qBph2-2、qBph4和qBph9,分别位于水稻第2、第4、第9染色体上。在已报道的水稻抗褐飞虱基因中, 第2染色体上已经定位的有Bph13(t), 位于长臂末端的标记RM250~RM240之间[17], 与本研究的qBph2-1和qBph2-2相距较远,因此这两个位点是新的抗褐飞虱位点。迄今为止, 第4染色体上已经定位了8个褐飞虱抗性基因, 分别为Bph3、Bph6、bph12、Bph12、Bph15、Bph17、Bph20(t)、Bph27、Bph27(t)[18]。其中, Bph3、Bph12、Bph15、Bph17、Bph20(t)定位于第4染色体短臂[19-20], 与qBph4定位区间相距较远, 而Bph6、bph12、bph18(t)、Bph27和Bph27(t)等均被定位于第4染色体长臂上, 与qBph4位置接近。bph12被定位于RFLP标记G271和R93之间比较宽的一个区间内[23]; Bph6来源于籼稻品种Swarnalata, 已被精细定位于STS标记Y19和Y9之间的25 kb区域内, 靠近bph12[24]。bph18(t)来源于普通野生稻, 被定位于标记RM273和RM6506之间[25]; Bph27来源于广西野生稻, 被精细定位于SSR标记RM16846和RM16853之间的86.3 kb区域[26]; Bph27(t)是从Balamawee材料中新鉴定出来的显性抗虫基因, 被定位于InDel标记Q52和Q20之间的63 kb[27]。通过与第4染色体长臂已定位的基因位置对比分析,本研究中定位的qBph4与Bph6位置相近, 二者是否为等位或同一基因需做进一步分析。第9染色体上仅报道过Bph(t)基因[28], 位于长臂末端的RFLP标记
CDO412~RZ404之间, 与qBph9相距较远, 因此, qBph9是一个新的抗褐飞虱基因位点。
4 结论
共定位了4个水稻抗褐飞虱QTL, 即qBph2-1、qBph2-2、qBph4、qBph9, 共解释表型变异率超过65%, 其中qBph4的贡献率达到44%~52%, 是一个主效位点, 该位点在杂合状态时也有较好的抗性。因此, qBph4可应用于杂交水稻育种。其他3个效应值较小的QTL, 将在培育稳定持久抗虫品种的育种项目中发挥作用。
References
[1] He G C, Du B, Chen R Z. Insect resistance. In: Zhang Q F, Wingeds R A, eds. Genetics and Genomics of Rice. New York: Springer, 2013. p 399
[2] 翟保平. 稻飞虱: 国际视野下的中国问题. 应用昆虫学报, 2011, 48: 1184–1193
Zhai B P. Rice planthoppers: a China problem under the international perspectives. Chin J Appl Entomol, 2011, 48: 1184–1193 (in Chinese with English abstract).
[3] Cheng X Y, Zhu L L, He G C. Towards understanding of molecular interactions between rice and the brown planthopper. Mol Plant, 2013, 6: 621–634
[4] Du B, Zhang W L, Liu B F, Hu J, Wei Z, Shi Z Y, He R F, Zhu L L, Chen R Z, Han B, He G C. Identification and characterization of Bph14, a gene conferring resistance to brown planthopper in rice. Proc Natl Acad Sci USA, 2009, 106: 22163–22168
[5] Tamura Y, Hattori M, Yoshioka H, Yoshioka M, Takahashi A, Wu J Z, Sentoku N, Yasui H. Map-based cloning and characterization of a brown planthopper resistance gene BPH26 from Oryza sativa L. ssp. indica cultivar ADR52. Sci Rep, 2014, 4: 5872
[6] Liu Y, Wu H, Chen H, Wu H, Chen H, Liu Y L, He J, Kang H Y, Sun Z G, Pan G, Wang Q, Hu J L, Zhou F, Zhou K N, Zheng X M, Ren Y L, Chen L M, Wang Y H, Zhao Z G, Lin Q B, Wu F Q, Zhang X, Guo X P, Cheng X N, Jiang L, Wu C Y, Wang H Y, Wan J M. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice. Nat Biotechnol, 2015, 33: 301–305
[7] Cohen M B, Alam S N, Medina E B, Bernal C C. Brown planthopper, Nilaparvatalugens, resistance in rice cultivar IR64: mechanism and role in successful N. lugens management in Central Luzon, Philippines. Entomol Exp Appl, 1997, 85: 221–229
[8] Huang Z, He G C, Shu L H, Li X H, Zhang Q F. Identification and mapping of two brown planthopper resistance genes in rice. Theor Appl Genet, 2001, 102: 929–934
[9] Xu X F, Mei H W, Luo L J, Chen X N, Li Z K. RFLP-facilitated investigation of the quantitative resistance of rice to brown planthopper (Nilaparvata lugens). Theor Appl Genet, 2002, 104: 248–253
[10] 苏昌潮, 程遐年, 翟虎渠, 万建民. 利用回交重组自交群体检测水稻抗褐飞虱数量性状基因座. 遗传学报, 2002, 29: 332–338
Su C C, Cheng X N, Zhai H Q, Wan J M. Detection and analysis of QTL for resistance to the brown planthopper, Nilaparvata lugens (Stal), in rice (Oryza sativa L.), using backcross inbred lines. Acta Genet Sin, 2002, 29: 332–338 (in Chinese with English abstract)
[11] 王建康. 数量性状基因的完备区间作图方法. 作物学报, 2009, 35: 239–245
Wang J K. Inclusive composite interval mapping of quantitative trait genes. Acta Agron Sin, 2009, 35: 239–245 (in Chinese with English abstract)
[12] 李慧慧, 张鲁燕, 王建康. 数量性状基因定位研究中若干常见问题的分析与解答. 作物学报, 2010, 36: 918–931
Li H H, Zhang L Y, Wang J K. Analysis and answers to frequently asked questions in quantitative trait locus mapping. Acta Agron Sin, 2010, 36: 918–931 (in Chinese with English abstract).
[13] Kosambi D D. The estimation of map distances from recombination values. Ann Eugenics, 1994, 12: 172–175
[14] McCouch S R, Cho Y G, Yano M, Paul E, Blinstrub M, Morishima H, Kinoshita T. Report on QTL nomenclature. Rice Genet Newsl, 1997, 14(11): 11-13
[15] McCouch S R, Teytelman L, Xu Y, Lobos K B, Clare K, Walton M, Fu B Y, Maghirang R, Li Z K, Xing Y Z. Development and mapping of 2240 new SSR markers for rice (Oryza sativa L.). DNA Res, 2002, 9(6): 199–207
[16] 刘光杰, 郑宜才, 桂丽琴, 沈君辉. 水稻品种抗稻飞虱鉴定方法的比较研究. 浙江农业学报, 1999, 11: 306–310
Liu G J, Zheng Y C, Gui L Q, Shen J H. A comparative study of the rice planthopper resistance identification method. Zhejiang Agric Sci, 1999, 11: 306–310 (in Chinese)
[17] 刘国庆, 颜辉煌, 傅强, 钱前, 张志涛, 翟文学, 朱立煌. 栽培稻的紧穗野生稻抗褐风虱主效基因的遗传定位. 科学通报, 2001, 46: 738–742
Liu G Q, Yan H H, Fu Q, Qian Q, Zhang Z T, Zhai W X, Zhu L H. Mapping of a new gene for brown planthopper resistance in cultivated rice introgressed from Oryza eichingeri. Chin Sci Bull, 2001, 46: 1495–1462 (in Chinese)
[18] Ali M P, Chowdhury T R. Tagging and mapping of genes and QTLs of Nilaparvatalugens resistance in rice. Euphytica, 2014, 195: 1–30
[19] Qiu Y F, Guo J P, Jing S L, Zhu L L, He G C. Development and characterization of japonica rice lines carrying the brown planthopper-resistance genes BPH12 and BPH6. Theor Appl Genet, 2012, 124: 485–494
[20] Yang H Y, You A Q, Yang Z F, Zhang F, He R F, Zhu L L, He G C. High-resolution genetic mapping at the Bph15 locus for brown planthopper resistance in rice (Oryza sativa L.). Theor Appl Genet, 2004, 110: 182–191
[21] Sun L H, Su C C, Wang C M, Zhai H Q, Wan J M. Mapping of a major resistance gene to the brown planthopper in the rice cultivar Rathu Heenati. Breed Sci, 2005, 55: 391–396
[22] Rahman M L, Jiang W, Chu S H, Qiao Y, Ham T H, Woo M O, Lee J, Khanam M S, Chin J H, Jeung J U. High-resolution mapping of two rice brown planthopper resistance genes, Bph20(t) and Bph21(t), originating from Oryza minuta. Theor Appl Genet, 2009, 119: 1237–1246
[23] Hirabayashi H, Ogawa T. Identification and utilization of DNA markers linked to genes for reistance to brown planthopper (BPH) in rice. Adv Breed (Japan), 1999, 41: 71–74
[24] Qiu Y F, Guo J P, Jing S L, Zhu L L, He G C. High-resolution mapping of the brown planthopper resistance gene Bph6 in rice and characterizing its resistance in the 9311 and Nipponbare near isogenic backgrounds. Theor Appl Genet, 2010, 121: 1601–1611
[25] Li R B, Li L S, Wei S M, Wei Y P, Chen Y Z, Bai D L, Yang L, Huang F K, Lu W L, Zhang X J, Li X Y, Yang X Q, Wei Y W. The evaluation and utilization of new genes for brown planthopper resistance in common wild rice (Oryza rufipogon Griff.). Mol Plant Breed, 2006, 4: 365–371
[26] Huang D, Qiu Y, Zhang Y, Huang F, Meng J, Wei S, Li R, Chen B. Fine mapping and characterization of BPH27, a brown planthopper resistance gene from wild rice (Oryza rufipogon Griff.). Theor Appl Genet, 2013, 126: 219–229
[27] He J, Liu Y, Liu Y Q, Liu Y L, Jiang L, Wu H, Kang H Y, Liu S J, Chen L M, Liu X, Cheng X N, Wan J M. High-resolution mapping of brown planthopper (BPH) resistance gene Bph27(t) in rice (Oryza sativa L.). Mol Breed, 2013, 31: 549–557
[28] Mei M, Zhuang C, Wan R, Wu J, Hu W, Kochert G. Genetic analysis and tagging of gene for brown planthopper resistance in indica rice. In: Rice Genetics III. Proceedings of the Third International Rice Genetics Symposium. IRRI, Los Baños, Philippines, 1996. pp 16–20
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151207.1041.014.html
Analysis of QTLs for Brown Planthopper Resistance in Indica Rice WD15515
DENG Zhao**, SHI Shao-Jie**, WANG Hui-Ying, SHANG-GUAN Xin-Xin, LIU Bing-Fang, JING Sheng-Li, DU Bo, CHEN Rong-Zhi, ZHU Li-Li, and HE Guang-Cun*
State Key Laboratory of Hybrid Rice, College of Life Sciences, Wuhan University, Wuhan 430072, China
Abstract:Brown planthopper (BPH) is one of the most destructive insect pests of rice. WD15515 is an indica germplasm highly resistant to BPH. An F2population was developed from the cross between 9311 and WD15515. One hundred F2plants were genotyped by using SSR markers and evaluated for BPH-resistance by measuring the honeydew weight secreted by BPH (HW), the body weight increment (WB) and the body weight increment ratio (WRB). A total of four QTLs for BPH resistance were identified. The qBph2-1, based on HW (honeydew weight), was detected between RM71 and RM6911 on chromosome 2, with LOD score of 3.68 and explaining the 11.08% of phenotypic variation. The qBph2-2, based on both WB and WRB, was mapped between RM6911 and RM521 on chromosome 2, with LOD score of 3.31 and 4.05 and explaining 7.81% and 9.38% of the phenotypic variation, respectively. The qBph4, based on HW, WB and WRB, was detected between RM16996 and RM17075 on chromosome 4, with LOD score of 11.11, 13.81, and 15.41 and explaining 44.38%, 45.24%, and 52.40% of the phenotypic variation, respectively. The qBph9, based on HW, WB, and WRB, was detected on chromosome 9 between RM219 and RM6444, with LOD score of 2.59, 4.04, and 3.63. This locus explained 10.91%, 12.39%, and 10.01% of the phenotypic variation in this population, respectively. qBph4 is a major gene for BPH-resistance. This result provides the new resources for BPH-resistance breeding.
Keywords:Rice; Resistance; Brown planthopper; QTL; Genetic map
收稿日期Received(): 2015-07-08; Accepted(接受日期): 2015-11-20; Published online(网络出版日期): 2015-12-07.
通讯作者*(Corresponding author): 何光存, E-mail: gche@whu.edu.cn, Tel: 027-68752384
DOI:10.3724/SP.J.1006.2016.00353

