大赖草6-SFT基因的克隆及其转基因烟草抗旱和抗寒性分析
贺晓岚 王建伟 李文旭 陈真真 赵继新 武 军 王中华陈新宏,*
1西北农林科技大学农学院 / 陕西省植物遗传工程育种重点实验室, 陕西杨凌 712100;2凯里学院环境与生命科学学院, 贵州凯里556011;3河南省农业科学院小麦研究所, 河南郑州 450002
大赖草6-SFT基因的克隆及其转基因烟草抗旱和抗寒性分析
贺晓岚1王建伟2李文旭3陈真真1赵继新1武军1王中华1陈新宏1,*
1西北农林科技大学农学院 / 陕西省植物遗传工程育种重点实验室, 陕西杨凌 712100;2凯里学院环境与生命科学学院, 贵州凯里556011;3河南省农业科学院小麦研究所, 河南郑州 450002
摘要:果聚糖合成酶(6-SFT)在植物抵御逆境胁迫中起重要作用。利用RACE结合RT-PCR技术从大赖草(Leymus racemosus, 2n = 4x = 28, NsNsXmXm)中克隆到6-SFT基因, 其完整开放阅读框为1863 bp。该基因被命名为Lr-6-SFT (GenBank登录号KT387273), 编码620个氨基酸, 其推导氨基酸序列含有保守的果糖基转移酶结构域。氨基酸序列比对及进化树分析表明, 大赖草6-SFT与华山新麦草、普通小麦、西尔斯山羊草和大麦6-SFT具有高度相似性。采用基因重组技术构建p1300-35SN-Lr-6-SFT表达载体, 利用农杆菌介导法将该载体转入烟草品种W38中。对经过抗性筛选、PCR和RT-PCR验证的转基因植株进行抗旱和抗寒性鉴定, 发现转基因植株与对照相比, 抗旱和抗寒性明显增强; 在逆境胁迫条件下, 转基因植株的果聚糖、可溶性糖、脯氨酸含量都显著高于对照, 而丙二醛的含量显著低于对照。本研究表明, Lr-6-SFT基因是典型的GH32家族成员, 其表达能够提高烟草对干旱和寒冷胁迫的抗性。
关键词:6-SFT基因; 干旱; 寒冷; 大赖草; 生理指标; 转基因烟草
本研究由国家自然科学基金项目(31571650)和西北农林科技大学唐仲英育种基金资助。
This study was supported by the National Natural Science Foundation of China (31571650) and the Tang Zhong-Ying Breeding Fund of the Northwest A&F University.
第一作者联系方式: E-mail: helingzhi123@126.com, Tel: 18285549260
果聚糖是以果糖为基本单位, 由蔗糖与一个或多个果糖基连接而成的聚合物[1], 广泛分布在各种生物有机体中。果聚糖是15%的被子植物和冷季型牧草的主要储存性碳水化合物[2]。积累果聚糖的植物主要分布在干旱和寒冷地区, 在热带或水生环境中分布较少[2]。在植物体内果聚糖主要积累在液泡中[3]。果聚糖不仅是重要的储存性碳水化合物, 也是一种重要的渗透调节物质。此外, 果聚糖含量的增加能防止膜相变, 进而起到稳定膜系统的作用[4],在植物适应干旱、低温和高盐等非生物逆境过程中起着重要的作用[5]。在高等植物中, 以蔗糖为底物进行果聚糖的合成, 有4种不同的果糖基转移酶参与果聚糖的合成[6], 其中sucrose:fructan 6-fructosyltransferase (6-SFT)是合成果聚糖的关键酶[7]。自1995年Sprenger等[7]首次从大麦中发现并克隆到6-SFT基因以来, 已经从多种植物中分离克隆该基因, 并且对其进行遗传转化和功能验证研究, 如冰草[8]、小麦[9]、猫尾草[10]、雀麦草[11]、华山新麦草[12]等。虽然6-SFT基因在进化上比较活跃[13], 但是, SDPNG、FRDP和WECIDF活性结构域是高度保守的[11]。大量研究表明, 6-SFT能够增强植物对干旱[5]和寒冷[11,14]等逆境胁迫的耐受能力; 在非果聚糖植物中, 6-SFT基因的表达使得转基因植株积累果聚糖[5,15]。在转6-SFT基因的植株中, 随着果聚糖含量的增加,可溶性糖含量也增加了[5,16-17]。Knipp和Honermeier[18]研究发现, 转果聚糖酶基因的植株中, 果聚糖的积累对脯氨酸的含量具有多向性效应。还有研究证明, 转6-SFT基因的植株中果聚糖的积累增强了转基因植株抗氧化胁迫的能力, 转基因植株丙二醛含量显著低于对照植株[15]。在逆境胁迫条件下, 可溶性糖和脯氨酸等渗透调节物质的积累有利于增强植物对非生物逆境胁迫的抵抗能力[19-20]。因此, 植物体内果聚糖含量的增加对其抗旱抗寒性的提高具有重要意义。
果聚糖的聚合度具有物种特异性[21]。在冷季型草中, 果聚糖低聚物的数量[22]和结构[23]差异很大。6-SFT基因在进化上比较活跃, 因此, 从不同物种中分离获取该基因的序列信息有助于分析它们之间的分子关系, 并有助于阐明不同物种同源基因之间的进化关系[8]; 同时, 将这些基因导入植物中可能会提高植物的抗逆性。大赖草(Leymus racemosus, 2n = 4x = 28, NsNsXmXm)又称巨大冰麦草, 大穗滨麦草,属于禾本科小麦族赖草属, 为多年生草本植物, 具有大穗、多花、抗旱、抗寒、耐盐和抗多种病害等优良性状[24]。该物种分布广泛, 从中亚到东欧都有分布, 在海岸、沙丘和沙漠中最为常见。前人已成功地将来源于细菌[25]、真菌[26]及植物[7]的果聚糖合成酶关键基因转入非果聚糖植物中, 对果聚糖的代谢及积累效应进行研究, 并且开展了抗旱[25]、抗寒[15]、抗盐[5]及抗氧化胁迫[15]的研究。但是, 有关大赖草6-SFT基因在干旱和寒冷胁迫抗性中的作用及其转基因植株在逆境胁迫下的生理生化反应的研究尚未见报道。本研究从大赖草中克隆6-SFT基因, 转化烟草, 通过干旱和寒冷胁迫处理, 旨在了解Lr-6-SFT在干旱和寒冷胁迫下的作用, 以证明转基因烟草是否通过表达6-SFT基因而增强其抗旱和抗寒性。
1 材料与方法
1.1大赖草果聚糖合成酶基因Lr-6-SFT的克隆
1.1.1cDNA中间保守区的克隆和序列测定大赖草(Leymus racemosus, 2n = 4x = 28, NsNsXmXm)种植于西北农林科技大学试验地(陕西杨凌), 利用总RNA提取试剂盒RNeasy Plant Minikit (Qiagen, Germany)提取大赖草叶片总RNA。使用SuperScript III Reverse Transcriptase cDNA第1链合成试剂盒(Invitrogen)合成cDNA第1链。参照小麦、西尔斯山羊草、大麦、冰草、雀麦、梯牧草、偏生早熟禾、草地早熟禾、毒麦和黑麦草10种植物的6-SFT蛋白氨基酸保守区序列设计1对简并引物, 选用LA Taq (TaKaRa)扩增大赖草6-SFT基因的cDNA中间保守区。简并引物序列, DPsen为5′-AAYGARATGYT NCARTGG-3′, DPantisen为5′-NCCRTCNARNACN GGNAC-3′, N=AcgT; Y=CT; R=Ag。反应程序为94。C预变性3 min; 94。C变性30 s, 55。C退火30 s, 72。C延伸2 min, 35个循环; 72。C延伸10 min。PCR扩增产物经琼脂糖凝胶电泳后回收纯化目的片段,目的片段与pMD19-T载体(大连TaKaRa)连接, 转化至大肠杆菌E. coli DH5α感受态细胞, 将菌落PCR和质粒单双酶切鉴定正确的5个重组质粒送生工生物工程(上海)有限公司测序。
1.1.2Lr-6-SFT基因3′端和5′端序列的克隆按照3′-Full RACE Core Set Ver.2.0试剂盒和5′-Full RACE Kit试剂盒(TaKaRa)说明书分别克隆大赖草Lr-6-SFT基因cDNA的3′端和5′端序列, 特异引物序列为GSOP3′-Lr3: 5′-TGAGGCTGATGTGGGCTA T-3′, GSIP3′-Lr3: 5′-CCTCGTCCTCGCTGCTGG TA-3′; GSOP5′-Lr3: 5′-GGTGACCAGATGACGGG ATT-3′, GSIP5′-Lr3: 5′-TGCACTGGACCTCAACAG
C-3′。大赖草叶片总RNA提取和PCR产物的克隆、测序方法如前所述。
1.2Lr-6-SFT基因cDNA编码区的获得及其编码产物序列分析
根据5′和3′-RACE的结果, 并参考小麦6-SFT基因cDNA序列设计克隆Lr-6-SFT基因的引物, 其序列为Lr-6-SFT-F: 5′-TCACAATCTACCAAACTC TCTTA-3′; Lr-6-SFT-R: 5′-CACTCTCCCAAACAAC AATA-3′, 通过PCR法扩增Lr-6-SFT基因编码区序列, 并测序验证。
采用National Center for Biotechnology Information (NCBI)网站(http://www.ncbi.nlm.nih.gov/)的在线工具DNAMAN 4.0、MegAlign软件和多序列比对程序ClustalX2进行cDNA序列BLAST分析。采用ExPasy proteomics server (http://www.expasy.ch/tools/ dna.html)氨基酸翻译工具及Conserved Domains数据库分析氨基酸序列的保守区域; 使用NCBI的ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf. html)分析基因开放阅读框(ORF), 借助ClustalX2和MEGA5.0软件构建系统进化树。
1.3以农杆菌介导法转化烟草
1.3.1表达载体的构建及转基因植株的培育将Lr-6-SFT基因的完整编码区序列插入植物表达载体p1300-35SN的Hind III–BamH I位点, 构建植物表达载体p1300-35SN-Lr-6-SFT (图1), 通过测序确保Lr-6-SFT在载体中的插入方向及完整性。将重组质粒p1300-35SN-Lr-6-SFT通过冻融法[27]转入农杆菌GV3101(本实验室保存), 再利用叶盘法[28]转化烟草W38, 最后将经过10 mg L–1潮霉素筛选的抗性植株移入温室培养。
1.3.2转基因植株PCR扩增分析采用CTAB法[29]提取推定的转基因烟草叶片的基因组DNA, 以其为模板, 以Lr-6-SFT-F (5′-TCACAATCTACCAAAC TCTCTTA-3′)和Lr-6-SFT-R (5′-CACTCTCCCAAAC AACAATA-3′)为引物, 通过PCR扩增法鉴定目的基因在转基因植株基因组中的整合情况。PCR反应条件为94℃预变性5 min; 94℃变性30 s, 60℃退火30 s,
72℃延伸2 min, 35个循环, 72℃延伸10 min, 扩增产物长度约2175 bp, 经1.0%琼脂糖凝胶电泳分析。1.3.3转基因植株RT-PCR分析为了分析Lr-6-SFT基因在RNA水平的表达情况, 本研究对PCR阳性转基因植株进行Lr-6-SFT转录水平分析。烟草总RNA的提取及cDNA第1链的合成方法同1.1.1。以测试烟草的cDNA为模板, 首先以烟草actin基因特异引物(ActF: 5′-TGGCATCATACCTT TTACAA-3′和ActR: 5′-TCCGGGCATCTGAACCTC T-3′)对各样本进行扩增, 根据扩增结果调整模板浓度, 以使模板cDNA均一化。反应程序为95℃预变性3 min; 94℃ 30 s, 55℃ 30 s, 72℃ 30 s, 35个循环; 72℃延伸10 min。然后用Lr-6-SFT基因的特异引物(Rp6-SFT-F: 5′-CCGCTGTTGAGGTCCAGT-3′, Rp6-SFT-R: 5′-TCTTCGCCGGATCATAGAA-3′)进行半定量RT-PCR分析。Lr6-SFT基因检测的RT-PCR反应条件为95℃预变性3 min; 94℃ 45 s, 55℃ 35 s, 72 ℃ 30 s, 35个循环; 72℃延伸10 min, 重复3次。
1.4转基因烟草植株的表型分析
1.4.1抗旱和抗冷性鉴定参考Bie等[5]的方法鉴定转基因植株的抗旱和抗冷性, 方法略有改动。选用五、六叶期、大小及长势一致的烟草转基因植株及对照(转空载体的植株)进行胁迫处理, 其中旱胁迫处理为胁迫35 d后(最嫩叶片有明显萎蔫症状)进行复水处理, 1周后观察其恢复生长情况; 冷胁迫处理为10℃、14 h光照/10 h黑暗、光照强度25 µmol m–2s–1条件处理10 d, 然后-20℃处理30 min, 室温条件下培养9 d, 观察植株生长状态。
1.4.2相关生理指标测定选择RT-PCR鉴定表达量相对较高的T0代转基因烟草植株, 采集逆境胁迫前及干旱胁迫(20 d)或冷胁迫(10℃ 10 d, –20℃ 5 min)后T0代转基因植株和对照植株叶片, 用蒽酮比色法测定可溶性糖含量[30], 茚三酮法测定脯氨酸含量[31], 植物丙二醛测定试剂盒(南京建成生物工程研究所)测定丙二醛含量, 及Plant Fructan Colorimetric Assay Kit (GenMed Scientifics Inc., USA)测定果聚糖含量。对每个处理的每个生理指标重复测定4次。

图1 植物表达载体p1300-35SN-Lr-6-SFT示意图Fig. 1 Structure of transformation vector p1300-35SN-Lr-6-SFT used in the studyRB: T-DNA右边界; 35S′: CaMV 35S poly A; p35S2: 含双增强子的CaMV 35S启动子; p35S1: CaMV 35S启动子; Tnos: 终止子; LB: T-DNA左边界。RB: right border of T-DNA; 35S′: CaMV 35S poly A; p35S2: CaMV 35S promoter with double enhancer sequences; p35S1: CaMV 35S promoter; Tnos: nopaline synthase terminator; LB: left border of T-DNA.
1.4.3统计分析用SAS V8.1软件统计分析测定数据, t检验法比较均数(P<0.05), Originpro 2015软件作图。
2 结果与分析
2.1Lr-6-SFT基因的获得和序列分析
采用简并引物PCR扩增和RACE获得全长大赖草6-SFT基因, 其完整开放阅读框为1863 bp, 编码620个氨基酸, 含有6个N端糖基化位点(Asn-Xaa-Ser/Thr), 等电点为5.11, 分子量预测为68.6 kD。在GenBank上进行Blast检索, 发现该序列与普通小麦的6-SFT基因序列相似性高达92%。将该基因的推导氨基酸序列与其他植物的同源序列比对显示, Lr-6-SFT存在3个高度保守的结构域, 与其他植物的6-SFT一样, 在蔗糖结合框S/NDPNG包含一个活跃的天冬氨酸(D)残基, 在WECID保守区包含一个谷氨酸(E)残基, 在FRDP框包含一个天门冬氨酸(D)残基(图2)。Lr-6-SFT与华山新麦草、普通小麦、西尔斯山羊草、大麦的6-SFT序列相似性很高, 在进化树上聚为一类(图3)。比较Lr-6-SFT基因与华山新麦草的6-SFT, 发现序列相似性高达97%, 大赖草的6-SFT除了插入12个连续的CCGCCGCCGACG核苷酸外, 还存在一些单碱基变异, 但是这些变异均属同义突变, 突变后仍然编码相同的氨基酸。在氨基酸水平上, Lr-6-SFT仅比华山新麦草6-SFT在N端多4个连续的AAAD氨基酸。因此, 克隆获得的序列为推定的6-SFT基因, 被命名为Lr-6-SFT, 基因登录号为KT387273。
2.2转Lr-6-SFT烟草植株的获得与鉴定
通过农杆菌转化法获得转基因烟草T0代植株,经潮霉素筛选后, 首先利用Lr-6-SFT-F/Lr-6-SFT-R引物对进行PCR验证, 共获得PCR阳性植株49株(图4-a), 再用Rp6-SFT-F/Rp6-SFT-R引物对进行RT-PCR验证, 获得43株阳性植株。RT-PCR分析结果显示, Lr-6-SFT在转基因烟草中均能正常表达, 而在对照植株中未检测到转录信号(图4-b)。
2.3转基因烟草逆境胁迫前后表型分析
在正常条件下, 转Lr-6-SFT基因的烟草植株和对照植株35 d后的生长状态无明显差异(图5-a)。在干旱胁迫35 d后, 对照植株全部干枯, 而转基因植株顶部的叶片仍然保持绿色(图5-b); 复水后, 对照植株未能复活, 而转基因植株在14 d后陆续有新叶长出。在冷胁迫(10℃ 10 d, –20℃30 min)后, 对照植株全部枯萎, 而转基因植株只有下部的叶片枯萎, 顶部叶片仍然保持正常生长势(图5-c); 转移至室温下恢复培养7 d后, 转基因植株表现出较低程度的生长发育迟缓, 而对照植株全部死亡。
2.4转基因烟草逆境胁迫前后生理指标分析
在正常生长条件下, 转基因T0植株的果聚糖含量显著高于对照植株, 转基因植株的果聚糖含量为6.87~9.57 mg g–1, 而在对照植株中没有检测到果聚糖; 转基因植株可溶性糖、脯氨酸的含量均略高于对照植株, 丙二醛的含量略低于对照植株, 差异不显著(图6)。
干旱胁迫20 d后, 转基因植株的果聚糖含量显著增加, 为14.97~19.23 mg g–1, 是胁迫前的2.0~2.3 倍, 而在对照植株中没有检测到果聚糖; 转基因植株的可溶性糖、脯氨酸含量分别为0.20%~0.23%和26.97~28.67 μg g–1, 均显著高于对照植株; 转基因植株的丙二醛含量仅为11.14~16.12 nmol g–1, 显著低于对照植株的29.66~30.17 nmol g–1(图6)。
与干旱胁迫处理相似, 冷胁迫处理后的转基因植株, 果聚糖含量增加到胁迫前的1.9~2.4倍, 而在对照植株中没有检测到果聚糖; 转基因植株的可溶性糖和脯氨酸含量也均显著高于对照植株, 丙二醛含量却显著低于对照植株(图6)。
总之, 干旱和冷胁迫后, 转基因植株中丙二醛的含量略有提高, 而对照植株中丙二醛的含量显著增加。在胁迫条件下, 转基因植株中的碳水化合物和脯氨酸含量都显著高于对照植株。
3 讨论
3.1Lr-6-SFT基因的cDNA及其推导氨基酸序列的特征分析
本研究克隆得到了大赖草叶片6-SFT基因全长序列, 将其命名为Lr-6-SFT。蛋白质结构分析表明, Lr-6-SFT属于植物糖基水解酶家族32。Lr-6-SFT核苷酸序列所编码的氨基酸序列包含SDPNG、RDP 和WECVD保守结构域及DDER模体, 这表明Lr-6-SFT蛋白属于S型的FT[32]。系统进化树分析结果显示, Lr-6-SFT编码的氨基酸序列与华山新麦草、小麦、大麦、西尔斯山羊草的同源序列亲缘关系较近, 尤其与华山新麦草的亲缘关系最近(图3)。多序列比对结果显示, N-端的氨基酸序列差异较大,功能区域较保守, 不同物种间6-SFT的相似性较高。推测6-SFT作为果聚糖合成路径的关键酶基因在进化过程中必须保持较高的遗传稳定性。
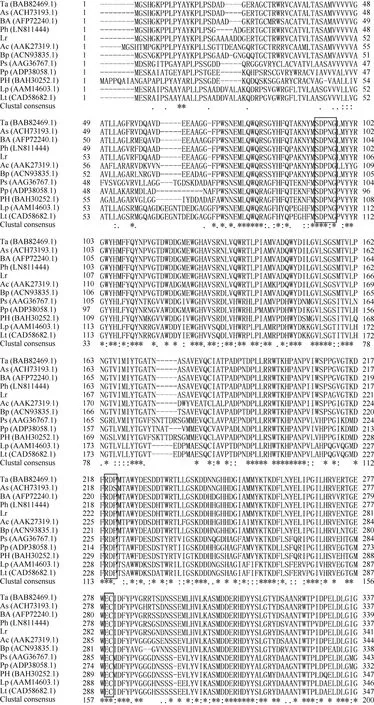
(图2)

图2 推定的大赖草6-SFT和其他物种6-SFT蛋白序列联配分析Fig. 2 Alignment of amino acid sequences of 6-SFTs from Leymus racemosus and other plant species方框显示序列保守区;星号(*)表示相同残基; 冒号(:)表示保守替换; 点号(.)表示半保守替换。比对物种为大赖草(Lr)、普通小麦(Ta)、西尔斯山羊草(As)、大麦(BA)、冰草(Ac)、金雀花(Bp)、猫尾草(PH)、偏生早熟禾(Ps)、草地早熟禾(Pp)、毒麦(Lt)、华山新麦草(Ph)和多年生黑麦草(Lp)。Conserved regions are boxed. Asterisks (*), colons (:), and periods (.) show the identical residues, conserved substitutions, and semiconserved substitutions, respectively. The 6-SFT sequences were obtained from Leymus racemosus (Lr), Triticum aestivum (Ta), Aegilops searsii (As), Hordeum vulgare subsp. vulgare (BA), Agropyron cristatum (Ac), Bromus pictus (Bp), Phleum pratense (PH), Poa secunda (Ps), Poa pratensis (Pp), Lolium temulentum (Lt), Psathyrostachys huashanica (Ph), and Lolium perenne (Lp).

图3 推定的大赖草的6-SFT蛋白与其他物种6-SFT蛋白的系统进化树分析Fig. 3 Phylogenic tree of 6-SFTs proteins from Leymus racemosus and other plant species各节点处数值表示Bootstrap值(迭代1000次)。比对物种为大赖草(Lr)、普通小麦(Ta)、西尔斯山羊草(As)、大麦(BA)、冰草(Ac)、金雀花(Bp)、猫尾草(PH)、偏生早熟禾(Ps)、草地早熟禾(Pp)、毒麦(Lt)、华山新麦草(Ph)和多年生黑麦草(Lp)。The bootstrap percentages (>50%) indicate next to the branches (based on 1000 replicates). The 6-SFT sequences were obtained from Leymus racemosus (Lr), Triticum aestivum (Ta), Aegilops searsii (As), Hordeum vulgare subsp. vulgare (BA), Agropyron cristatum (Ac), Bromus pictus (Bp), Phleum pratense (PH), Poa secunda (Ps), Poa pratensis (Pp), Lolium temulentum (Lt), Psathyrostachys huashanica (Ph), and Lolium perenne (Lp).

图4 转Lr-6-SFT基因烟草分子检测结果Fig. 4 PCR assay of Lr-6-SFT transgenic tobacco plantsa: 随机挑选的8株转基因烟草植株的PCR检测, 其中M为DL10000 DNA marker, P为阳性对照(质粒), NT为转空载体的阴性对照, 1~8为推定的转基因植株。b: T0代烟草转基因植株的RT-PCR检测, 以Actin为内参, 其中NT为转空载体的阴性对照, 其他泳道为转基因植株。Panel a show the PCR profile of Lr-6-SFT gene in eight individual tobacco plants. M: DL10000 DNA marker; P: positive control (plasmid); NT: negative control (non-transgenic plants); 1–8: putative transgenic plants. Panel b show the RT-PCR result of primary T0transgenic tobacco plants using Actin primers as the internal control. Lane NT is the negative control (non-transgenic plants) and other lanes are the transgenic plants.

图5 转Lr-6-SFT基因烟草逆境胁迫处理结果Fig. 5 Phenotypes of tobacco plants transformed with the Leymus racemosus Lr-6-SFT gene under stressesa: 温室培养35 d的烟草植株; b: 干旱胁迫处理35 d后的烟草植株; c: 冷胁迫(10℃ 10 d, –20℃ 35 min)处理后转移至温室培养7 d的烟草植株。NT为对照(转空质粒), 其他为转基因植株。a: Tobacco plants grown in greenhouse; b: Tobacco plants performance at 35 days after drought stress; c: Tobacco plants recovered under room temperature for seven days after cold stress (10℃for 10 days and –20℃ for 35 min). NT indicates the non-transgenic tobacco plant and others are Lr-6-SFT transgenic plants.

图6 转Lr-6-SFT基因烟草及对照植株在干旱和冷胁迫前后的果聚糖(a)、可溶性糖(b)、脯氨酸(c)和丙二醛含量(d)的变化Fig. 6 Changes of fructan (a), soluble sugar (b), proline (c), and MDA (d) contents in non-transgenic and Lr-6-SFT transgenic tobacco plants before and after drought or cold stress treatmentsNT: 转空载体对照; L1~L8: T0代转基因植株。*表示同一处理条件下, 转基因植株与NT达显著差异(P<0.05)。NT: non-transgenic plant; L1–L8: transgenic T0plants; * indicates significant difference between the transgenic plant and NT under the same growing condition (P<0.05).
Lr-6-SFT基因的cDNA序列长度与岳爱琴等[33]克隆的6份普通小麦和10份二倍体小麦的cDNA序列长度一致, 但与Gao等[34]从小麦族中分离到的多个6-SFT基因及其Ns基因组的供体华山新麦草6-SFT基因[12]的cDNA序列长度不同。序列比对结果显示, Lr-6-SFT除了12 bp的插入突变外, 还与华山新麦草的6-SFT存在多处单碱基变异。因此, 推测大赖草的6-SFT基因来自Xm基因组。Del Viso 等[11]报道在雀麦属中6-SFT基因至少存在2个拷贝。大赖草属于异源四倍体物种, 存在Ns和Xm基因组,我们推测其6-SFT基因可能至少存在2个拷贝, 但这一推测还需进一步验证。
3.2Lr-6-SFT表达对转基因烟草果聚糖含量和抗逆性的影响
在本研究中, 转Lr-6-SFT烟草植株表现出明显高于对照植株的抗旱和抗寒能力, 转基因植株叶片的平均果聚糖含量为6.87~9.56 mg g–1, 转Lr-6-SFT基因植株在逆境胁迫后, 果聚糖含量显著增加。这些结果与前人报道的结果相似。Bie等[5]发现转3个小麦果聚糖合成酶基因(Ta6-SFT、Ta1-SST和
Ta1-FFT)单基因的烟草植株的逆境抗性提高了, 并且转基因植株中果聚糖含量为6.1~10.2 mg g–1; 李淑洁等[35]报道, CaMV35S和rd29A启动子驱动的Ta-6-SFT基因转化烟草, 转基因植株果聚糖含量在逆境胁迫条件下显著升高。果聚糖在转基因烟草中的积累表明外源果聚糖合成途径已引入转基因植株中, 这可能也是导致转基因植株抗旱和抗寒性提高的原因。果聚糖的含量受温度、pH、离子强度、底物质量浓度等影响[36]。因此, 在逆境胁迫条件下转基因植株果聚糖含量显著增加, 这可能是逆境条件下植物的底物质量浓度增加所致。
无论在逆境胁迫前或逆境胁迫后, 转Lr-6-SFT基因阳性植株叶片的平均可溶性糖含量均高于对照植株, 这与Tamura等[17,37]的研究结果相一致。转Lr-6-SFT基因的阳性转基因植株可溶性糖含量提高的原因可能是由于在逆境胁迫条件下, 部分果聚糖水解释放出蔗糖、果糖和葡萄糖, 作为液泡的渗透缓冲剂和低温保护剂, 插入细胞质膜防止其渗漏[38]。
在胁迫条件下, 转Lr-6-SFT烟草植株的脯氨酸含量显著高于对照植株。Knipp和Honermeier[18]也曾报道, 转果聚糖合成酶基因的马铃薯在水分胁迫条件下, 植株中脯氨酸含量提高, 但是果聚糖聚合度较高的转基因植株中脯氨酸含量较低。这表明可溶性碳水化合物代谢的改变可能会影响水分胁迫诱导的脯氨酸积累, 但是可溶性碳水化合物代谢和脯氨酸积累之间的关系是复杂的, 尚需深入探讨其机制。
丙二醛是膜脂过氧化的最终分解产物, 与细胞内各种成分发生强烈反应, 导致酶和膜系统严重损伤, 细胞结构生理完整性破坏。因此, 其含量与植物抗逆性显著负相关[39]。与Li等[15]的研究结果一致,本试验也发现在逆境胁迫后, 转基因植株丙二醛的含量比对照植株低; 在干旱和冷胁迫后, 转基因植株丙二醛的含量只是略有增加, 而对照植株的丙二醛含量显著增加。这表明Lr-6-SFT基因合成的果聚糖在烟草的抗旱和抗寒过程中发挥重要作用。
本研究表明, Lr-6-SFT基因的表达及果聚糖在转基因烟草植株中的积累, 使转基因植株中可溶性糖和脯氨酸含量增加。果聚糖、可溶性糖、脯氨酸是植物细胞内重要的渗透调节物质, 它们能够增加细胞质浓度, 降低细胞的冰点, 防止细胞过度脱水,减少环境胁迫对细胞造成的氧化胁迫损伤[19-20]。然而, 积累果聚糖的转基因烟草如何调控植株的生理响应, 有待进一步研究。
4 结论
克隆到大赖草果聚糖合成酶关键基因Lr-6-SFT。该基因属于糖基水解酶第32家族, 能够显著提高转基因烟草的抗旱和抗寒性。本研究结果丰富了作物逆境胁迫抗性基因资源, 对改良作物抗逆性有参考价值。
References
[1] Van Arkel J, Sévenier R, Hakkert J C, Bouwmeester H J, Koops A J, van der Meer I M. Tailor-made fructan synthesis in plants: a review. Carbohydr Polym, 2013, 93: 48–56
[2] Hendry G A, Wallace R K. The origin, distribution, and evolutionary significance of fructans. In: Suzuki M, Chatterton N J, eds. Science and Technology of Fructans, Boca Raton, Florida, USA: The Chemical Rubber Company Press, 1993. pp 119–139
[3] Wiemken A, Frehner M, Keller F, Wagner W. Fructan metabolism, enzymology and compartmentation: current topics in plant biochemistry and physiology. In: Proceedings of the Plant Biochemistry and Physiology Symposium. Columbia, USA: University of Missouri, 1986. pp 17–37
[4] Hincha D K, Livingston D R, Premakumar R, Zuther E, Obel N, Cacela C, Heyer A G. Fructans from oat and rye: composition and effects on membrane stability during drying. Bioch Biophys Acta, 2007, 1768: 1611–1619
[5] Bie X M, Wang K, She M Y, Du L, Zhang S X, Li J R, Gao X, Lin Z S, Ye X G. Combinational transformation of three wheat genes encoding fructan biosynthesis enzymes confers increased fructan content and tolerance to abiotic stresses in tobacco. Plant Cell Rep, 2012, 31: 2229–2238
[6] Ritsema T, Joling J, Smeekens S. Patterns of fructan synthesized by onion fructan:fructan 6G-fructosyltransferase expressed in tobacco BY2 cells: is fructan:fructan 1-fructosyltransferase needed in onion? New Phytol, 2003, 160: 61–67
[7] Sprenger N, Bortlik K, Brandt A, Boller T, Wiemken A. Purification, cloning, and functional expression of sucrose:fructan 6-fructosyltransferase, a key enzyme of fructan synthesis in barley. Proc Natl Acad Sci USA, 1995, 92: 11652–11656
[8] Wei J Z, Chatterton N J. Fructan biosynthesis and fructosyltransferase evolution: expression of the 6-SFT (sucrose:fructan 6-fructosyltransferase) gene in crested wheatgrass (Agropyron cristatum). J Plant Physiol, 2001, 158: 1203–1213
[9] Kawakami A, Yoshida M. Molecular characterization of sucrose:sucrose 1-fructosyltransferase and sucrose:fructan 6-fructosyltransferase associated with fructan accumulation in winter wheat during cold hardening. Biosci Biotech Biochem, 2002, 66: 2297–2305
[10] Tamura K I, Kawakami A, Sanada Y, Tase K, Komatsu T, Yoshida M. Cloning and functional analysis of a fructosyltransferase cDNA for synthesis of highly polymerized levans in timothy (Phleum pratense L.). J Exp Bot, 2009, 60: 893–905
[11] Del Viso F, Puebla A F, Fusari C M, Casabuono A C, Couto A S, Pontis H G, Hopp H E, Heinz R A. Molecular characterization of a putative sucrose:fructan 6-fructosyltransferase (6-SFT) of the
cold-resistant Patagonian grass Bromus pictus associated with fructan accumulation under low temperatures. Plant & Cell Physiol, 2009, 50: 489–503
[12] He X L, Chen Z Z, Wang J W, Li W X, Zhao J X, Wu J, Wang Z H, Chen X H. A sucrose:fructan-6-fructosyltransferase (6-SFT) gene from Psathyrostachys huashanica confers abiotic stress tolerance in tobacco. Gene, 2015, 570: 239–247
[13] 高翔. 小麦族植物果聚糖合成酶基因克隆及功能验证. 中国农业科学院博士学位论文, 北京, 2010
Gao X. Cloning and Functional Analysis of Genes Encoding Fructan Biosynthesis Enzymes in Triticeae Plants. PhD Dissertation of Chinese Academy of Agricultural Sciences, Beijing, China, 2010 (in Chinese with English abstract)
[14] Del Viso F, Casabuono A C, Couto A S, Hopp H E, Puebla A F, Heinz R A. Functional characterization of a sucrose:fructan 6-fructosyltransferase of the cold-resistant grass Bromus pictus by heterelogous expression in Pichia pastoris and Nicotiana tabacum and its involvement in freezing tolerance. J Plant Physiol, 2011, 168: 493–499
[15] Li H J, Yang A F, Zhang X C, Gao F, Zhang J R. Improving freezing tolerance of transgenic tobacco expressing sucrose: sucrose 1-fructosyltransferase gene from Lactuca sativa. Plant Cell Tissue Organ Cult, 2007, 89: 37–48
[16] Wei J Z, Jerry Chatterton N, Larson S R. Expression of sucrose: fructan 6-fructosyltransferase (6-SFT) and myoinositol 1-phosphate synthase (MIPS) genes in barley (Hordeum vulgare) leaves. J Plant Physiol, 2001, 158: 635-643
[17] Tamura K, Sanada Y, Tase K, Kawakami A, Yoshida M, Yamada T. Comparative study of transgenic Brachypodium distachyon expressing sucrose: fructan 6-fructosyltransferases from wheat and timothy grass with different enzymatic properties. Planta, 2014, 239: 783–792
[18] Knipp G, Honermeier B. Effect of water stress on proline accumulation of genetically modified potatoes (Solanum tuberosum L.) generating fructans. J Plant Physiol, 2006, 163: 392–397
[19] Ruelland E, Vaultier M, Zachowski A, Hurry V. Chapter 2 cold signalling and cold acclimation in plants. Adv Bot Res, 2009, 49: 35–150
[20] Szabados L, Savouré A. Proline: a multifunctional amino acid. Trends Plant Sci, 2010, 15: 89–97
[21] Schroeven L, Lammens W, Kawakami A, Yoshida M, Van Laere A, Van den Ende W. Creating S-type characteristics in the F-type enzyme fructan:fructan 1-fructosyltransferase of Triticum aestivum L. J Exp Bot, 2009, 60: 3687–3696
[22] Chatterton N J, Harrison P A, Bennett J H, Asay K H. Carbohydrate partitioning in 185 accessions of Gramineae grown under warm and cool temperatures. J Plant Physiol, 1989, 134: 169–179
[23] Chatterton N J, Harrison P A, Thornley W R, Bennett J H. Structure of fructan oligomers in cheatgrass (Bromus tectorum L.). New Phytol, 1993, 124: 389–396
[24] Mcguire P E, Dvorak J. High salt-tolerance potential in wheatgrasses. Crop Sci, 1981, 21: 702–705
[25] Pilon-Smits E, Ebskamp M, Paul M J, Jeuken M, Weisbeek P J, Smeekens S. Improved performance of transgenic fructanaccumulating tobacco under drought stress. Plant Physiol, 1995, 107: 125–130
[26] Heyer A G, Wendenburg R. Gene cloning and functional characterization by heterologous expression of the fructosyltransferase of Aspergillus sydowi IAM 2544. Appl Environ Microbiol, 2001, 67: 363–370
[27] Chen H, Nelson R S, Sherwood J L. Enhanced recovery of transformants of Agrobacterium tumefaciens after freeze-thaw transformation and drug selection. Biotechniques, 1994, 16: 664–668 [28] Schuler M A, Zielinski R E. Transformation of leaf discs with Agrobacterium. In: Gelvin S B, Schilperoort R A, Verma D P S, eds. Methods in Plant Molecular Biology. San Diego: Academic Press, 1989. pp 145–156
[29] Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning (Third Edn). New York: Cold Spring Harbor Laboratory Press, 1989
[30] Fales F W. The assimilation and degradation of carbohydrates by yeast cells. J Biol Chem, 1951, 193: 113–124
[31] Bates L S, Waldren R P, Teare I D. Rapid determination of free proline for water-stress studies. Plant Soil, 1973, 39: 205–207
[32] Lasseur B, Schroeven L, Lammens W, Le Roy K, Spangenberg G, Manduzio H, Vergauwen R, Lothier J, Prud’ Homme M P, Van den Ende W. Transforming a fructan:fructan 6G-fructosyltransferase from perennial ryegrass into a sucrose:sucrose 1-fructosyltransferase. Plant Physiol, 2009, 149: 327–339
[33] 岳爱琴, 李昂, 毛新国, 昌小平, 李润植, 贾继增, 景蕊莲. 小麦果聚糖合成酶基因6-SFT-A单核苷酸多态性分析及其定位.中国农业科学, 2011, 44: 2216–2224
Yue A Q, Li A, Mao X G, Chang X P, Li R Z, Jia J Z, Jing R L. Single nucleotide polymorphism and mapping of 6-SFT-A gene responsible for fructan biosynthesis in common wheat. Sci Agric Sin, 2011, 44: 2216–2224 (in Chinese with English abstract)
[34] Gao X, She M Y, Yin G X, Yu Y, Qiao W H, Du L P, Ye X G. Cloning and characterization of genes coding for fructan biosynthesis enzymes (FBEs) in triticeae plants. Agric Sci China, 2010, 9: 313–324
[35] 李淑洁, 李静雯, 张正英. Ta6-SFT在烟草中的逆境诱导型表达及抗旱性. 作物学报, 2014, 40: 994–1001
Li S J, Li J W, Zhang Z Y. Expression of Ta6-SFT gene in tobacco induced by drought stress. Acta Agron Sin, 2014, 40: 994–1001 (in Chinese with English abstract)
[36] 文明, 卜利伟, 罗紫韵, 王佳伟, 董芬, 黄雪松. 大蒜蔗糖: 蔗糖1-果糖基转移酶(1-SST)的酶学特征. 中国农业科学, 2015, 48: 334–342
Wen M, Bu L W, Luo Z Y, Wang J W, Dong F, Huang X S. Characteristics of sucrose:sucrose 1-fructosyltransferase in garlic. Sci Agric Sin, 2015, 48: 334–342 (in Chinese with English abstract)
[37] Tamura K, Sanada Y, Tase K, Yoshida M. Fructan metabolism and expression of genes coding fructan metabolic enzymes during cold acclimation and overwintering in timothy (Phleum pratense). J Plant Physiol, 2014, 171: 951–958
[38] 许欢欢, 康健, 梁明祥. 植物果聚糖的代谢途径及其在植物抗逆中的功能研究进展. 植物学报, 2014, 49: 209–220
Xu H H, Kang J, Liang M X. Research advances in the metabolism of fructan in plant stress resistance. Chin Bull Bot, 2014, 49: 209–220 (in Chinese with English abstract)
[39] Venkateswarlu B, Shanker A K, Shanker C, Maheswari M. Crop Stress and its Management: Perspectives and Strategies. Springer Netherlands, 2012
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151218.0915.006.html
Cloning of 6-SFT Gene from Leymus racemosus and Analysis of Tolerance to Drought and Cold Stresses in Transgenic Tobacco
HE Xiao-Lan1, WANG Jian-Wei2, LI Wen-Xu3, CHEN Zhen-Zhen1, ZHAO Ji-Xin1, WU Jun1, WANG Zhong-Hua1, and CHEN Xin-Hong1,*
1Shaanxi Provincial Key Laboratory of Plant Genetic Engineering Breeding / College of Agronomy, Northwest A&F University, Yangling 712100, China;2College of Environment and Life Science, Kaili University, Kaili 556011, China;3Wheat Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, China
Abstract:The fructan biosynthesis enzyme (6-SFT) plays an important role in plant in response to abiotic stresses. In this study, a full-length cDNA encoding sucrose:fructan-6-fructosyltransferase, designated as Lr-6-SFT (GenBank accession No. KT387273), was cloned from Leymus racemosus (2n = 4x = 28, NsNsXmXm) using reverse transcriptase PCR (RT-PCR) and rapid- amplification of cDNA ends (RACE) techniques. The full-length open reading frame comprises 1863 bp and encodes 620 amino acids. The predicted protein structure of the gene contains a conserved fructosyltransferase domain. Multiple sequence alignment and phylogenetic analysis showed that the Lr-6-SFT protein shared high similarity with 6-SFT proteins from Psathyrostachys huashanica, Triticum aestivum, Aegilops searsii, and Hordeum vulgare subsp. vulgare. The Lr-6-SFT gene was transferred into tobacco (Nicotiana tabacum L. cv. W38) via Agrobacterium-mediated transformation. The screened plants were tested by PCR and RT-PCR, and the transgenic tobacco plants exhibited much higher tolerance to drought and cold compared with the non-transgenic plants. Under drought and cold stresses, the Lr-6-SFT expressions were associated with the increased accumulation of stored carbohydrate and proline and the decreased malondialdehyde storage. These results suggest that Lr-6-SFT is a typical member of the glycoside hydrolase 32 (GH32) family and may be linked to enhanced tolerance to drought and cold stresses.
Keywords:6-SFT gene; Drought; Freezing; Leymus racemosus; Physiological indices; Transgenic tobacco
收稿日期Received(): 2015-07-22; Accepted(接受日期): 2015-11-20; Published online(网络出版日期): 2015-12-18.
通讯作者*(Corresponding author): 陈新宏, E-mail: cxh2089@126.com, Tel: 029-87082854
DOI:10.3724/SP.J.1006.2016.00389

