青稞脂质转运蛋白基因blt4.9的克隆及其对非生物胁迫的响应
姚晓华 吴昆仑青海省农林科学院 / 青海省青稞遗传育种重点实验室 / 青海省高原作物种质资源创新与利用国家重点实验室培育基地, 青海西宁8006
青稞脂质转运蛋白基因blt4.9的克隆及其对非生物胁迫的响应
姚晓华吴昆仑*
1青海省农林科学院 / 青海省青稞遗传育种重点实验室 / 青海省高原作物种质资源创新与利用国家重点实验室培育基地, 青海西宁810016
摘要:为了解脂质转运蛋白基因在青稞中的功能, 以青稞品种昆仑12为材料, 利用同源克隆得到青稞blt4.9基因序列(GenBank登录号为KU170187), 该基因的cDNA序列全长720 bp, 开放阅读框长348 bp, 编码115个氨基酸残基, 相对分子质量为11.2 kD, 理论等电点9.04, 不稳定系数为28.41, 是一个稳定的蛋白质。blt4.9编码的蛋白绝大多数属于疏水区, 没有较大的亲水区。序列比对显示, 该基因与大麦blt4.9基因编码蛋白的同源性最高(98.3%)。Real-time PCR分析结果显示, blt4.9基因在20%~30% PEG-6000、4℃以及50 μmol L-1ABA处理后表达量显著增加,且在抗逆性强的青稞品种(旱地紫)中的表达量高于在抗逆性弱的品种(大麻)中, 推测该基因与青稞的抗逆性有关。该研究结果为利用青稞脂质转运蛋白基因改良青稞抗逆性奠定了基础。
关键词:青稞; blt4.9基因; 克隆; 非生物胁迫; 基因表达量
本研究由国家自然科学基金项目(31160284)和国家现代农业产业技术体系建设专项(CARS-05)资助。
This study was supported by the National Natural Science Foundation of China (31160284) and the Special Program of Modern Agro-industry Technology System (CARS-05).
第一作者联系方式: E-mail: yaoxiaohua009@126.com, Tel: 15009717456
青稞(Hordeum vulgare L. var. nudum Hook. f.)为禾本科大麦属, 因其成熟时籽粒内外稃与颖果分离,籽粒裸露, 故称裸大麦[1]。青稞在青藏高原地区利用价值以及独特的营养结构和保健作用使其成为极具开发利用价值的高原特色农作物之一[2]。青稞主要种植于我国西北、西南地区, 特别是西藏、青海、
甘肃南部、四川甘孜和阿坝州、云南迪庆州等高原地区, 种植区域高寒缺氧, 环境恶劣, 降雨量少, 蒸发量大。青稞在如此恶劣的条件下表现出很强的适应性, 说明其基因组中蕴藏了丰富的与抗逆相关的优良基因。开发利用这些优良基因, 不仅对选育青稞抗逆新品种具有重要理论意义, 而且对作物抗胁迫基础研究具有促进作用。
高等植物脂质转运蛋白(lipid-transfer protein, LTP)是一类小分子量碱性单体蛋白质, 主要参与生物膜、角质和脂类的形成, 在离体条件下参与磷脂、脂肪酸、糖脂等在生物膜之间的运输, 在植物生殖发育和信号转导等生物途径中发挥重要作用[3-5]。研究表明, LTP基因易受温度、盐、干旱胁迫、外源ABA、以及损伤等逆境诱导而过量表达, 是植物抵抗逆境胁迫的蛋白[6-8]。Hincha Dirk[9]研究表明, 当植物遭遇低温胁迫时, LTP可以充当调控蛋白, 稳定质膜活性, 抵抗低温伤害。
在大麦中blt (low-temperature responsive barley gene)基因家族是一类低温反应基因[10], 主要包括blt4 (blt4.2、blt4.6和blt4.9)、blt14 (blt14.1和blt14.2)、blt63、blt101 (blt101.2)、blt410和blt80等, 受低温诱导表达[11], 个别基因(如blt4)也同时受干旱和ABA的诱导。研究表明, blt4基因编码的是一种脂质转运蛋白, 可以通过改变质膜的组成来提高膜的冷稳定性, 对调控植物抗寒性具重要作用[12]。本文利用同源克隆技术, 获得了青稞blt4.9基因序列, 通过序列分析和功能验证, 初步认为该基因与非生物胁迫有密切关系, 可为研究青稞blt基因家族奠定基础, 为青稞抗逆基因的深入研究和抗逆育种提供候选基因。
1 材料与方法
1.1供试材料
选用3个青稞品种, 其中来自青海省的昆仑12用于基因克隆和基因功能验证, 该品种由北青1号(母本)和昆仑1号(父本)通过有性杂交选育而成, 中抗条纹病和散黑穗病, 较抗倒伏, 抗落粒性强, 具较强的耐旱、耐寒性; 来自四川省的旱地紫具有较强的抗旱性和耐冷性, 来自甘肃省的大麻, 其抗旱和耐冷性较弱, 这两个品种用于基因功能验证。2013年春, 将3个品种同时种植于青海省农林科学院试验田(青海西宁), 2013年秋收获种子进行室内试验。
1.2目的基因克隆及基因分析
1.2.1引物设计根据GenBank (http://www.ncbi. nlm.nih.gov/nuccore/U63993.1)公布的大麦blt4.9基因序列设计引物P1 (F: 5′-CGGGATCCCGAACCCA ATGGACGCAATAC-3′; R: 5′-CGAGCTCGACTCAT AGGTCCCCTCAAAG-3′), 由生工生物工程(上海)有限公司合成。
1.2.2blt4.9基因的克隆与测序将青稞种子置于铺3层湿润滤纸的培养皿中, 在人工气候箱中培养,温度为(25±1)℃, 光照强度为433 μmol m–2s–1, 每天光照14 h, 其间每天向滤纸加数滴蒸馏水, 浸透滤纸并稍有剩余, 以避免干旱。待幼苗长至约10 cm高时(约2周), 以4℃低温处理12 h, 取其叶片提取植物总RNA, 经PrimeScript II 1st Strand cDNA Synthesis Kit (TaKaRa)试剂盒反转录后用于目标基因的扩增模板。PCR体系为20 μL, 包括10× buffer 2.0 μL, 25 mmol L–1Mg2+1.5 μL, cDNA模板1 μg, 10 mmol L–1dNTP 0.5 μL, Taq DNA聚合酶1 U, 10 μmol L–1上、下游P1引物各0.5 μL。反应参数为94℃ 5 min; 94℃ 1 min, 56 ℃ 1 min, 72℃ 1 min 40 s, 35个循环; 72℃ 延伸8 min。PCR产物经1.0%琼脂糖凝胶电泳检测, 并回收、纯化目的片段, 与pMD20-T载体连接, 连接体系含pMD20-T Vector 1 μL, Insert DNA 0.1~0.3 pmol, 加ddH2O至5 μL; 再加5 μL (等量)的Solution I; 16℃反应30 min。将连接好的重组DNA全量(10 μL)加至100 μL Top10感受态细胞中, 冰浴30 min, 42℃热激45 s,再在冰上放置1 min; 加入800 μL LB液体培养基(无抗生素)。混匀, 37℃、150转 min–1摇床振荡1 h; 取200 μL菌液铺于含Amp (50 μg μL–1)的LB固体培养基上, 37℃平放20 min, 后倒置培养12~14 h。挑取阳性克隆于含有Amp的LB液体培养基上, 37℃、250转min–1摇床振荡8~10 h, 用TIANpure Midi Plasmid Kit试剂盒(天根)提取质粒DNA, 分别通过PCR检测和BamH І、Sac І酶切鉴定, 并将5个克隆送至生工生物工程(上海)有限公司测序。
1.2.3青稞blt4.9基因分析及结构特性预测采用ExPasy网站的在线工具ProtParam (http://expasy.org/tools/protparam.html)计算克隆基因编码蛋白质的等电点和分子量, 预测蛋白的性质和结构;通过蛋白质预测服务器(http://npsa-pbil.ibcp.fr/cgibin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)分析蛋白质二级结构, 通过DNAstar7.1软件的Protean模块, 分别应用Garnier-Robson、Deleage-
Roux、Hydropathy-Kyte-Doolittle、Karplus-Schulz、Emini计算氨基酸残基的特定结构域、蛋白质的二级结构、蛋白质的疏水区和亲水区、蛋白质骨架区的柔韧性以及蛋白质表面的可能性。
1.3blt4.9基因在非生物胁迫下的表达
1.3.1胁迫处理按前述方法在人工气候箱中培养青稞幼苗, 待幼苗长至约10 cm高时(约2周)分别进行干旱(PEG-6000)、低温(4℃)和ABA处理, 胁迫处理期间, 每天向滤纸加相应溶液数滴, 以浸透滤纸并稍有剩余为标准, 尽量减少水势变动。PEG-6000 (0、5%、10%、15%、20%、25%、30%)和ABA (0、5、10、50、100、200、500 μmol L–1)处理1 d 后, 低温处理0、12、24、48 h后, 分别提取叶片总RNA, 用PrimeScriptRT Master Mix (TaKaRa)试剂盒反转录合成cDNA, 用于检测blt4.9基因的表达量。1.3.2引物设计根据测得的blt4.9序列, 在开放阅读框(ORF)内设计荧光定量PCR引物P2 (F: 5′-AAACCGCCTGTGACCT-3′; R: 5′-CACGCCGCTTG CTTGT-3′), 利用稳定表达的18SrRNA作为内参基因, 其引物(P3)序列为F: 5′-AAACCGCCTGTGA CCT-3′; R: 5′-GCTGGAATTACCGCGGCT-3′。引物由生工生物工程(上海)有限公司合成。
1.3.3Real-time PCR反应程序采用Bio-Rad公司iQ5荧光定量PCR仪, 按照生工生物(上海)有限公司的荧光试剂盒Hot Start Fluorescent PCR Core Reagent Kits (SYBR Green I)分别建立目的基因和内参基因的反应体系, 其组成为cDNA 42.5 ng,10 μm L–1P2/P3上下游引物各0.5 μL, Hotstart Fluo-PCR mix 12.5 μL, 加ddH2O至25 μL。反应参数为, 95℃3 min; 95℃ 10 s, 61℃ 30 s, 95℃ 1 min, 61℃ 1 min, 40个循环。
1.3.4基因表达分析采用2-ΔΔCt法计算基因相对表达量[13], 干旱和低温胁迫以旱地紫无胁迫处理的表达量为1; ABA胁迫以0 μmol L–1ABA处理昆仑12的表达量为1。用Stst2与SPSS13.0进行方差分析和多重比较。用Origin 8.0制作柱状图。
2 结果与分析
2.1青稞blt4.9基因的克隆
用设计的特异引物扩增得到一条约800 bp的特异性片段, 与预期结果相符。将该条带纯化后与pMD20-T克隆载体连接, 并转入大肠杆菌, 在含有Amp的LB培养基上通过蓝白斑筛选得到阳性克隆。分别对阳性克隆进行PCR和酶切鉴定, 随机选取5个经鉴定为阳性的克隆进行测序。
测序结果表明, blt4.9基因全长为720 bp, 其ORF为348 bp, 编码115个氨基酸(图1)。氨基酸组分分析结果显示, blt4.9富含Ala (23.48%)、Ser (11.3%)、Val (8.7%)、Gly (8.7%)、Cys (6.96%)、Ile (6.09 %)和Lys (6.09 %), 不含Trp、Glu和Phe。这与已报道的其他冷诱导基因编码蛋白氨基酸组成[14-15]相似。
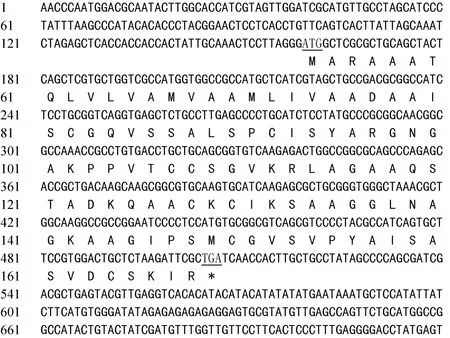
图1 青稞品种昆仑12中blt4.9基因的序列Fig. 1 Sequence of blt4.9 gene from hulless barley variety Kunlun 12
2.2青稞blt4.9基因及其编码产物分析
Blast分析结果表明, 青稞blt4.9基因编码的氨基酸序列与几个大麦blt基因编码产物的同源性很高(图2-A), 均在96%以上, 尤其与大麦blt4.9编码蛋白的同源性最高, 达98.3%; 其次是与硬粒小麦、黑麦(blt4.9)和普通小麦blt4编码蛋白的同源性, 分别为81%、77%和72%; 与粳稻blt4.9编码蛋白的同源性最低, 仅为62%。通过DNAStar得到分离自不同物种blt4.9基因的系统进化树(图2-B)显示了与Blast比对一致的结果, 其原因可能是青稞与大麦同属大麦属, 而且blt家族的基因都报道是低温反应相关的基因。
利用DNAStar7.1软件中的Protean模块计算得知, blt4.9是编码115个氨基酸的小分子蛋白质, 分子量为11.2 kD, 等电点为9.04, 是一个碱性蛋白,其分子量介于9.9~11.9 kU之间, 推测属于LTP I家族[16]。利用软件预测blt4.9编码蛋白的性质和结构,表明该蛋白的不稳定系数为28.41, 说明这是一个稳定的蛋白质; 脂肪系数为92.78, 总平均亲水性为0.597。且蛋白二级结构主要由α-螺旋(48.70%)、β-折叠(7.83%)和无规则卷曲(43.48%)构成(图3); 绝大多数结构位于疏水区, 没有形成较大的亲水区(图4)。
2.3blt4.9基因在逆境胁迫下的表达分析
2.3.1blt4.9在干旱和低温胁迫下的表达以PEG-6000模拟干旱胁迫24 h, 当PEG-6000浓度在5%~15%时, blt4.9表达量虽有提高, 但增加幅度不明显; 随着干旱胁迫程度的增加, 当PEG-6000浓度为20%时基因表达量显著增加(P<0.05); 当25% PEG-6000处理时, 基因表达量达到峰值, 约为对照的53.04倍(旱地紫)和24.18倍(大麻); 当PEG-6000浓度为30%时, 表达量仍显著高于对照。并且在模拟干旱胁迫下, blt4.9基因在抗旱性强的品种(旱地紫)中的表达量显著高于在抗旱性弱的品种(大麻)中(图5-A)。
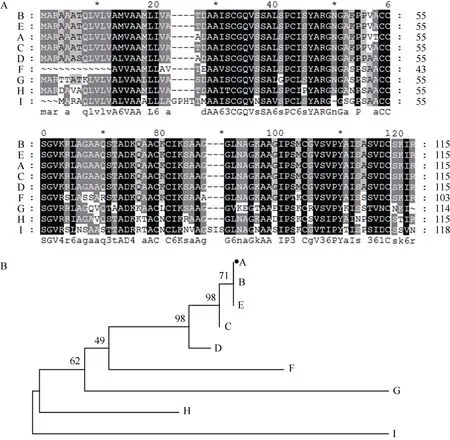
图2 不同物种blt4基因编码氨基酸序列的同源性比较(A)和系统进化树分析(B)Fig. 2 Analysis of amino acid sequences (A) and phylogenetic tree (B) of blt4 genes from different speciesA: 昆仑12 blt4.9; B: 大麦blt4.2 (Q43785); C: 大麦blt4.3 (Q42842); D: 大麦blt4.1 (Q43767); E: 大麦blt4.9 (U63993.1); F: 硬粒小麦blt4 (AEG47274); G: 小麦blt4 (AAV66924); H: 黑麦blt4.9 (ABG27011); I: 粳稻blt4.9 (AAA74624)。A: blt4.9 from Kunlun 12; B: blt4.2 of Hordeum vulgare (Q43785); C: blt4.3 of Hordeum vulgare (Q42842); D: blt4.1 of Hordeum vulgare (Q43767); E: blt4.9 of Hordeum vulgare (U63993.1); F: blt4 of Triticum durum (AEG47274); G: blt4 of Triticum aestivum (AAV66924); H: blt4.9 of Secale careale (ABG27011); I: blt4.9 of Oryza sativa (AAA74624).

图3 SOPMA软件预测blt4.9的二级结构Fig. 3 Secondary structure of the blt4.9 analyzed by SOPMA卷曲、螺旋、延伸链分别用粉、蓝和红线条表示。Curly, helix and extension chain are indicated with pink, blue, and red lines, respectively.

图4 blt4.9编码蛋白质二级结构、疏水性以及抗原分析Fig. 4 Secondary structure, hydrophilicity, and antigenic analysis of blt4.9
4℃低温胁迫0~48 h, 旱地紫和大麻两品种的blt4.9基因表达量都随胁迫时间的延长而显著增加,并且在耐冷性较强的旱地紫中表达量高于在耐冷性较弱的大麻中(图5-B)(P<0.05)。2.3.2blt4.9在ABA胁迫下的表达0~500 μmol L-1ABA胁迫处理下, 随着外源ABA浓度的增加, blt4.9基因表达量呈先增加后降低的趋势, 50 μmol L–1ABA处理的表达量最高, 为对照的8.96倍(P<0.05); 100~500 μmol L–1ABA胁迫下, blt4.9基因表达量均低于对照, 但与对照差异不显著(图6)。
3 讨论
植物在遭遇低温胁迫时, 会诱导多种在转录水平调节的启动子区域有一个cis作用元件(TACCG AC AT)基因表达, 受冷调节信号作用, 称为脱水反应因子DRE[17]。国内外对大麦blt基因家族各成员研究比较多, 何涛和贾敬芬[15]、邓晓青等[18]都克隆了青稞blt14.2基因, 证明该基因是低温专一诱导基因, 在组织中特异性表达, 在植物的抗寒中具有一定的作用。White等[19]用低温感应基因blt4.1作为探
针, 克隆了编码大麦脂质转运蛋白的3个同家族的基因序列gblt4.2、gblt4.6和gblt4.9, 并且发现它们的序列中存在与低温反应元件(accgac a)相似的序列, 但blt4基因家族的耐寒功能是否与低温反应原件有关, 还有待进一步证明。本研究通过克隆青稞blt4.9基因及其序列分析, 也发现一个与上述顺式作用元件相似的低温反应元件CCGAC, 由此推测, 该元件可能与青稞的耐寒性有一定关系。另外, 受实验条件限制, 本试验只测定了抗逆性不同的两个青稞品种中blt4.9基因对4℃低温胁迫的表达反应, 初步结果显示青稞品种耐冷性与blt4.9基因表达呈正相关,这一结果若能经研究确认, 则或许能作为选育青稞耐寒新品种的鉴定方法之一。

图5 blt4.9基因在模拟干旱胁迫下(A)和低温下(B)的表达Fig. 5 Expressions of blt4.9 gene under drought (A) and low temperature (B) stresses以旱地紫无胁迫处理为对照, 不同小写字母表示处理间在0.05水平有显著差异。Handizi without stress treatment was used as the control. Different letters above error bars indicate significant difference among treatments atP<0.05.

图6 blt4.9基因在ABA胁迫下的表达Fig. 6 Expression level of blt4.9 gene under ABA stress以昆仑12无ABA处理为对照, 不同小写表示处理间在0.05水平有显著差异。Kunlun 12 without ABA treatment was used as the control. Different letters above error bars indicate significant difference among treatments at P<0.05.
通过分析青稞品种昆仑12中blt4.9的基因序列,得知该基因编码的蛋白质是一个高度疏水蛋白, 其氨基酸成分和冷诱导基因编码蛋白的氨基酸成分相似; 在二级结构上, blt4.9富含α-螺旋(48.7%)。高比例的α螺旋使blt4.9蛋白在空间上具有很大的柔性和流动性, 有利于在分子内形成氢键, 使蛋白质分子形成任何方向上伸展、拉长及弯曲的无规则卷曲结构, 保护细胞及膜免遭逆境的伤害[20]。Steponkus 等[21]提出一个假设, 即某些亲水脂α螺旋对膜磷脂层内部的弯曲性有很强的作用, 并影响到它们形成六角形II相。用这个内部弯曲假说可以解释抗冻基因编码的亲水性多肽的作用。它们都形成亲水脂性α螺旋的区域, 因此都可能通过影响膜磷脂层内部的弯曲性, 来稳定膜结构以抵抗干旱、冷冻和高盐等引起的细胞脱水而造成的膜伤害。据邓江明等[22]报道, 这些高度的亲水性蛋白质对膜起保护和稳定作用, 从而防止冰冻损伤, 提高植物的抗冻性。但本研究结果与之相反, 青稞blt4.9基因编码的蛋白质绝大多数都位于疏水区, 没有形成较大的亲水区,是一个高度疏水性蛋白质。有研究表明, blt4和植物脂质转运蛋白基因高度同源[23], LTP肽链也具有较大的疏水面, 且LTP在植株体内主要充当防御蛋白,外界温度、干旱等环境因子的变化, 诱导LTP基因的表达[24-25]。本研究通过实时荧光定量PCR分析表明, 青稞blt4.9基因对干旱、低温和ABA均能产生上调表达现象, 说明该基因可能在青稞抗旱、冷冻
胁迫和ABA信号通路中发挥着重要的保护功能; 这一研究结果与李倩等[26]研究的小麦脂质转运蛋白基因TaLTP在ABA、PEG、NaCl及4℃低温胁迫诱导下均上调表达, 可能与抗逆性调节相关的结果类似。另外, 本研究还发现, 在相同的逆境胁迫下抗逆性强的青稞品种, 其blt4.9基因表达量显著高于抗逆性弱的品种, 提示我们可以检测在一定程度的干旱或者冷胁迫下blt4.9基因的表达量来判断青稞的抗逆性。
4 结论
克隆了青稞blt4.9基因(GenBank登录号为KU170187), 该基因对干旱、冷冻以及ABA胁迫均有表达响应, 且在干旱和低温胁迫下抗逆性强的品种表达量显著高于抗逆性弱的品种, 推测该基因在青稞的抗逆性反应中起重要作用。
References
[1] 郭本兆. 青海经济植物志. 西宁: 青海人民出版社, 1987 Guo B Z. Economic Plant Flora of Qinghai. Xining: Qinghai People’s Publishing House, 1987 (in Chinese)
[2] 臧靖巍, 阚建全, 陈宗道, 赵国华. 青稞的成分研究及其应用现状. 中国食品添加剂, 2004, (4): 43–46
Zang J W, Kan J Q, Chen Z D, Zhao G H. Applications of barley study on its components. China Food Additives, 2004, (4): 43–46 (in Chinese with English abstract)
[3] Kader J C. Lipid-transfer proteins in plants. Annu Rev Plant Physiol Plant Mol Biol, 1996, 47: 627–654
[4] Yubero-Serrano E M, Moyano E, Medina - Escobar N, Munoz-Blanco J, Caballero J L. Identification of a strawberry gene encoding a non-specific lipid transfer protein that responds to ABA, wounding and cold stress. J Exp Bot, 2003, 54: 1865–1877
[5] Hsu C Y, Creeeh R G, Johnie J N, Ma D P. Analysis of promoter activity of cotton lipid transfer protein gene LTP6 in transgenic tobacco plants. Plant Sci, 1999, 143: 63–70
[6] Tobias B D, Dansen Jan W, Fred S W, Ronald J W, Arie H, Theodorus W G, Karel W W. High affinity binding of very long chain fatty acyl CoA esters to the peroxisomal nonspecific lipid transfer protein (sterol carrier protein). Biochem J, 1999, 339: 193–199
[7] Wu G, Robertson A J, Liu X, Zheng P, Wilen R W, Nesbitt N T. A lipid transfer protein gene BG-14 is differentially regulated by abiotic stress, ABA, anisomycin, and sphingosine in bromegrass (Bromus inermis). Plant Physiol, 2004, 161: 449–458
[8] Jung S H, Lee J Y, Lee D H. Use of SAGE technology to reveal changes in gene expression in Arabidopsis leaves undergoing cold stress. Plant Mol Biol, 2003, 52: 553–567
[9] Hincha Dirk K. Cryoprotectin: a plant lipid-transfer protein homologue that stabilizes membranes during freezing. In: Philosophical transactions of the Royal Society of London. Series B, Biological Sciences, 2002. pp 909–915
[10] Dunn M A, White A J, Vural S, Hughes M A. Identification of promoter elements in a low-temperature-responsive gene (blt4.9) from barley (Hordeum vulgare L.). Plant Mol Biol, 1998, 38: 551–564
[11] Hughes M A, Durm M A. The molecular biology of plant acclimation to low temperature. J Exp Bot, 1996, 47: 291–305
[12] Dunn M A, Goddard N J, Zhang L, Pearce R S, Hughes M A. Low-temperature-responsive barley genes have different control mechanisms. Plant Mol Biol, 1994, 24: 879–888
[13] Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR. Nucl Acids Res, 2001, 4: 29–45
[14] Thomashow M F. Arabidopsis thaliana as a model for studying mechanisms of plant cold tolerance. In: Meyerowitz E, Somerville C, eds. Arabidopsis. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 1994. pp 807–834
[15] 何涛, 贾敬芬. 青稞hbltl4.2基因的克隆及功能分析. 作物学报, 2009, 35: 295–300
He T, Jia J F. Cloning and function analysis of hblt14.2 gene in highland barley (Hordeum vulagare L. var. nudum Hook. f.). Acta Agron Sin, 2009, 35: 295–300 (in Chinese with English abstract)
[16] 李长生, 赵传志, 李爱芹, 李兴圃, 赵光敬, 王兴军. 植物脂质转运蛋白的研究. 山东农业科学, 2009, (8): 15–17
Li C S, Zhao C Z, Li A Q, Li X P, Zhao G J, Wang X J. Study of plant transfer proteins. Shandong Agric Sci, 2009, (8): 15–17 (in Chinese with English abstract)
[17] 郭晋艳, 郑晓瑜, 邹翠霞. 李秋莉. 植物非生物胁迫诱导启动子顺式元件及转录因子研究进展. 生物技术通报, 2011, (4): 16–18
Guo J Y, Zheng X Y, Zou C X, Li Q L. Research progress of cis-elements of abiotic stress inducible promoters and associated transcription factors. Biotechnol Bull, 2011, (4): 16–18 (in Chinese with English abstract)
[18] 邓晓青, 姚晓华, 吴昆仑, 迟德钊. 青稞LTP蛋白基因blt14.2的克隆及其在低温下的表达. 中国农业大学学报, 2012, 17(2): 18–24
Deng X Q, Yao X H, Wu K L, Chi D Z. Isolation of a blt14.2 gene encoding LTP protein of hulless barley and its expression in low temperature. J China Agric Univ, 2012, 17(2): 18–24 (in Chinese with English abstract)
[19] White A J, Dunn A M, Brown K, Hughes M A. Comparative analysis of genomic sequence and expression of a lipid transfer protein gene family in winter barley. J Exp Bot, 1994, 45: 1885–1892
[20] 王艇, 苏应娟, 刘良式. 植物低温诱导蛋白和低温诱导基因的表达调控. 武汉植物学研究, 1997, 15: 80–90
Wang T, Su Y J, Liu L S. Plant low-temperature-induced protein and regulation of the expression of low-temperature-induced gene. J Wuhan Bot Res, 1997, 15: 80–90 (in Chinese with English abstract)
[21] Steponkus P L, Uemura M, Joseph R A, Gilmous S J, Thomashow M F. Mode of action of the CoR15a gene on the freezing tolerance of Arabidopsis thaliana. Proc Natl Acad Sci USA, 1998, 95: 14570–14575
[22] 邓江明, 简令成. 植物抗冻机理研究新进展: 抗冻基因表达及其功能. 植物学通报, 2001, 18: 521–530
Deng J M, Jian L C. Advances of studies on plant freez-
ing-tolerance mechanism: freezing tolerance gene expression and its function. Chin Bull Bot, 2001, 18: 521–530 (in Chinese with English abstract)
[23] Hughes M A, Dunn M A, Pearce R S, White A J, Zhang L. An abscisic-acid-responsive, low temperature barley gene has homology with a maize phospholipid transfer protein. Plant Cell & Environ, 1992, 15: 861–865
[24] Soufleri I A, Vergnolle C, Miginiac E, Kader J C. Germination-specific lipid transfer protein cDNA in Brassica napus L. Planta, 1996, 199: 229–237
[25] Liu K H, Lin T Y. Cloning and characterization of two novel lipid transfer protein I genes in Vigna radiate. DNA Seq, 2003, 14: 420-426
[26] 李倩, 王景一, 毛新国, 李昂, 高丽锋, 刘惠民, 景蕊莲. 小麦脂质转运蛋白基因TaLTP克隆及功能分析. 作物学报, 2015, 41: 673–682
Li Q, Wang J Y, Mao X G, Li A, Gao L F, Liu H M, Jing R L. Cloning and functional analysis of lipid transfer protein gene TaLTP in wheat. Acta Agron Sin, 2015, 41: 673–682 (in Chinese with English abstract)
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151218.0915.014.html
Isolation of blt4.9 Gene Encoding LTP Protein in Hulless Barley and Its Response to Abiotic Stresses
YAO Xiao-Hua and WU Kun-Lun*
Qinghai Academy of Agriculture and Forestry Sciences / Qinghai Provincial Key Laboratory of Hulless Barley Genetics and Breeding / State Key Laboratory Breeding Base for Innovation and Utilization of Plateau Crop Germplasm, Xining 810016, China
Abstract:Higher plant lipid transfer protein (LTP) is a class of small molecular weight alkaline single protein that can transfer phospholipids between biomembrane and form the biomembrane in cells. The objective of this study was to understand the function of LTP gene in hulless barley (Hordeum vulgare L. var. nudum Hook. f.). The cDNA sequence of the LTP gene, blt4.9 (Gen-Bank accession number KU170187), was cloned from hulless barley variety Kunlun 12. The full length of blt4.9 cDNA is 720 bp including 348 bp of open reading frame and encodes 115 amino acids. The encoding product is a stable protein with a molecular weight of 11.2 kD, theoretical pI of 9.04, and instability coefficient of 28.41. This protein is rich in Gly, Ala, Leu, and Val amino acids excluding Trp, Glu, and Phe and similar to proteins encoded by other LTP genes. Sequence alignment indicated high similarity (98.3%) of protein encoded by blt4.9 from hulless barley and barley (Hordeum vulgare L.). The Real-time PCR assay showed that blt4.9 was up-regulated by 20–30% PEG-6000, 4ºC and 50 μmol L-1ABA and the expression level was higher in the most tolerant variety Handizi than in the most susceptible variety Dama, indicating a possible relationship between stress tolerance and blt4.9 in hulless barley. These results provide basic information in the utilization of LTP genes to improve hulless barley tolerance to abiotic stresses.
Keywords:Hulless barley; blt4.9; Isolation of gene; Abiotic stresses; Gene expression level
收稿日期Received(): 2015-05-29; Accepted(接受日期): 2015-11-20; Published online(网络出版日期): 2015-12-18.
通讯作者*(Corresponding author): 吴昆仑, E-mail: wklqaaf@163.com, Tel: 13997276769
DOI:10.3724/SP.J.1006.2016.00399

