金属离子对4-氨基安替比林与牛血清白蛋白相互作用的影响
高宗华,付彩霞,王 雪,张怀斌
(滨州医学院药学院,山东烟台264003)
金属离子对4-氨基安替比林与牛血清白蛋白相互作用的影响
高宗华*,付彩霞,王雪,张怀斌
(滨州医学院药学院,山东烟台264003)
摘要:采用荧光法研究了金属离子Ca2+、Zn2+和Mg2+存在下4-氨基安替比林( 4-AAP)与牛血清白蛋白( BSA)的相互作用.结果表明,金属离子存在时,4-AAP对BSA的猝灭常数减小,但猝灭机制仍旧为静态猝灭,4-AAP 与BSA之间的结合常数( KA)及结合位点数( n)均增大,分析认为,金属离子在二者的结合作用中起了“离子架桥”的作用.
关键词:4-氨基安替比林;牛血清白蛋白;相互作用;金属离子
4-AAP作为原料中间体,被用于生产镇痛、消炎、抗菌类的新型药物[1].血清白蛋白是生物体内血浆中含量最丰富的蛋白质,对生命活动有着非常重要的作用,是运输内源及外源性物质的重要载体[2].动物体的正常生理活动需要大量金属离子的参与,我们在前期的研究中发现金属离子对药物小分子和蛋白质的作用会产生不同的影响[3-4].鉴于此,本文作者在模拟生理条件下,用荧光光谱法研究了钙、镁、锌3种金属离子对4-AAP与BSA相互作用的影响,以期为4-AAP在体内的转运、代谢等研究提供一定的参考信息.
1 实验部分
1.1仪器与试剂
LS-55荧光分光光度计(美国,PE公司),TU-1901双光束紫外-可见分光光度计(北京普析仪器公司),电热恒温水浴锅(龙口市先科仪器公司),BP211D电子分析天平(上海精密仪器厂).BSA(生化试剂,纯度>98%),4-AAP购自国药集团,为分析纯,氯化钠、Tris试剂、盐酸、氯化锌、氯化钙、氯化镁均为分析纯.用0.05 mol·L-1pH= 7.40的Tris-HCl缓冲溶液(含0.1 mol·L-1NaCl)配制BSA溶液,BSA浓度为1.0×10-6mol·L-1,用蒸馏水配制浓度为1.16×10-3mol·L-1的4-AAP储备液;配制浓度分别为1.00×10-4mol·L-1的ZnCl2、MgCl2、CaCl2溶液.实验用水为二次蒸馏水.
1.2荧光光谱测定方法
292 K时,移取3.0 mL BSA溶液于石英比色皿中,逐次加入10 uL的4-AAP溶液,摇匀,静置5 min.设定激发波长为280 nm,测定体系的荧光光谱,记录最大发射波长处的荧光强度.
分别移取1.5 mL的BSA和1.5 mL的各种金属离子(混合后BSA的浓度为5.00×10-7mol·L-1;各种金属离子的浓度为5.00×10-5mol·L-1)加入石英比色皿中,摇匀,静置5 min,然后逐次加入10 uL的4-AAP溶液,摇匀,静置5 min,测定混合体系的荧光光谱,考查金属离子对4-AAP与BSA结合作用的影响.
2 结果与讨论
2.1 4-AAP对BSA荧光光谱的影响
蛋白质结构中因含有色氨酸、酪氨酸和苯丙氨酸残基而具有内源荧光.通过荧光光谱的变化可以反映小分子、金属离子等物质与蛋白质相互作用的情况[5].图1为在292 K时,4-AAP对BSA荧光光谱的影响.BSA的最大发射峰位于348.5 nm附近处.随着4-AAP浓度的增大BSA的荧光发射峰强度明显减弱,发生荧光猝灭;最大发射峰位蓝移到346.5 nm处,蓝移2 nm.表明4-AAP与BSA发生了相互作用,4-AAP的加入有可能改变了氨基酸残基周围的微环境[5].
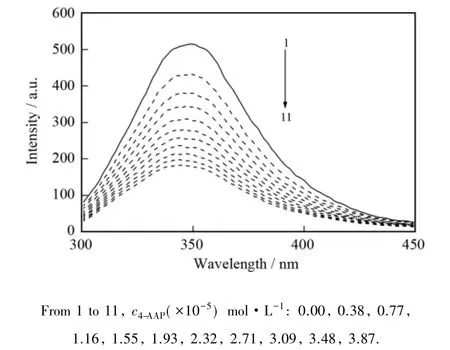
图1 4-AAP对BSA荧光光谱的影响Fig.1 Effect of 4-AAP on fluorescence spectra of BSA
蛋白质的荧光猝灭机制主要包括动态猝灭和静态猝灭,根据Stern-Volmer方程[6]F0/F = 1 + KSV[c]= 1 + Kqτ0[c]作出4-AAP对BSA荧光猝灭的Stern-Volmer曲线,如图2所示,求出292 K时猝灭常数KSV=4.75×104L·mol-1和猝灭速率常数Kq=4.75×1012L·mol-1·s-1.
Kq值远大于各类猝灭剂对生物大分子的最大扩散碰撞猝灭常数2.0×1010L·mol-1·s-1[6],由此推断4-AAP对BSA的荧光猝灭作用主要是静态猝灭.

图2 4-AAP对BSA的Stern-Volmer曲线Fig.2 Stern-Volmer curves for 4-AAP-BSA
2.2 4-AAP与BSA的结合作用
在静态猝灭中,小分子与蛋白质的结合作用可以用公式lg( F0/F-1) = lgKA+ nlg[c]加以描述[7],式中KA为4-AAP与白蛋白分子的结合常数,n为结合位点数.在292 K时,以lg( F0/F-1)对lg[c]作图(图3).由直线的斜率及截距分别求得反应的结合常数KA及结合位点数n,见表1. 2.3不同金属离子对4-AAP与BSA相互作用的影响

图3 lg[c]与lg( F0/F-1)的关系Fig.3 Plot of lg[c]versus lg( F0/F-1)
固定BSA与金属离子( Ca2+、Zn2+、Mg2+)的浓度,分别加入不同浓度的4-AAP,在292 K时考查金属离子对4-AAP与BSA相互作用的影响,结果见表1.表1显示,在Ca2+、Zn2+和Mg2+存在下,4-AAP对BSA的荧光猝灭作用略有减小,但静态猝灭仍是导致4-AAP对BSA荧光猝灭的主要成因; 4-AAP与BSA的结合位点数及结合常数增大,说明金属离子首先和BSA发生一定程度的络合,加入4-AAP分子后,4-AAP分子通过金属离子增强了与BSA的结合作用,金属离子起到了“离子架桥”的作用[8].

表1 292 K时金属离子存在下4-AAP与BSA作用的参数Table 1 Quenching reactive parameters of 4-AAP and BSA in the presence of metal ions at 292 K
3 结论
采用荧光光谱法探讨了3种金属离子对4-氨基安替比林和BSA相互作用的影响.金属离子存在下,4-AAP对BSA的荧光猝灭机制仍为静态猝灭;4-AAP与BSA的结合常数和结合位点数均增大,金属离子的参与促进了4-AAP与BSA的结合作用.该研究对于小分子在体内的运输过程及作用机理具有一定的意义.
参考文献:
[1]YU X Y,LIAO Z X,JIANG B F,et al.The interaction between 4-aminoantipyrine and bovine serum albumin: Multiplespectroscopic and molecular docking investigations [J].Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2014,133: 372-377.
[2]CAO S H,JIANG X Y,CHEN J W.Effect of zinc ( II) on the interactions of bovine serum albumin withfiavonols bearing different number of hydroxyl substituent on B-ring [J].J Inorganic Biochem,2010,104( 2) : 146-152.
[3]张怀斌,荣先国.三价铁对灯盏花素与牛血清白蛋白相互作用的影响[J].化学研究,2013,24( 3) : 224-227.
[4]张怀斌,马丽英,刘向勇,等.Eu(Ⅲ)、Cu(Ⅱ)对灯盏花素与BSA作用的扰动[J].化学试剂,2012,34 ( 12) : 1068-1072.
[5]ZHANG P J,LAN P,MA Y N,et al.Spectroscopic investigation on the interaction of Cr( VI) with bovine serum albumin [J].J biochem mole toxicol,2012,26( 2) : 54 -59.
[6 ]CHI Z X,LIU R T.Phenotypic characterization of the binding of tetracycline to human serum albumin [J].Biomacromolecules,2011,12( 1) : 203-209.
[7]付彩霞,王晓艳,高宗华.盐酸苯肼与BSA的相互作用[J].化学研究与应用,2013,25( 5) : 642-646.
[8]刘雪峰,李磊,方云,等.中药成分七叶内酯-BSA-金属离子的相互作用[J ].化学研究与应用,2007,19 ( 2) : 145-149.
[责任编辑:任铁钢]
The effect of metal ions on the interaction between 4-aminoantipyrine and bovine serum albumin
GAO Zonghua*,FU Caixia,WANG Xue,ZHANG Huaibin
( Pharmaceutical College,Binzhou Medical University,Yantai 264003,Shandong,China)
Abstract:The interaction between bovine serum albumin ( BSA) and 4-Aminoantipyrine( 4-AAP) was investigated using fluorescence spectroscopy in the presence of metal ions ( Ca2+,Zn2+and Mg2+).The results suggested that the quenching constant decreased in the presence of metal ions,but the quenching mechanism was not changed.The binding constants ( KA) and numbers of binding site ( n) increased.The anslysis indicated that the effect of metal ions on the interaction between 4-AAP and BSA was related to the metal ions function as the bridge ions.
Keywords:4-aminoantipyrine; bovine serum albumin; interaction; metal ions
作者简介:高宗华( 1966-),女,教授,研究方向为有机合成和光谱分析.*通讯联系人,E-mail: gzh3308@ 163.com.
基金项目:山东省教育厅科技计划项目( J08LG15).
收稿日期:2015-08-15.
中图分类号:O657.3
文献标志码:A
文章编号:1008-1011( 2016) 01-0051-03

