计算机模拟HsRAD51蛋白与多肽BRC4分子对接
刘广斌,赵东欣,马 丽,姜曰水,卢 奎,3*
( 1.河南工业大学化学化工学院,河南郑州450001; 2.曲阜师范大学生命科学学院,山东曲阜273165; 3.河南工程学院材料与化工学院,河南郑州450007)
计算机模拟HsRAD51蛋白与多肽BRC4分子对接
刘广斌1,赵东欣1,马丽1,姜曰水2,卢奎1,3*
( 1.河南工业大学化学化工学院,河南郑州450001; 2.曲阜师范大学生命科学学院,山东曲阜273165; 3.河南工程学院材料与化工学院,河南郑州450007)
摘要:研究使用ZDOCK算法进行HsRAD51蛋白与多肽BRC4分子对接的准确性.采用Accelrys Discovery Studio 3.5软件计算平台,使用基于快速傅立叶转换的ZDOCK分子对接程序进行蛋白HsRAD51与乳腺易感基因BRCA2的重复基元BRC4的分子对接,然后使用RDOCK程序进行结果优化,最后将通过分子对接得到的几个蛋白-多肽复合物的三级结构与文献报道的通过X射线测得的蛋白HsRAD51与BRC4复合物的准确结构进行叠合比较,结果发现其中一些结构的叠合效果较好,碳链骨架叠合的RMSD最小的为0.034 4 nm.推测使用ZDOCK分子对接程序来进行HsRAD51蛋白与多肽的对接,具有较高的准确性.该结果为今后研究HsRAD51蛋白与BRCA2其他重复基元的分子对接以及相互作用提供了重要依据.
关键词:HsRAD51; BRC4; BRCA2; ZDOCK;分子对接
BRCA2蛋白与抑癌基因中的RAD51、P53蛋白等具有较强的相互作用,与多种肿瘤的发生具有较强的相关性[1-2];同时BRCA2蛋白是修复DNA损伤的一种关键蛋白,可以参与多种基因表达的调节[3-5].人的BRCA2蛋白与其他哺乳动物的BRCA2蛋白具有很高的同源性,其中包括8个序列高度保守的重复基元( BRC),每个重复基元有35个左右的氨基酸残基.研究BRCA2蛋白中的重复基元与功能分子之间的相互作用,可以为我们探索肿瘤的发病机理以及开发肿瘤多肽类药物提供重要的指导[6-7].
目前,BRCA2蛋白的8个BRC重复基元以及重复基元的突变体中只有BRC4与HsRAD51蛋白的晶体结构通过X射线的方法被准确测定[8].本文作者利用已被确定具体结构的HsRAD51蛋白和BRC4复合物的3D结构,从中提取出HsRAD51蛋白结构模型和多肽BRC4结构模型,使用ZDOCK来计算两者的结合模式[9],并将计算的结果使用RDOCK算法进行优化,最后将所得复合物结构与真实晶体结构进行结构叠合比较,结果发现使用分子对接得到的复合物结构可以与已知的晶体复合物结构进行很好的叠合.
1 计算模拟实验部分
1.1蛋白与多肽结构的处理
从蛋白质晶体数据库中下载HsRAD51-BRC4的蛋白复合物结构( PDB: 1N0W),然后在Accelrys Discoverys Studios 3.5平台下对复合物结构进行处理,删去其中的水分子以及小分子配体化合物,使用系统平台自带的Prepare protein工具对其进行蛋白结构优化,最后将优化后晶体结构中HsRAD51蛋白三级结构和BRC4的三级结构提取出来.
1.2分子对接
使用Accelrys Discoverys Studios 3.5平台自带的ZDOCK模块进行受体HsRAD51蛋白与配体BRC4多肽的分子对接.在计算参数的设置中欧拉转角为6°,设置结合模式“Top Poses”为2 000,“RMSD Poses”参数为1.0 nm,结合构型聚类的最大数目“Maxium Number of Clusters”参数为100,其他参数均使用缺省值,然后进行计算,得到HsRAD51蛋白与BRC4可能的结合位点图(图1).从图1中可以看出ZDOCK计算出两者有很多种可能的对接模式.
图1 HsRAD51蛋白与BRC4结合位点图Fig.1 The binding sites image of HsRAD51 and BRC4
ZDOCKScore得分越高,说明对接模式可能越接近真实情况.选取其中ZDOCKScore超过15分的结合位点,然后使用RDOCK程序进行进一步的能量优化.E_RDOCK值越低说明RDOCK的对模型的评分越高,很有可能与真实的对接构象比较接近.结果发现ZDOCKScore排名前五个结合模式Pose1、Pose2、Pose3、Pose4、Pose5经过RDOCK优化后按照能量稳定性排名结果分别变为4、3、9、1、2(表1),也就是说结合模式的排名发生了比较大的变化.

表1 RDOCK优化后的部分结合位点( ZDOCKScore>15)的E_RDOCKTable 1 The E_RDOCK of some binding sites( ZDOCKScore>15) refined by RDOCK
1.3模拟结构与真实构象的叠合
将RDOCK优化后的32种结合模式与真实蛋白-多肽复合物的构象1N0W使用superimpose程序进行叠合比较(图2),结果发现13种结合模式主碳链均可以与真实蛋白-多肽复合物1N0W进行很好的叠合,主碳链叠合RMSD均小于0.1 nm(表2).从图2中看出13种结合模式与真实的复合物构象的叠合程度较高,一些结合模式有较大的偏差.

图2 RDOCK优化后的32种结合模式和1N0W叠合图Fig.2 The superimpostion image of 1N0W and 32 kinds of binding models refined by RDOCK
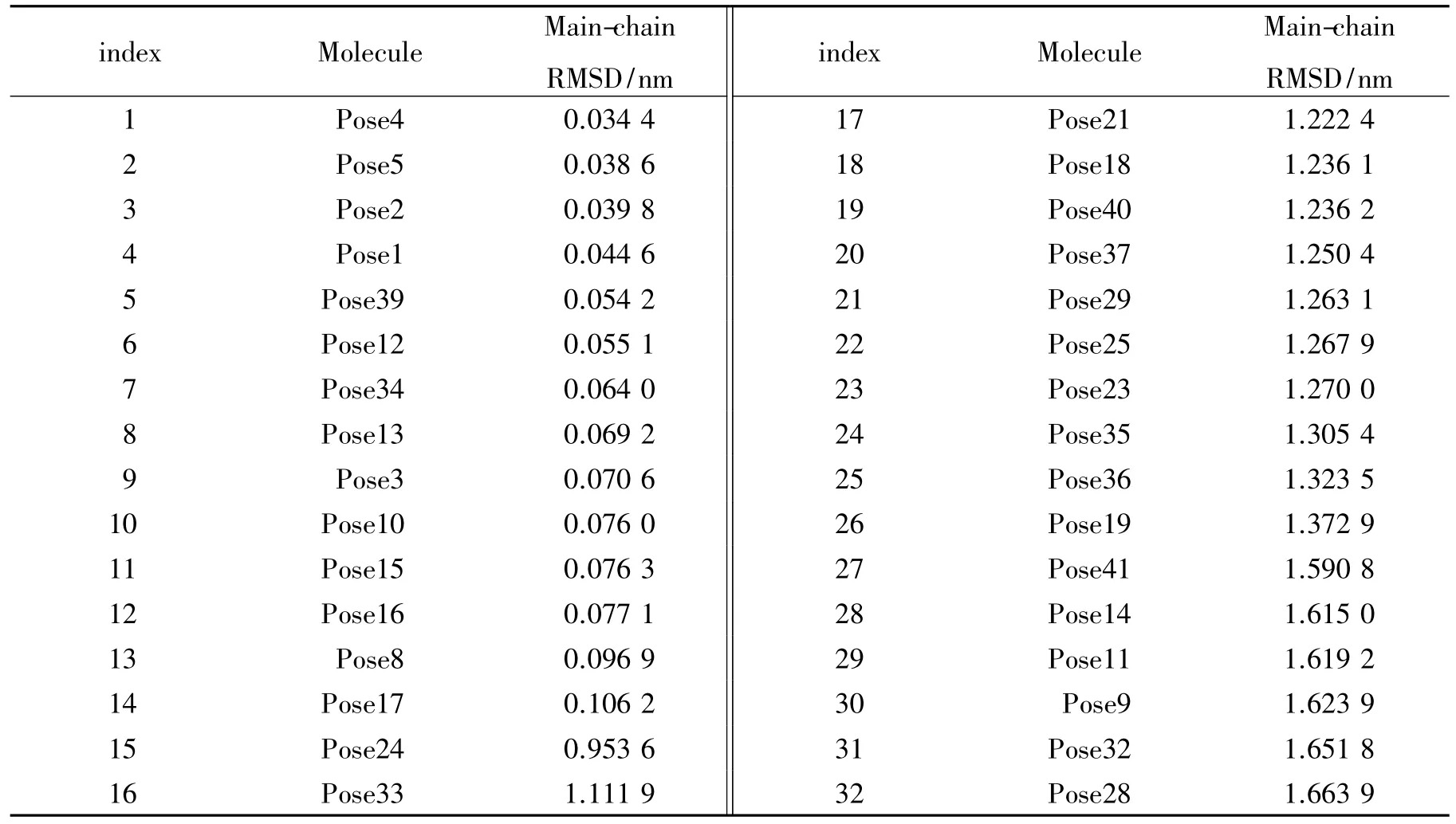
表2 RDOCK优化后的32种结合模式和1N0W主碳链叠合比较结果Fig.2 The results of main-chain superimposition between 1N0W and 32 kinds of binding models refined by RDOCK
2 结果与讨论
2.1使用计算模拟HsRAD51蛋白与多肽BRC4分子对接的准确性
ZDOCK是基于傅立叶快速转换技术( FFT)的大分子刚性对接算法,并且充分考虑了配体分子的柔性,在大分子-大分子的分子对接中具有很高的准确性;而RDOCK算法是基于CHARMM力场能量的最小化以及使用有静电势能和去溶剂化能组成的自由能打分函数来预测结合位点准确性的方法[10].)从实验中我们发现,ZDOCK的得分值最高的复合物结构( Pose1)与1N0W的结构差异较小,是接近真实构象的结构;但经过RDOCK优化后所得的复合物结构( Pose4)与1N0W叠合的RSMD最小,是所得的最接近真实构象的结构.也就是说,使用RDOCK程序来进一步优化ZDOCK分子对接得到模型可以进一步提高分子对接预测的可靠性.
另外在模拟实验中,我们使用ZDOCK进行蛋白质与多肽的分子对接,然后使用RDOCK进行大分子分子对接结果的优化,结果发现13种结合模式的碳骨架都与已知的晶体结构1N0W的叠合RMSD均小于0.1 nm,也就是说使用ZDOCK来进行重复基元BRC4与HsRAD51蛋白的分子对接然后使用RDOCK程序进行进一步优化的模拟方法具有较高的准确性.
2.2使用计算模拟HsRAD51蛋白与多肽BRC4分子对接对其他BRC分子研究的意义
目前,关于BRCA2的重复单元与抑癌基因HsRAD51以及P53的研究,主要是通过氨基酸饱和突变[8]、酶联免疫吸附实验( Elasa)[11-12]、嵌合体[13]、免疫共沉淀[14]、三维电镜结构分析[15]等实验方法进行,而本实验的结果为使用计算模拟研究包括BRC4在内的BRCA2重复基元与HsRAD51以及P53的相互作用机制提供了分子对接依据.
BRCA2的8个重复基元的氨基酸序列如下[6]:

由于各个重复基元与BRC4的序列一致性分别为: 28.6%、34.3%、45.7%、100.0%、25.7%、34.3%、37.1%、42.9%.蛋白质三级结构的保守性远远超过一级序列的保守性[16],因此各个重复基元可能与重复基元BRC4有着非常相近的三级结构.由于序列一致性绝大多数都大于30%,我们可以通过蛋白质同源建模的方法来使用BRC4的三级结构作为模版来建立其他重复基元的三级结构,然后将建立的结构模型进行优化后使用ZDOCK算法与蛋白进行分子对接,找到最可能的结合模式,并进行进一步的虚拟突变筛选,最后再通过化学和生物实验进行验证,进而为发现BRCA2重复基元以及突变体与蛋白的真正结合模式、作用机制以及真实构象提供基础.
3 结论
模拟实验的结果表明,使用ZDOCK及RDOCK算法进行HsRAD51蛋白与BRCA2重复基元BRC4的分子对接进行结合模式的预测具有较高的准确性,可以用这种方法预测HsRAD51蛋白与BRCA2其他重复基元的结合模式.
参考文献:
[1]RAYMOND J S,HOGUEC J R.Multiple primary tumours in women following breast cancer,1973-2000 [J].Brit J Cancer,2006,94: 1745-1750.
[2]STEINMANN D,BREMER M,RADESD,et al.Mutations of the BRCA1 and BRCA2 genes in patients with bilateral breast cancer [J ].Brit J Cancer,2001,106: 1460-1463.
[3 ]GUDMUNTSDOTTIR K,ASHWORTH A.The roles of BRCA1 and BRCA2 and associated proteins in the maintenance of genomic stability [J ].Oncogene,2006,25 ( 43) : 5864-5874.
[4 ]ROSENTHAL C K.BRCA2 in abscission [J ].Nat Cell Biol,2012,14( 8) : 792-792.
[5]KOTEJARAI Z,ELES R A.BRCA1,BRCA2 and their possible function in DNA [J].Brit J Cancer,1999,81: 1099-1102.
[6]BIGWELL G,MICHAELR.STRATTON M R,et al.The BRC repeats are conserved in mammalian [J].Hum Mol Genet,1997,6: 53-58.
[7]CARREIRA A,HILARIO J,et al.The BRC Repeats of BRCA2 Modulate the DNA-Binding Selectivity of RAD51 [J].Cell,2009,136( 6) : 1032-1043.
[8 ]PELLEGRINIL,YU D S,LO T,et al.Insights into DNA recombination from the structure of a HsRAD51-BRCA2 complex [J].Nature,2002,420: 287-293.
[9]CHEN R,LI L,WENG Z P.ZDOCK: an initial-stage protein-docking algorithm [J].Proteins,2003,52( 1) : 80-87.
[10]QASIM M A,VANETTEN R L,YEH T,et al.Despite having a common P1 Leu,eglin C inhibits alpha-lytic proteinase a million-fold more strongly than does turkey ovomucoid third domain [J ].Biochemistry,2006,45 ( 38) : 11342-11348.
[11 ]OCHIAI K,YOSHIKAWA Y,YOSHINATSU K.Valine 1532 of human BRC repeat 4 plays an important role in the interaction between BRCA2 and RAD51 [J ].FEBS Lett,2011,585( 12) : 1771-1777.
[12]YOSHIKAWA Y,OCHIAI K,MORIMASTU M.Effects of the missense mutations in canine BRCA2 on BRC repeat 3 functions and comparative analyses between canine andhuman BRC repeat 3 [J ].PLoS One,2012,7( 10) : e45833.
[13]NOMME J,RENODON C A,ASONOMI Y.Design of potent inhibitors of human RAD51 recombinase based on BRC motifs of BRCA2 protein: modeling and experimental validation of a chimera peptide [J].J Med Chem,2010,53( 15) : 5782-5791.
[14 ]CHALERMRUJINANANT C,MICHOWSKI W,SITTITHUMCHAREE G,et al.Cyclin D1 promotes BRCA2-Rad51 interaction by restricting cyclin A/B-dependent BRCA2 phosphorylation [J].Oncogene,2015: 1-9.
[15]SHAHID T,SOROKA J,KONG E,et al.Structure and mechanism of action of the BRCA2 breast cancer tumor suppressor [J ].Nat Struct Mol Biol,2014,21: 962-968.
[16]LESK A M,CHOTHIA C.How different amino acid sequences determine similar protein structures: the structure and evolutionary dynamics of the globins [J].J Mol Bio,1980,136( 3) : 225-270.
[责任编辑:吴文鹏]
Computer simulation of the molecular docking between HsRAD51 and BRC4
LIU Guangbin1,ZHAO Dongxin1,MA Li1,JIANG Yueshui2,LU Kui1,3*
( 1.School of Chemistry and Chemical Engineering,Henan University of Technology,Zhengzhou 450051,Henan,China;
2.School of Life Science,Qufu Normal University,Qufu 273165,Shandong,China;
3.School of Material and Chemical Engineering,Henan Institute of Engineering,Zhengzhou 450057,Henan,China)
Abstract:The accuracy of the molecular docking between HsRAD51 and BRC4 was studied by using the procedure ZDOCK.Based on the software Accelrys Discovery Studio 3.5 computing platform,the molecular docking between HsRAD51 and BRC4 was carried out,then the docking results were refined by the procedure RDOCK.In the process of superimposing those binding modes with the real conformation confirmed by X-ray,it was found that some binding modes were consistent with the reference complex conformation and the minimal RMSD of main-chain superimposition was 0.034 4 nm.It indicated that the molecular docking using ZDOCK had a better accuracy.Those results are significant for studying the molecular docking and interaction between HsRAD51 and other BRCA2 repeat motifs in the future.
Keywords:HsRAD51; BRC4; BRCA2; ZDOCK; moleculardocking
作者简介:刘广斌( 1983-),男,硕士生,主要从事化学生物学方面的研究.*通讯联系人,E-mail: lukui126@ 126.com.
基金项目:国家自然科学基金( 21172054,21572046,21301050).
收稿日期:2015-10-15.
中图分类号:O629.7
文献标志码:A
文章编号:1008-1011( 2016) 01-0097-05

