《物质结构与性质》热点聚焦
山东 王 波
《物质结构与性质》热点聚焦
山东 王 波
《物质结构与性质》模块在高考中一般以选考题的形式呈现,此题主要通过拼盘式设问,综合考查物质结构与性质内容。分析近几年高考试题,简答题是此题设问的热点,既能考查考生对物质结构理论的理解能力,又能考查考生的文字(或图形、符号、表达式)表达能力,已成为此题的失分点和区分点。现结合近几年高考试题,对《物质结构与性质》模块的简答题进行归纳,并对教材知识进行解读。
一、原子结构与性质
1.元素电离能比较
例1 (2011福建,改编)C、N、O三种元素第一电离能从大到小的顺序是________,其原因为__________________。
分析:同周期元素从左到右第一电离能逐渐增大,但N由于最外层2p3处于半充满稳定结构,其第一电离能比O的大。
答案:N>O>C 同周期从左到右随原子序数递增,元素的第一电离能依次增大,但 N原子的价电子排布为2s22p3,属于半充满状态,较稳定,导致氮元素的第一电离能大于氧
【知识归纳】同一周期中,从左向右,元素的第一电离能总体上逐渐增大,其中电子层处于半充满、全充满状态的原子的第一电离能比相邻的后者还要大。
(1)由于S轨道全满,同周期中ⅡA族元素的第一电离能大于ⅢA族元素的第一电离能,例如Be>B,Mg>Al。
(2)由于p轨道半满,同周期中ⅤA族元素的第一电离能大于ⅥA族元素的第一电离能,例如:N>O,P>S。
衔接练习1:铜、锌两种元素的第一电离能、第二电离能如表所示

电离能/kJ·mol-1 I1 I 2铜906 1 733 746 1 958锌
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是____ ___________________________。
提示:根据Cu、Zn失去一个电子后的结构,分析再失去一个电子的难易,从而比较Cu、Zn的第二电离能。
答案:Cu失去一个电子变成结构为[Ar]3d10的Cu+,属于能量较低稳定结构,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小或Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,铜达到了较稳定状态,所以Cu的第二电离能相对较大)
2.物质稳定性比较
例2 (2016陕西质检)从原子结构说明+3价铁的化合物比+2价铁的化合物稳定的原因:__________________。
分析:基态Fe的核外有26个电子,电子排布式为1s22s22p63s23p63d64s2,+3价铁的结构为3d5,+2价铁的结构为3d6,3d5半满更稳定。
答案:+3价铁原子结构是3d5半满稳定,而+2价铁原子结构是3d6不稳定,易转化为3d5
【知识归纳】从原子结构的角度,在同一亚层的轨道上当电子全充满、半充满、全空时能量最低,体系较稳定。如s2、p3、p6、d5、d10、f7、f14等轨道,都是较稳定的。
衔接练习2:在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因:________。
提示:根据+1价铜、+2价铜的结构,比较CuO、Cu2O稳定性。
答案:结构上Cu2+为3d9,而Cu+为3d10全充满更稳定
二、分子结构与性质
例3 (2016全国Ⅰ,节选)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_____________。
分析:Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键。
答案:Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键
【知识归纳】在形成共价键时,原子间总是尽可能地沿着原子轨道最大重叠的方向成键。成键电子的原子轨道重叠程度越高,电子在两核间出现的概率密度也越大,形成的共价键也越稳固,这就是最大重叠原理。
衔接练习3:CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成π键,而Si、O原子间不能形成上述π键?__________________________________
1.共价键的形成
提示:根据C、Si原子结构的差别,从二者与O原子“肩并肩”重叠的难易,分析π键形成的难易。
答案:C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成较稳定的π键;而Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
2.分子的立体构型
例4 (2011山东,节选)H3O+中H—O—H的键角比H2O中H—O—H的键角大,原因是___________________。
分析:共价键键角的大小取决于分子中共用电子对之间斥力的大小,H2O中O原子有2对孤对电子,而H3O+中O原子只有1对孤对电子,排斥力较小,因此 H3O+中H—O—H键角比H2O中H—O—H键角大。
答案:H2O中的O原子有2对孤对电子,而H3O+中的O原子只有1对孤对电子,排斥力较小,故 H3O+中H—O—H的键角比H2O中H—O—H的键角大
【知识归纳】对于ABn型的分子或离子,中心原子A价层电子对(包括成键的σ键电子对和未成键的孤对电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥力最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定。分子中价层电子对之间的斥力主要顺序为:①孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;②双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力。
答案:大 NH+4中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,导致NH+4中H—N—H的键角比NH3中大
3.配位键的稳定性
例5 (2014全国Ⅱ,节选)[Cu(NH3)4(H2O)2]SO4加热时首先失去的组分是________,判断理由是_________。
分析:根据CuSO4溶液中逐滴滴加氨水,先生成蓝色沉淀,后沉淀消失,形成深蓝色溶液,变化过程为[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+,说明NH3比H2O更容易与Cu2+形成配位键,即H2O与Cu2+的配位键比NH3与Cu2+的弱,因此[Cu(NH3)4(H2O)2]SO4加热时首先失去的组分是H2O。
答案:H2O H2O与Cu2+的配位键比NH3与Cu2+的弱
【知识归纳】配位键越强,配合物越稳定。由教材可知配位键的稳性:Cu2+←H2O>Cu2+←NH3>H+←NH3,其中电子对给予体形成配位键的能力:NH3>H2O;接受体形成配位键的能力:H+>过渡金属>主族金属。
衔接练习5:(2016郑州质检)NH3与Cu2+可形成[Cu(NH3)4]2+配离子。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是______。
答案:F的电负性比N大,N—F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键
三、晶体结构和性质
例6 (2016全国Ⅰ,节选)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因:____________。

GeCl4 GeBr4 GeI 4熔点/400℃ -49.5 26 146沸点/℃ 83.1 186 约
分析:根据提供数据,GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是三者均为分子晶体。分子结构相似,分子量依次更大,分子间相互作用力逐渐增强。
答案:GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强
【知识归纳】晶体熔沸点的高低,取决于晶体类型及微粒间作用力。
(1)不同类型的晶体,熔沸点高低的比较规律:原子晶体>离子晶体>分子晶体。金属晶体熔、沸点相差很大,有的很高,如钨;有的很低,如汞。
(2)同种类型的晶体,熔沸点高低的比较规律:
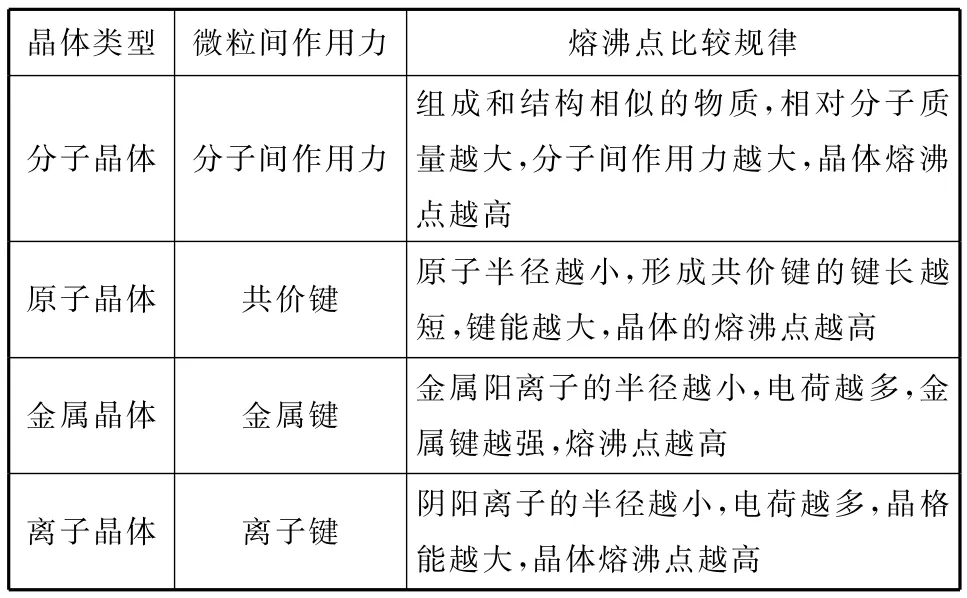
晶体类型 微粒间作用力 熔沸点比较规律分子晶体 分子间作用力组成和结构相似的物质,相对分子质量越大,分子间作用力越大,晶体熔沸点越高原子晶体 共价键 原子半径越小,形成共价键的键长越短,键能越大,晶体的熔沸点越高金属晶体 金属键 金属阳离子的半径越小,电荷越多,金属键越强,晶体熔沸点越高熔沸点越高离子晶体 离子键 阴阳离子的半径越小,电荷越多,晶格能越大,
衔接练习6:(2016湖北黄冈质检)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
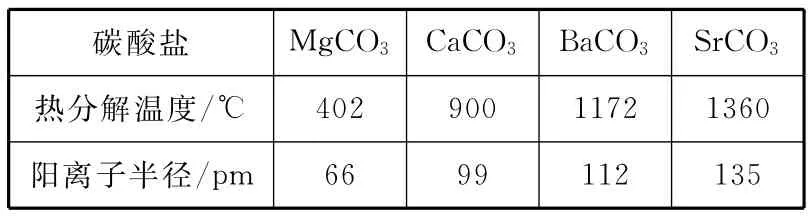
碳酸盐 MgCO3CaCO3BaCO3SrCO3热分解温度/m 66 99 112 135℃ 402 900 1172 1360阳离子半径/p
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?________。
(作者单位:山东省高青县第一中学)

