化学反应速率和化学平衡考向预测
湖北 罗功举
化学反应速率和化学平衡考向预测
湖北 罗功举
化学反应速率和化学平衡是高中化学重要的基本理论,考点多,能力要求高,是每年高考都要涉及的内容。笔者通过对近年高考试题及最新考试大纲进行深入分析,将化学反应速率和化学平衡中的典型考查方式归类如下,供考生备考。
一、考查化学反应速率
此知识点的考查内容包括化学反应速率计算、大小比较、影响因素及规律的分析、图象分析、实验设计等。
【例1】(2015福建)在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是()

v[mmol/(L·min)]c(mol/L)0.600 0.500 0.400 0.300T(K)318.2 3.60 3.00 2.40 1.80 328.2 9.00 7.50a4.50b2.16 1.80 1.44 1.08
A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
【分析】A项,根据表格的数据可知:在328.2K时,蔗糖的浓度越大,水解的速率越快,根据浓度与速率的变化关系可知:蔗糖的浓度每减小0.100mol/L,对应速率减小1.50mmol/(L·min),所以在浓度为0.400mol/L时,水解的速率是a=6.00mmol/(L·min),正确。B项,根据表格数据可知,升高温度,水解速率增大;增大浓度,水解速率也增大,若同时改变反应物的浓度和反应的温度,则对反应速率的影响因素会相互抵消,反应速率可能不变,正确。C项,在物质的量浓度不变时,升高温度,水解速率增大;降低温度,水解速率减小,由于在物质的量浓度是0.600mol/L时,当318.2K时,水解速率是3.60mmol/(L·min),现在该反应的速率是2.16mmol/(L·min)<3.60mmol/(L·min),所以反应温度低于318.2K,即b<318.2,正确。D项,不同温度时,蔗糖浓度减少,所以速率减慢,但是温度不同,在相同的浓度时的反应速率不相同,错误。
【答案】D
【点评】处理表格数据问题时,一要寻找数据的特点及变化规律,二要分析引起数据变化的原因(影响反应速率的因素主要包括浓度、温度、反应物颗粒大小、催化剂、压强等),然后再与有关化学知识或规律相联系,进而判断作答。
二、考查化学平衡状态
这类问题主要涉及三种题型:一是化学平衡状态的判据判断,二是化学平衡移动及外因与移动方向分析,三是勒夏特列原理的应用。

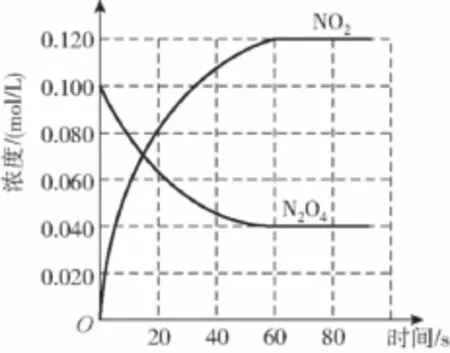
(1)反应的ΔH________(填“大于”或“小于”)0;100℃时,体系中各物质浓度随时间变化如上图所示。在0—60s时段,反应速率v(N2O4)为________mol/(L·s);反应的平衡常数K1为________。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0mol/(L·s)的平均速率降低,经10s又达到平衡。
a:T______(填“大于”或“小于”)100℃,判断理由是______________________________________。
b:列式计算温度T时反应的平衡常数K2=________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向__________(填“正反应”或“逆反应”)方向移动,判断理由是___________________________________________。


【点评】化学平衡移动的分析是该考点的重点,解答具体问题时,一般按照“可逆反应及特点→外因是什么→外因如何影响平衡→平衡移动方向→结论”程序思考,或根据浓度商与平衡常数间的关系判断。针对不同的问题,应灵活选择不同的方法。
三、考查化学平衡计算
此类问题是高考考查的重点,一般涉及各组分的物质的量、浓度、转化率、百分含量、气体混合物的密度、平均摩尔质量、压强、平衡常数等。
【例3】(2015新课标Ⅰ,节选)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
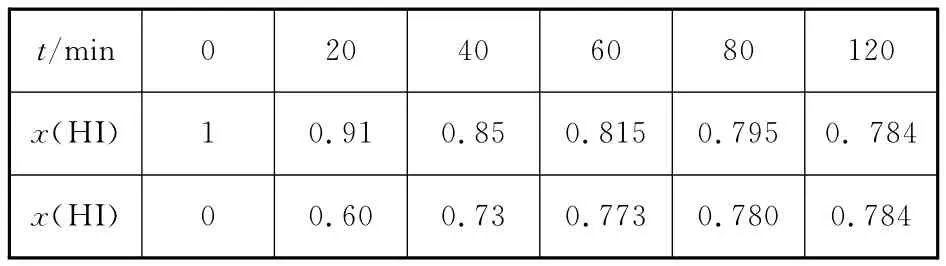
t/min 0 20 40 60 80 120x(HI)1 0.91 0.85 0.815 0.795 0.784x(HI)0 0.60 0.73 0.773 0.780 0.784
①根据上述实验结果,该反应的平衡常数K的计算式为_________________。
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若k正=0.002 7min-1,在t=40min时,v正=________min-1。
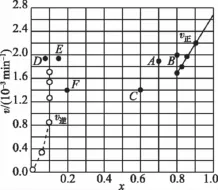
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为________(填字母)。
【分析】(4)①问中的反应是比较特殊的,反应前后气体体积相等,不同的起始态很容易达到等效的平衡状态。大家注意表格中的两列数据是正向和逆向的两组数据。
716K时,取第一行数据计算:

体积不影响平衡常数计算,
故K=c(H2)·c(I2)/c2(HI)=0.1082/0.7842。
本小题的易错点是:计算式会被误以为是表达式。
②问的要点是:平衡状态下,v正=v逆,故有:k正·x2(HI)=k逆·x(H2)·x(I2)
变形:k正/k逆={x(H2)·x(I2)}/x2(HI)=K,故有:k逆=k正/K。
若k正=0.002 7min-1,在t=40min时,x(HI)=0.85,则v正=k正·x2(HI)=0.002 7min-1×0.852=1.95× 10-3min-1。
③表中第一行数据意指由HI分解建立平衡,表中第二行数据意指向逆反应反向进行建立平衡;由第一行数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸气的物质的量分数相等,均为0.108;当升高温度时,有两个效应:①化学反应速率加快,坐标点会上移(看图,下同),如A、D、E点;②平衡向右移动[第(3)问中已知正反应吸热],HI的物质的量分数减小,坐标点会左移,如A点,而H2的物质的量分数增大,坐标点会右移,如E点;故当升高到某一温度时,反应重新达到平衡时,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E。
【答案】(4)①K=0.1082/0.7842②k正/K1.95× 10-3③AE
【点评】处理化学平衡计算问题时,一要合理运用三段式法列式、寻找关系量;二要准确把握各计算内容对应的计算公式;三要注意计算中的一些特定要求,如反应速率的单位及书写形式、化学平衡常数表达式的书写及计算数据为对应物质的平衡浓度等。
四、考查化学反应速率和化学平衡图象
这一问题涉及的图象类型较多,如v-t图、c-t图、%或α-p或T图等,考查识图能力及对有关知识规律的掌握情况和解题技巧。
【例4】(2015新课标Ⅱ)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:

回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
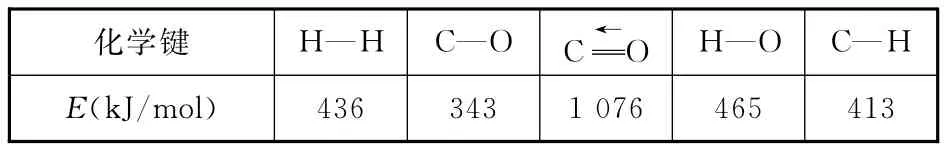
_____化学键_H—H _C—O _C__←O _H—O _C—H ___E(kJ/mol)436 343 1 076 465 413__
由此计算ΔH1=__________kJ/mol,已知ΔH2=―58kJ/mol,则ΔH3=________kJ/mol。
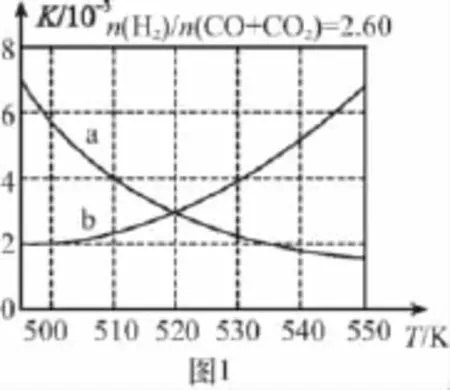
(2)反应①的化学平衡常数K的表达式为__________ ______;图1中能正确反映平衡常数K随温度变化关系的曲线为(填曲线标记字母)________,其判断理由是______ ________________________。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是______________________________。图2中的压强由大到小为________,其判断理由是_________________________。
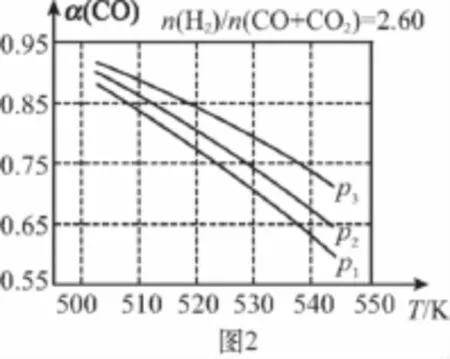
【分析】(1)反应热等于断键吸收的能量与形成化学键所放出的能量的差值,则根据方程式CO(g)+2H2(g)幑幐CH3OH(g)可知:ΔH1=1 076kJ/mol+2×436kJ/mol-3×413kJ/mol-343kJ/mol-465kJ/mol=-99kJ/mol。根据盖斯定律可知:反应②-①即得到反应③,则ΔH3=-58kJ/mol+99kJ/mol=+41kJ/mol。(2)化学平衡常数是指在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则反应①的化学平衡常数K的表达式为K=c(CH3OH)/[c(CO)·c2(H2)]。正反应是放热反应,升高温度,平衡向逆反应反向移动,所以平衡常数减小,a正确。(3)升高温度时,反应①为放热反应,平衡向逆反应反向移动,使得体系中CO的量增大;反应③为吸热反应,平衡向正反应反向移动,又产生CO,使CO的量增大;总的结果是:随着温度的升高,使CO的转化率降低。相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高,所以,图2中的压强由大到小为p3>p2>p1。
【答案】(1)―99 +41 (2)K=c(CH3OH)/[c(CO)· c2(H2)] a 反应①为放热反应,平衡常数应随温度升高变小
(3)减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;总结果,随温度升高,使CO的转化率降低p3>p2>p1相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高。
【点评】对于图象类问题,先要弄清楚图象中横、纵坐标及曲线的意义;再要能将曲线变化情况与有关知识及规律联系起来,并应用于题目的解答;三要熟悉基本的解题策略,如“先拐先平数值大”、“定一议二”、作辅助线等。简答要注意层次性、全面性、逻辑性等。
除上述一些类型问题外,还有等效平衡问题、化学平衡在生产生活中的应用问题等,也是学习中要注意的问题,不一一列举。总之,对本章节中的重要考点要做到胸中有数,解题策略要运用娴熟。
(作者单位:湖北省枝江一中)

