川芎嗪对土三七诱导的小鼠肝小静脉闭塞病治疗机制的研究*
川芎嗪对土三七诱导的小鼠肝小静脉闭塞病治疗机制的研究*
陈哲1刘竟芳1朱洪怡2杨丽3霍继荣2#
长沙市中心医院老年医学科1(410004)中南大学湘雅二医院消化内科2湖南省人民医院消化内科3
背景:肝小静脉闭塞病(HVOD)临床上以肝肿大、黄疸、腹水和体重增加为特征,目前尚缺乏有效的治疗手段。本课题前期研究发现川芎嗪对土三七诱导的小鼠HVOD具有治疗作用。目的:探讨川芎嗪对土三七诱导的小鼠HVOD的治疗机制。方法:将115只小鼠随机分为土三七组(土三七浓缩煎液30 g·kg-1·d-1灌胃)、低剂量川芎嗪干预组(土三七浓缩煎液30 g·kg-1·d-1+川芎嗪100 mg·kg-1·d-1灌胃)、高剂量川芎嗪干预组(土三七浓缩煎液30 g·kg-1·d-1+川芎嗪200 mg·kg-1·d-1灌胃)和正常对照组(PBS 30 g·kg-1·d-1灌胃),30 d后处死所有小鼠。行HE染色和Masson染色,以RT-PCR法和蛋白质印迹法分别检测肝组织中组织因子(TF)、核因子(NF)-κBp65、早期生长反应因子-1(Egr-1) mRNA和蛋白表达。结果:HE染色和Masson染色结果显示川芎嗪可明显改善HVOD小鼠肝组织病理损伤。土三七组TF、NF-κBp65和Egr-1 mRNA和蛋白表达显著高于正常对照组,组间差异有统计学意义(P<0.05);川芎嗪干预后,TF、NF-κBp65和Egr-1 mRNA和蛋白表达均不同程度下降(P<0.05),以高剂量组下降更为明显,而高剂量川芎嗪干预组与正常对照组相比差异无统计学意义(P>0.05)。结论:川芎嗪可能通过下调NF-κBp65和Egr-1表达降低TF水平,阻止凝血系统活化,从而有效治疗HVOD,且高剂量川芎嗪的疗效更为确切。
关键词肝静脉闭塞性疾病;土三七;川芎嗪;组织因子;早期生长反应蛋白质1;NF-κBp65亚基
Mechanism of Therapeutic Effect of Ligustrazine on Hepatic Veno-occlusive Disease Induced by Sedum aizoon in Mice
CHENZhe1,LIUJingfang1,ZHUHongyi2,YANGLi3,HUOJirong2.
1DepartmentofGeriatrics,ChangshaCentralHospital,Changsha(410004);2DepartmentofGastroenterology,theSecondXiangyaHospitalofCentralSouthUniversity,Changsha;3DepartmentofGastroenterology,HunanProvincialPeople’sHospital,Changsha
Correspondence to: HUO Jirong, Email: 36444522@qq.com
Background: Hepatic veno-occlusive disease (HVOD) is a disease characterized by hepatomegaly, jaundice, ascites, weight gain and lack of effective treatment currently. Our prophase research showed that ligustrazine had therapeutic effect on Sedum aizoon induced HVOD in mice. Aims: To investigate the mechanism of therapeutic effect of ligustrazine on Sedum aizoon induced HVOD in mice. Methods: A total of 115 mice were randomly divided into 4 groups: mice in group A were intragastrically administrated with 30 mg·kg-1·d-1Sedum aizoon to induce HVOD and served as model group; mice in group B were given 30 mg·kg-1·d-1Sedum aizoon + 100 mg·kg-1·d-1ligustrazine and served as low dose ligustrazine intervention group; mice in group C were given 30 mg·kg-1·d-1Sedum aizoon + 200 mg·kg-1·d-1ligustrazine and served as high dose ligustrazine intervention group; mice in group D were given 30 mg·kg-1·d-1PBS and served as normal control group. After 30 days, all the mice were sacrificed. HE staining and Masson staining were performed for histological examination. The mRNA and protein expressions of tissue factor (TF), nuclear factor (NF)-κBp65 and early growth response factor (Egr)-1 in liver tissue were determined by RT-PCR and Western blotting, respectively. Results: HE staining and Masson staining histological examination showed that ligustrazine could obviously ameliorate the pathological injury of liver tissue in HVOD mice. Compared with group D, the mRNA and protein expressions of TF, NF-κBp65, Egr-1 were significantly increased in group A (P<0.05). After intervention with ligustrazine, the mRNA and protein expressions of TF, NF-κBp65, Egr-1 were significantly decreased (P<0.05), especially in group C, and no significant differences were found between group C and group D (P>0.05). Conclusions: Ligustrazine has therapeutic effect on HVOD, the possible mechanism is that ligustrazine could interrupt the activation of coagulation system by reducing the expression of TF via down regulating the expressions of NF-κBp65 and Egr-1, especially in high dose ligustrazine group.
Key wordsHepatic Veno-Occlusive Disease;Sedum aizoon;Tetramethylpyrazine;Tissue Factor;
Early Growth Response Protein 1;NF-kappa B p65 Subunit
肝小静脉闭塞病(hepatic veno-occlusive disease, HVOD)指肝小叶中央静脉和小叶下静脉损伤导致管腔狭窄或闭塞而产生的肝内窦后性门脉高压症,临床上以肝肿大、腹水、体重增加和黄疸为特征[1]。国外临床报道显示HVOD多与骨髓移植前大剂量化疗相关,发生率为10%~60%[2]。近年来,因误服含吡咯烷类生物碱(pyrrolizidine alkaloids, PAs)的中草药所致HVOD越来越受到重视,国内临床报道多与服用土三七有关。HVOD的发病机制尚不明确,有文献报道内皮细胞损伤后,肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β等细胞因子的释放导致凝血系统激活,可能在HVOD的发病过程中起有重要作用[3-4]。
川芎嗪是川芎的有效成分四甲基吡嗪,具有抗血小板聚集、降低血液黏滞度、改善微循环、扩张血管、抗纤维化等作用。本课题组的前期研究[5]发现川芎嗪对土三七诱导的小鼠HVOD具有防治作用,且作用与剂量呈正相关。有文献报道,川芎嗪能有效抑制TNF-α介导的人脐静脉血管内皮细胞组织因子(TF) mRNA表达[6],而TNF-α诱导的内皮细胞TF表达主要由核因子(NF)-κB和早期生长反应因子-1(early growth response factor-1, Egr-1)调控[7-8]。本实验通过检测土三七诱导HVOD小鼠肝组织中TF及其转录因子NF-κBp65、Egr-1的表达,旨在从mRNA和蛋白水平探讨川芎嗪对HVOD的治疗机制,为临床有效防治提供新靶点。
材料与方法
一、主要材料
1. 实验动物:清洁级雌性昆明小鼠115只,体质量18~22 g,由中南大学湘雅二医院实验动物中心提供。
2. 药物:土三七购自安徽省毫州市药材总公司中药公司,磨碎后水浸1 h,加适量水煎煮30 min,使浓缩煎液相当于生药1 g/mL;川芎嗪购自河南辅仁怀庆堂制药有限公司。
3. 主要试剂:Trizol(Sigma公司),PCR Master Mix(Fermentas公司),BCA蛋白定量试剂盒、ECL化学发光试剂盒(上海碧云天生物技术有限公司),TF、NF-κBp65、Egr-1蛋白一抗(Santa Cruz公司)。
二、研究方法
1. 动物模型和分组:小鼠正常饲养1周后,随机分为4组:①土三七组30只,给予土三七浓缩煎液30 g·kg-1·d-1灌胃;②低剂量川芎嗪干预组30只,给予土三七浓缩煎液30 g·kg-1·d-1+川芎嗪100 mg·kg-1·d-1灌胃;③高剂量川芎嗪干预组30只,给予土三七浓缩煎液30 g·kg-1·d-1+川芎嗪200 mg·kg-1·d-1灌胃;④正常对照组25只,给予PBS 30 g·kg-1·d-1灌胃。每周测量2次体质量,30 d 后处死各组小鼠,取肝左叶部分组织置于液氮中保存待用。
2. 肝组织病理学评分[9]:按修改后的Deleve光镜评分标准,包括中央静脉内皮损伤、中央静脉内皮下出血、肝窦内出血、肝细胞凝固性坏死、中央静脉内皮下纤维化、中央静脉外膜纤维化和肝窦纤维化7项,对肝组织行病理学评分。
3. 逆转录聚合酶链反应(RT-PCR)检测肝脏TF、NF-κBp65、Egr-1 mRNA表达:从GenBank中查阅检测指标的mRNA全长序列,用Primer 5.0引物设计软件进行设计(表1),由武汉英韦创津公司合成。取冻存的肝组织,Trizol二步法提取总RNA,逆转录成cDNA,行PCR扩增。反应条件:TF:94 ℃预变性 5 min;94 ℃变性30 s,63 ℃退火40 s,72 ℃延伸30 s,共29个循环;72 ℃延伸7 min。NF-κBp65:94 ℃预变性 1 min;94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸45 s,共35个循环;72 ℃延伸5 min。Egr-1:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸7 min。β-actin:94 ℃预变性 5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸7 min。取PCR产物行2%琼脂糖凝胶电泳;用GelDoc 2000凝胶图像分析系统(Bio-Rad公司)进行扫描,BandScan 5.0软件进行分析, 测定产物条带的吸光度值, 以β-actin为内参,行半定量分析,目的基因条带相对表达量=目的基因条带灰度值/β-actin条带灰度值。

表1 PCR引物和产物长度
4. 蛋白质印迹法检测肝脏TF、NF-κBp65、Egr-1蛋白表达:取肝组织100 mg,加入组织裂解液,BCA法测定蛋白浓度。每份样品取20 g蛋白,按4∶1的比例加入5×上样缓冲液,95 ℃变性10 min后行SDS-PAGE电泳。PVDF膜半干转移,1~2 mA/cm2恒流1~2 h。用含5%脱脂奶粉的TBST封闭1 h。加入一抗(TF工作浓度为1∶400,NF-κBp65 1∶500,Egr-1 1∶200,β-actin 1∶4 000),4 ℃过夜。TBST洗膜3次,每次10~15 min。加入工作浓度为1∶10 000的HRP标记的二抗,37 ℃孵育1 h。TBST洗膜3次,每次10~15 min。加入ECL化学发光试剂,暗室曝光,X片显影。采用GelDoc 2000凝胶图像分析系统扫描,应用BandScan软件进行吸光度分析,目的蛋白相对表达量=目的蛋白条带灰度值/β-actin条带灰度值。
三、统计学分析
结果
一、肝脏病理学改变
HE染色可见正常对照组肝小叶结构完整,肝细胞以中央静脉为中心呈放射状排列;土三七组肝小叶结构破坏以及不同程度的肝窦扩张淤血、内皮细胞损伤、肝细胞坏死等;低剂量川芎嗪干预组部分肝小叶肝窦狭窄,且可见内皮损伤、散在肝窦淤血等表现;高剂量川芎嗪干预组肝小叶结构完整,可见散在的肝窦淤血和内皮细胞损伤,未见明显肝窦狭窄(图1)。Masson染色见正常对照组肝小叶结构完整,无纤维蛋白沉积;土三七组肝小叶结构破坏,肝窦内、中央静脉内皮下和外膜均可见纤维蛋白沉积;低剂量川芎嗪干预组肝窦内、中央静脉内皮下仍可见纤维蛋白沉积,但数量较土三七组明显减少;高剂量川芎嗪干预组肝小叶结构完整,肝窦周围有少量纤维蛋白沉积(图2)。与土三七组相比,低、高剂量川芎嗪干预组肝脏炎症、出血、纤维化等病变均有不同程度减轻。
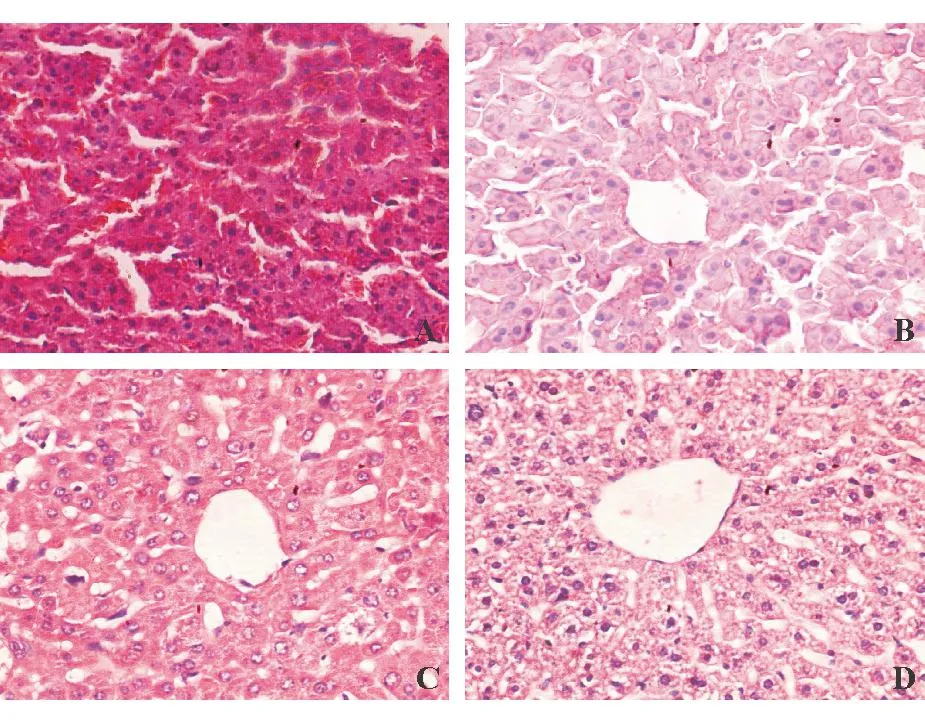
A:土三七组;B:低剂量川芎嗪干预组;C:高剂量川芎嗪干预组;D:正常对照组
图1各组小鼠肝脏HE染色结果(×200)

A:土三七组;B:低剂量川芎嗪干预组;C:高剂量川芎嗪干预组;D:正常对照组
图2各组小鼠肝脏Masson染色结果(×200)
二、TF、NF-κBp65、Egr-1 mRNA和蛋白表达
RT-PCR结果显示土三七组小鼠肝组织中TF、NF-κBp65、Egr-1 mRNA表达较正常对照组明显增高(P<0.05),川芎嗪干预后肝组织中TF、NF-κBp65、Egr-1 mRNA表达较土三七组显著下降(P<0.05),以高剂量干预组下降更为明显,两干预组间差异有统计学意义(P<0.05)(表2、图3)。

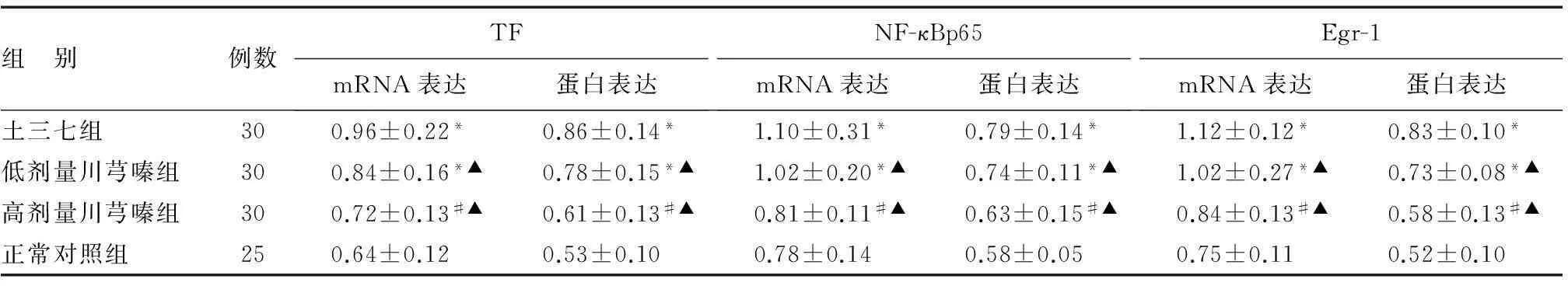
组 别例数TFmRNA表达蛋白表达NF-κBp65mRNA表达蛋白表达Egr-1mRNA表达蛋白表达土三七组300.96±0.22*0.86±0.14*1.10±0.31*0.79±0.14*1.12±0.12*0.83±0.10*低剂量川芎嗪组300.84±0.16*▲0.78±0.15*▲1.02±0.20*▲0.74±0.11*▲1.02±0.27*▲0.73±0.08*▲高剂量川芎嗪组300.72±0.13#▲0.61±0.13#▲0.81±0.11#▲0.63±0.15#▲0.84±0.13#▲0.58±0.13#▲正常对照组250.64±0.120.53±0.100.78±0.140.58±0.050.75±0.110.52±0.10
*与正常对照组比较,P<0.05;#与低剂量川芎嗪比较,P<0.05;▲与土三七组比较,P<0.05
蛋白质印迹结果显示土三七组小鼠肝组织TF、NF-κBp65、Egr-1蛋白表达较正常对照组明显增高(P<0.05),川芎嗪干预组肝组织中TF、NF-κBp65、Egr-1蛋白表达较土三七组显著降低(P<0.05),以高剂量干预组降低更为明显,两干预组间差异有统计学意义(P<0.05)(表2、图4)。

M:Marker;泳道1:土三七组;泳道2:低剂量川芎嗪干预组;泳道3:高剂量川芎嗪干预组;泳道4:正常对照组
图3各组小鼠肝脏TF、NF-κBp65、Egr-1 mRNA表达的电泳图(RT-PCR法)

1 Da=0.992 1 u
A:土三七组;B:低剂量川芎嗪干预组;C:高剂量川芎嗪干预组;D:正常对照组
图4各组小鼠肝脏TF、NF-κBp65、Egr-1蛋白的表达(蛋白质印迹法)
讨论
土三七又名菊叶三七,产于四川、云南、广东、江苏、湖南等地,具有破血散瘀、止血、消肿等功效,是民间常用的治疗跌打损伤和骨折的中草药。近年来,有关误服土三七导致HVOD的报道不断增多,这可能与土三七中含有PAs相关。目前HVOD尚缺乏有效的治疗手段,临床多以对症支持治疗为主。有文献报道,重组组织型纤溶酶原激活物(t-PA)、低分子量肝素、激素等对HVOD有一定的疗效[10-11],但部分患者会出现致命性出血等并发症。去纤苷是近年的研究热点[12-13],其可通过促进内皮表面前列腺素E2(PGE2)、前列环素(PGI2)、血栓调节蛋白的产生,降低凝血酶和纤溶酶原激活物抑制因子1(PAI-1)水平,增加内源性t-PA表达,从而达到保护内皮细胞、抑制纤维蛋白沉积的作用。对于重症HVOD患者,应考虑肝移植,但总体预后不佳。
HVOD的发病机制目前尚不明确。近年研究表明,凝血系统活性的改变在HVOD的发生、发展中起重要作用。PAs本身并无毒性,进入机体经肝脏代谢后,生成具有烯丙醇酯结构的代谢产物,后者在体内可产生细胞毒性,导致内皮细胞损伤,释放TNF-α、IL-1β、内皮素-1(ET-1)等细胞因子。TNF-α、IL-1β具有促凝活性,可促进TF、PAI-1等凝血活性物质释放[14-15],从而导致机体处于高凝状态。此外,血小板活化和纤维化相关因子,如转化生长因子β1、Ⅲ型前胶原肽表达增多,最终导致受累小静脉纤维沉积、闭塞,发生HVOD。TF是机体内活性最强的促凝物质之一,同时也是外源性凝血系统的启动因子[16]。在血管壁受损或某些病理性刺激下,如内毒素、免疫复合物、补体成分等可刺激体内内皮细胞、单核细胞表达TF。体内TF的表达主要受三个转录因子活化蛋白-1、Egr-1和NF-κB调控。文献[7-8]报道,TNF-α诱导的内皮细胞TF表达主要由NF-κB和Egr-1调控。
本实验发现土三七组小鼠TF、NF-κBp65、Egr-1 mRNA和蛋白表达较正常对照组均明显增加。不同剂量川芎嗪干预后,小鼠肝组织中TF、NF-κBp65、Egr-1 mRNA和蛋白表达均有所下降,以高剂量川芎嗪干预组下降更为明显,且与正常对照组差异无统计学意义。提示川芎嗪对土三七诱导的小鼠HVOD具有较好的治疗作用,高剂量(200 mg·kg-1·d-1)更为有效。川芎嗪治疗HVOD的机制可能与TF表达下调有关,通过下调转录因子NF-κBp65和Egr-1表达,降低TF水平,从而抑制机体内凝血系统的活化,达到有效治疗HVOD的目的。
参考文献
1 Zhou H, Wang YX, Lou HY, et al. Hepatic sinusoidal obstruction syndrome caused by herbal medicine[J]. Korean J Radiol, 2014, 15 (2): 218-225.
2 Richardson P, Guinan E. Hepatic veno-occlusive disease following hematopoietic stem cell transplantation[J]. Acta Haematol, 2001, 106 (1-2): 57-68.
3 房婷, 安立才, 刘迷迷, 等. 小鼠肝窦内皮细胞损伤在肝静脉闭塞病中的作用研究[J]. 中国实验血液学杂志, 2012, 20 (6): 1457-1462.
4 Coppell JA, Brown SA, Perry DJ. Veno-occlusive disease: cytokines, genetics, and haemostasis[J]. Blood Rev, 2003, 17 (2): 63-70.
5 陈哲, 霍继荣, 朱洪怡, 等. 川芎嗪对土三七诱导的肝小静脉闭塞病小鼠肝组织PAI-1表达的影响[J]. 中国医科大学学报, 2012, 41 (8): 709-712.
6 熊石龙, 文志斌, 王前, 等. 川芎嗪对肿瘤坏死因子致血管内皮细胞组织因子表达的影响[J]. 中国现代医学杂志, 2007, 17 (19): 2330-2333.
7 熊石龙, 文志斌, 何晓凡, 等. 川芎嗪抑制肿瘤坏死因子α诱导人脐静脉血管内皮细胞组织因子表达的机制研究[J]. 广东医学, 2008, 29 (4): 545-548.
8 Rong Y, Hu F, Huang R, et al. Early growth response gene-1 regulates hypoxia-induced expression of tissue factor in glioblastoma multiforme through hypoxia-inducible factor-1-independent mechanisms[J]. Cancer Res, 2006, 66 (14): 7067-7074.
9 DeLeve LD, McCuskey RS, Wang X, et al. Characterization of a reproducible rat model of hepatic veno-occlusive disease[J]. Hepatology, 1999, 29 (6): 1779-1791.
10Bearman SI, Lee JL, Barón AE, et al. Treatment of hepatic venocclusive disease with recombinant human tissue plasminogen activator and heparin in 42 marrow transplant patients[J]. Blood, 1997, 89 (5): 1501-1506.
11Al Beihany A, Al Omar H, Sahovic E, et al. Successful treatment of hepatic veno-occlusive disease after myeloablative allogeneic hematopoietic stem cell transplantation by early administration of a short course of methylprednisolone[J]. Bone Marrow Transplant, 2008, 41 (3): 287-291.
12Chopra R, Eaton JD, Grassi A, et al. Defibrotide for the treatment of hepatic veno-occlusive disease: results of the European compassionate-use study[J]. Br J Haematol, 2000, 111 (4): 1122-1129.
13Richardson P, Soiffer RJ, Antin JH, et al. Defibrotide (DF) for the treatment of severe veno-occlusive disease (sVOD) and multi-organ failure (MOF) post SCT: final results of a multi-center, randomized, dose-finding trial[J]. Blood, 2006, 108 (11): 178.
14Coppell JA, Brown SA, Perry DJ. Veno-occlusive disease: cytokines, genetics, and haemostasis[J]. Blood Reviews, 2003, 17 (2): 63-70.
15Pihusch V, Pihusch W, Penovici M, et al. Transforming growth factor beta-1 released from platelets contributes to hypercoagulability in veno-occlusive disease following hematopoetic stem cell transplantation[J]. Thromb Res, 2005, 116 (3): 233-240.
16Rauch U. Tissue factor and cardiomyocytes[J]. Thromb Res, 2012, 129 (suppl 2): S41-S43.
(2015-06-13收稿;2015-06-30修回)
*基金项目:湖南省科技厅资助(2009FJ3102)
DOI:10.3969/j.issn.1008-7125.2016.01.005
#本文通信作者,Email: 36444522@qq.com

