福寿螺密度变化的环境影响因素研究
段清星, 李湘, 王本君, 刘春红, 高霞, 敬凯
(云南师范大学生命科学学院,生物能源持续开发利用教育部工程研究中心,昆明650500)
福寿螺密度变化的环境影响因素研究
段清星, 李湘, 王本君, 刘春红, 高霞, 敬凯*
(云南师范大学生命科学学院,生物能源持续开发利用教育部工程研究中心,昆明650500)
生物入侵已成为全球重要的环境问题。福寿螺Pomaceacanaliculata的入侵对当地农业和湿地生态系统造成了严重危害。入侵地的环境因子对入侵物种的生存至关重要。2015年1—12月,采用样方法对云南省昆明地区景观池塘中的福寿螺密度以及相应的栖息地环境因子进行了调查和测定以研究环境因子对福寿螺密度的影响。结果表明:(1)不同区域的福寿螺密度差异有高度统计学意义,环境因子中植被高度、植被盖度、水面边缘植被宽度、田螺密度、鱼类出现频次的差异有高度统计学意义;水深、水温、pH值和氨氮浓度的差异有统计学意义。(2)福寿螺密度与栖息地中的植被高度、植被盖度、水面边缘植被宽度、水温、pH值、田螺密度呈极显著正相关关系,而与水深、氨氮浓度、鱼类出现频次呈极显著负相关关系。(3)植被盖度、pH值和鱼类出现频次是影响福寿螺密度变化的主要因素。
福寿螺;密度变化;环境因子
生物入侵的出现往往与入侵地的环境条件、资源水平和物种组成有关(Shea & Chesson,2002;Molesetal.,2008)。环境因子对种群具有调节作用,环境条件发生改变会使种群相应地扩大或缩小(Thompson,1929),其中栖息地环境因子,如物理因子和种间关系对水生生物种群的分布和数量具有重要的影响(何明海等,1988;Molesetal.,2008)。
福寿螺Pomaceacanaliculata为原产于南美洲淡水湿地的热带物种,现已扩散到全球,尤以中国台湾、菲律宾、日本、马来西亚、泰国等东南亚和东亚国家和地区为重(Mochida,1988)。由于食性广、食量大、繁殖快、适应性强、缺乏天敌等原因,福寿螺可迅速在野外建立庞大的种群,对当地农业和湿地生态系统造成严重的危害(Robert,2002;Sallehetal.,2012),已成为我国长江以南大部分地区的主要农业害虫(俞晓平等,2001)。同时,福寿螺还是广州管圆线虫Angiostrongyluscantonensis、卷棘口吸虫Echinostomarevolutum等寄生虫的中间宿主,严重威胁人类健康(潘长旺等,1998;郭靖等,2014)。
福寿螺在全球广泛的入侵带来了严重的生态学和经济学问题,研究者对其开展了大量的研究,内容涉及生物学特性(Estoyetal.,2002;Teo,2004;Yusaetal.,2006b)、入侵地种群的遗传多样性(Vegaetal.,2005;Yusa,2006;Accorsietal.,2014)、生态危害(Sin,2003;Carlssonetal.,2006;Fangetal.,2010)、防控技术(Yusaetal.,2006a;Wongetal.,2009;Dongetal.,2012)等。中国的研究也经历了从最早的开发养殖技术到认识遗弃后成为入侵种所造成的危害,以及再后来的防控技术研究(邓智心等,2013)。目前的研究重点仍然是种群扩散造成的危害以及防控技术的开发。全面分析入侵地环境因子与福寿螺的关系,对了解影响福寿螺密度变化的主要环境因素,揭示其入侵机制和相应的生态学过程(Burlakovaetal.,2010)具有重要意义,也能为预测福寿螺对本地生态系统的影响和进一步开发防控技术提供新的科学依据。本文对景观池塘中福寿螺的密度和环境因子进行了调查研究,以了解栖息地植被、水体物理化学因子和种间关系对福寿螺密度的影响。
1 研究方法
1.1 研究地概况
研究地点为云南省昆明市呈贡区(102°51′7′′E,24° 51′56′′N),海拔1 890 m,处于云贵高原中部的滇池盆地以东,属于典型的温带季风气候。干、湿季分明,5—10月为雨季,全年降水量约800 mm,年均温14.7 ℃,最热月平均气温19.7 ℃,最冷月平均气温6.5 ℃。研究地点为农田区的自然湿地经过一系列改造和人工绿化形成的景观池塘,水域面积约43 000 m2。整个研究区域分为3个部分,包括南湖、清溪和北潭,由2座石桥隔开,但水体彼此相连,南湖为自然泉水的出水口。除原本的自然植被外,研究区域还引入了大量的水生生物,如菖蒲Acoruscalamus、纸莎草Cyperuspapyrus、睡莲Nymphaeatetragona、铁线蕨Adiantumcapillus-veneris、芦苇Phragmitescommunis、风车草Cyperusalternifolius、姜花Hedychiumcoronarium、莲Nelumbonucifera和鸢尾Iristectorum等,沿岸还种植有垂柳Salixbabylonica以及其他杂草。福寿螺是在水生景观植物移栽时被带入而定殖形成的种群,水体在引入养殖鱼苗时也带入了一些外来野杂鱼,如食蚊鱼Gambusiaaffinis、中华鳑鲏Rhodeussinensis等。这些养殖鱼类和野杂鱼通常捕食水底的螺类,特别是幼螺。

图1 研究地点示意图Fig. 1 Sketch map of the study sites
1.2 研究方法
1.2.1 福寿螺密度调查 2015年1—12月,在北潭、清溪、南湖3个区域各随机选取8个样方,对样方进行标记(图1)。样方大小为1 m2(1 m1 m),样方间的距离大于50 m。每月对样方中福寿螺的密度进行2次调查,共计24次。调查时,使用捞网捞取样方内的福寿螺,计数并称重。福寿螺的大小根据傅先元和王洪全(2000)的标准进行分级,体质量<1.5 g为幼螺,1.5 g≤中螺≤6.5 g,>6.5 g为成螺。

1.3 数据处理与分析
对各区域福寿螺的密度和环境因子数据先用SPSS 15.0非参数检验中的Kolmogorov-Smirnov进行正态分布检验,根据检验结果进行单因素方差分析(One-Way ANOVA),对差异有统计学意义的因子采用Duncan法进行多重比较。环境因子与福寿螺密度的关系采用Pearson相关分析,对有显著相关的因子进行多元回归分析,求出最优回归模型。结果采用平均值±标准误(Mean±SE)表示。数据采用Excel 2010作图,P<0.05表示差异有统计学意义,P<0.01表示差异有高度统计学意义。
2 结果与分析
2.1 不同区域之间福寿螺密度和环境因子的差异
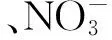

表1 景观池塘不同区域中环境因子的测量值Table 1 Measured values of environment factors at different regions of landscape ponds
注:a、b、c依次表示数值由大到小排列; 不同字母代表区域间的数值差异有统计学意义, 相同字母代表区域间的数值差异无统计学意义。
Notes: a, b and c indicated the ordinary value from small to large; Different letters between the columns indicated there was a significant difference, and the same letters indicated there was no significant difference.
2.2 环境因子与福寿螺密度的关系
2.2.1 植被 植被对福寿螺的密度有重要的影响。Pearson相关分析结果表明,福寿螺密度与植被高度(r=0.794,P<0.001,n=24)、植被盖度(r=0.903,P<0.001,n=24)、水面边缘植被宽度(r=0.802,P<0.001,n=24)呈极显著正相关关系(图2)。表明栖息地中植被越丰富,福寿螺的密度越大。
2.2.2 水体理化性质 水体的部分物理化学因子与福寿螺密度关系密切(图3)。Pearson相关分析显示,福寿螺密度与水体深度(r=-0.720,P<0.001,n=24)、NH3-N浓度(r=-0.752,P<0.001,n=24)呈极显著的负相关关系;而与水温(r=0.699,P<0.001,n=24)、pH值(r=0.839,P<0.001,n=24)呈极显著正相关关系。水体较浅、NH3-N浓度低、水温及pH值较高环境中的福寿螺密度高。
2.2.3 种间关系 水体中的鱼类对福寿螺密度也有重要的影响。样方内的鱼类出现频次在0~18次之间,相关分析显示鱼类出现频次与福寿螺密度之间呈极显著负相关(Pearson,r=-0.753,P=0.001,n=24)关系(图4)。表明水体中作为福寿螺捕食者的鱼类出现越频繁,福寿螺的密度就越低。

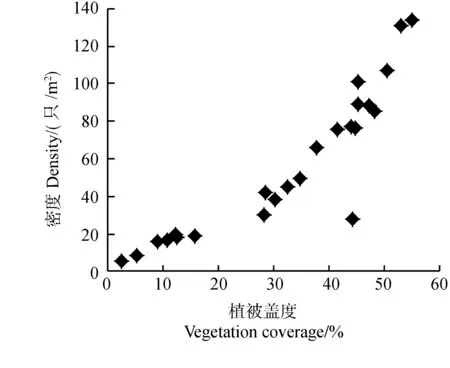

图2 栖息地植被对福寿螺密度的影响Fig.2 The influence of vegetation on the density of Pomacea canaliculata
样方内本地田螺密度在3~26只/m2之间,田螺密度与福寿螺密度呈极显著正相关(Pearson,r=0.625,P<0.001,n=24)关系(图5),显示水域中田螺密度越大区域中的福寿螺密度也越大。
2.3 影响福寿螺密度的主要环境因素
对与福寿螺密度具有相关关系的9个环境因子(植被高度、植被盖度、水面边缘植被宽度、水温、pH值、水深、NH3-N浓度、田螺密度、鱼类出现频次)进行多元回归分析得到3个模型(表2)。3个回归模型中,当植被盖度、pH值和鱼类出现频次进入回归方程时,回归方程的拟合程度最高(表3),为最优回归模型。其方程为:
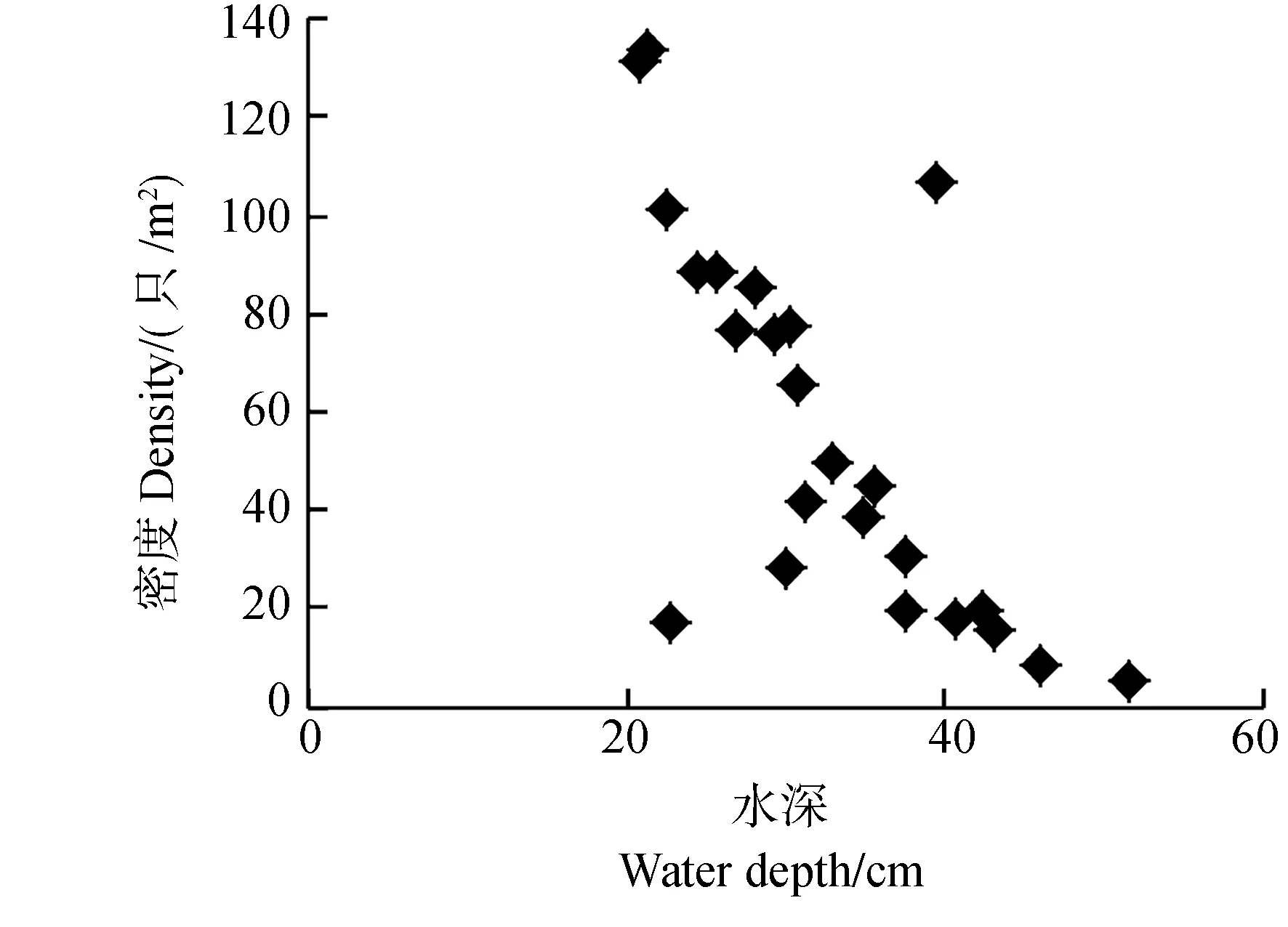

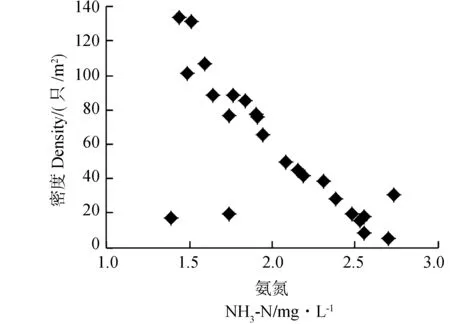

图3 水体物理化学因子与福寿螺密度的关系Fig.3 The relationships between the physical and chemical environment factors of water body and the density of Pomacea canaliculata
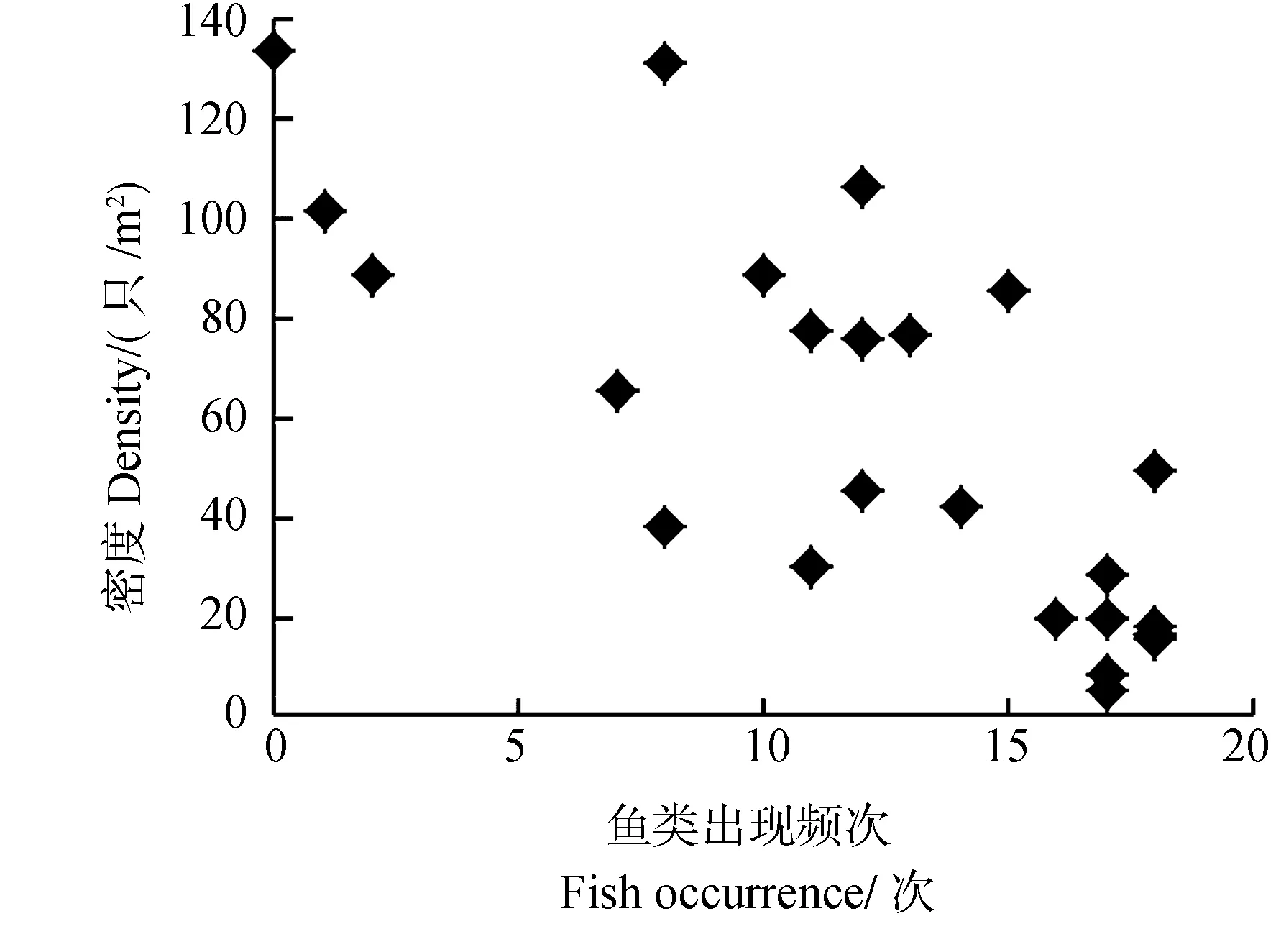
图4 鱼类的出现频次与福寿螺密度的关系Fig.4 The relationship between fish occurrence and the density of Pomacea canaliculata

图5 田螺密度与福寿螺密度的关系Fig.5 The relationship between the density of Cipangopaludinacahayensis and the density of Pomacea canaliculata
模型显示,植被盖度、pH值和鱼类出现频次是影响福寿螺密度最重要的3个环境因子。福寿螺密度随植被盖度和水体pH值的增加而增加,随鱼类出现频次的增加而降低。
3 讨论
栖息地的不同是影响淡水螺类分布的主要因素之一(Crowl & Schnell,1990)。福寿螺的种群增长受到多种环境因子的影响,如水文周期、食物、温度等,其种群的丰度与环境因子(如水深、水流、水温、溶解氧等)密切相关(Teo,2004;Yamanishietal.,2012)。在研究地,景观池塘的北潭、清溪和南湖3个不同区域里,福寿螺密度表现出明显的差异(密度大小依次为北潭>清溪>南湖),同样,不同区域福寿螺栖息地的14个环境因子中有9个也表现出了显著的不同。这显示多种环境因子对福寿螺密度具有影响,北潭的植被高度、植被盖度和水面边缘植被宽度都较大,而水体的水深较浅,NH3-N浓度较低,水温较高,pH值较大,鱼类出现频次较低,因此福寿螺密度相对较高。

表2 影响福寿螺密度变化的主要环境因子的逐步回归分析模型Table 2 Stepwise regression analysis model of the effects of environment factors on the density of Pomacea canaliculata
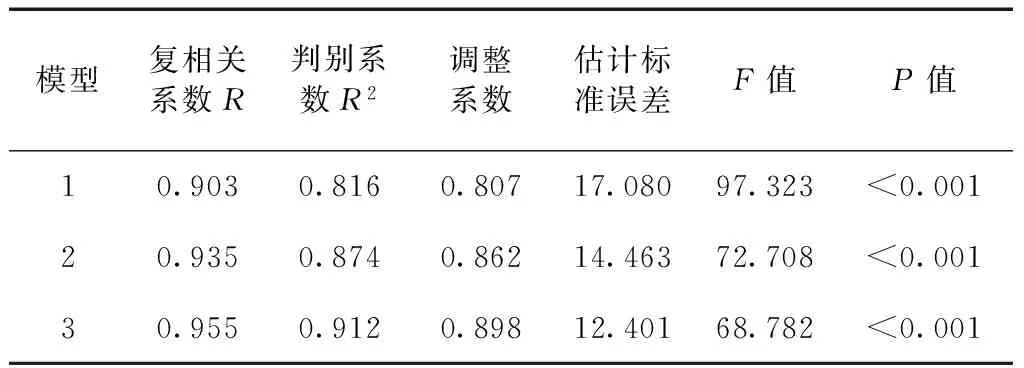
表3 影响福寿螺密度变化的主要环境因子的多元回归模型检验Table 3 Statistics test of the multiple regression models for the effects of environment factors on density variation ofPomacea canaliculata
3.1 植被的影响
水生植物是影响淡水螺类分布的重要因素之一(Giorgietal.,2005;Tietze & De Francesco,2010)。本研究发现植被高度、植被盖度、水面边缘植被宽度等对福寿螺密度具有重要影响。丰富的植被为福寿螺提供了充足的食物资源。福寿螺为广食性种类,对水生和陆生植物没有偏爱性(叶建人等,2011),主要栖息于水草茂盛的水域,可摄食大量水生植物,其生长速率与倾向摄食的植物丰富度有关(徐汝梅,叶万辉,2003)。池塘中有大量的湿地植被和枯枝落叶等有机质,杂草丛生,是福寿螺主要的食物来源(Estebenet,1995)。水体植被除了为福寿螺提供了食物外,还为其提供了产卵场所。福寿螺虽然是水生动物,但只在水面上方产卵(Wangetal.,2012),且所产的卵只能在空气中孵化(王彝豪,1988)。福寿螺吸附于水生植物的茎叶上,较高的植被有利于福寿螺进行产卵,避免所产的卵块接近水面,也可保证卵块不受其他物种的干扰,增加卵块的存活率(Seuffert & Martín,2010)。丰富的植被还可能为福寿螺提供躲避敌害的场所(Werneretal.,1983;Haraetal.,2015)。大型植物一方面为福寿螺提供了丰富的食物,有利于福寿螺进行产卵活动和直接进行空气呼吸,另一方面为福寿螺提供了躲避不良环境的场所(Seuffert & Martín,2013)。当大型植物减少或消失时,福寿螺密度会急剧下降(Tietze & De Francesco,2010)。
3.2 水体的影响
水深是福寿螺栖息地的重要限制因子之一。研究表明福寿螺的死亡率与水深有密切关系,水体太深或太浅都不利于福寿螺的生存(Teo,2004)。福寿螺主要栖息于水深不超过50 cm的浅水区(Burlakovaetal.,2010)。在日本,当水深超过50 cm时,福寿螺密度快速下降(Ichinoseetal.,2000)。夏威夷的福寿螺倾向于生活在水深不超过30 cm的水体中,当水深超过90 cm时很少有福寿螺的分布,而在原产地巴西的福寿螺主要集中生活在水深30~168 cm的水域中(Levinetal.,2006)。本研究表明,福寿螺偏爱生活在较浅的水体中,其原因可能是较浅水域中有大量泥土基质,当遇到天敌或极端环境时,福寿螺能较快躲避。浅水区的挺水植物、浮游植物和有机质都较丰富,不仅为福寿螺提供了丰富的食物,还有利于其在植被上进行产卵和直接爬出水面进行呼吸(Turner,1996;Darbyetal.,2002)。福寿螺营两栖生活,浅水区更有利于其进行水生和陆生的交替生活。
一是各工程项目部领用工程材料时,均以工程管理部填列的大料单为依据,在特别情况发生时,存在超出限额部分未及时办理审批手续的情况;二是工程管理部的大料单以设计管理部的设计图纸为依据编制,领料单一出,就将材料悉数领出,存在未用材料存于企业仓库或散于工地现场的情况,不利于施工企业采购资金的安排和材料存放安全;三是单个工程完工后办理退料时,工程项目部往往将尚未用完的的散件直接退回,未能按照节约原则在下一个工程中进行充分利用,存在不愿领用可改造使用的散件而领用整件再分割使用的情况.
水温不仅影响福寿螺的生长、发育,还影响其生存(Costil & Bailey,1998;Albrechtetal.,2005)。研究表明水温与福寿螺的死亡密切相关(Teo,2004)。福寿螺的正常生活水温为10 ℃~35 ℃(刘中丽,1989),当水温在10 ℃~30 ℃时,随着温度的升高,福寿螺的活动和摄食行为明显增强(Seuffertetal.,2010)。福寿螺原产于南美洲热带地区,适宜在水温较高的水域中生活(Robert,2002),23 ℃~27 ℃是其生长发育的最佳温度,当水温低于15 ℃时,福寿螺的活动和摄食能力明显受到抑制(刘中丽,1989)。然而高于40 ℃或低于0 ℃(周卫川等,2003)的水温常会导致福寿螺的死亡。本研究区域的水温处于福寿螺生存的安全生理温度之间,有利于其入侵和种群的扩散。
淡水螺类对环境中的酸碱度适应范围较广,在pH值4.5~9.4范围内均可存活(Hunter,1990)。朱丽霞等(2015)对福寿螺的研究发现,pH值6.5~8.5有利于福寿螺的生长发育和繁殖,当pH≤3.5或pH≥10.5,福寿螺的生长受到抑制。本研究区域中的pH值变化不大,处于福寿螺安全生理pH值之间,随着pH值的升高,福寿螺种群增加,表明中性和弱碱性的水体有利于福寿螺的生存。这与其他研究(Kwongetal.,2008;Seuffert & Martín,2013;朱丽霞等,2015)的结论一致。一般认为,pH值偏低时会影响囊胚或早期的发育,导致淡水螺生长缓慢、产卵量下降(Hunter,1990)。
NH3-N浓度对福寿螺的生长具有一定的影响。在一定条件下,福寿螺正常生存的NH3-N安全浓度为2.684 mg·L-1,随着NH3-N浓度的增加,福寿螺的死亡率增加(尹绍武,许芳,2000)。本研究表明,福寿螺远离NH3-N浓度高的环境,可能是因为在NH3-N浓度高的水体中,藻类和某些细菌过度繁殖会破坏水体的生态平衡,严重时可致福寿螺中毒甚至窒息死亡(夏新建等,2012)。
3.3 捕食者的影响
捕食是影响被捕食者种群动态和群落结构的重要因素之一(Sih,1987),而福寿螺的密度与其捕食者的捕食活动有关(Yamanishietal.,2012)。本研究区域中福寿螺的捕食者主要是各种大型鱼类,如青鱼Mylopharyngodonpiceus、鲤鱼Cyprinuscarpio、鲫鱼Carassiusauratus、鲶鱼Silurusasotus、草鱼Ctenopharyngodonidellus等。鲫鱼、青鱼、鲶鱼和鲤鱼主要捕食福寿螺幼螺,体型大的鱼还可捕食中大型螺类(Sin,2006;Yusaetal.,2006a)。本研究发现福寿螺的数量与鱼类出现频次呈极显著负相关关系,鱼类出现频次较多的区域中福寿螺密度较小,可能是捕食者(鱼类)对福寿螺的捕食所致。这与其他相关研究(Ichinoseetal.,2002;Haraetal.,2015)的结果一致。
本研究还发现,在昆明地区的景观池塘中,福寿螺密度受多种环境因子共同的影响。在逐步回归分析中仅有植被盖度、pH值和鱼类出现频次进入最后的最优回归模型,这表明福寿螺密度受植被、水体及捕食者压力等环境因子的共同作用。
邓智心, 罗明珠, 章家恩. 2013. 1981~2011年有关福寿螺研究的中文文献计量学分析[J]. 生物安全学报, 21(4): 300-307.
傅先元, 王洪全. 2000. 大瓶螺繁殖生态学研究[J]. 浙江海洋学院学报(自然科学版), 19(1): 37-41.
郭靖, 陈敏, 王玥, 等. 2014. 雌雄福寿螺摄食生长及形态性状差异研究[J]. 广东农业科学, 41(8): 96-100.
何明海, 蔡尔西, 吴启泉, 等. 1988. 九龙江口底栖生物生态研究[J]. 生态学报, 8(2): 133-139.
刘中丽. 1989. 热带福寿螺的引种养殖与气候适应性区划[J]. 华北农学报, 4(3): 116-120.
潘长旺, 邢文鸾, 梁韶辉, 等. 1998. 温州福寿螺体内首次发现广州管园线虫幼虫[J]. 中国寄生虫病防治杂志, 11(1): 78.
王彝豪. 1988. 福寿螺的养殖和生态特点[J]. 动物学杂志, 23(1): 1-3.
夏新建, 许忠能, 林小涛, 等. 2012. 不同池塘养殖模式的环境氮磷负荷及其水质特征[J]. 海洋科学, 36(5): 87-92.
徐汝梅, 叶万辉. 2003. 生物入侵: 理论与实践[M]. 北京: 科学出版社.
叶建人, 冯永斌, 林贤文, 等. 2011. 福寿螺的寄主植物及其对福寿螺体重的影响[J]. 生物安全学报, 20(2): 124-131.
尹绍武, 许芳. 2000. 福寿螺的生物学研究[J]. 湖南师范大学自然科学学报, 23(2): 76-82.
俞晓平, 和田节, 李中方, 等. 2001. 稻田福寿螺的发生和治理[J]. 浙江农业学报, 13(5): 247-252.
周卫川, 吴宇芬, 杨佳琪. 2003. 福寿螺在中国的适生性研究[J]. 福建农业学报, 18(1): 25-28.
朱丽霞, 黄瑶瑶, 张泽宏, 等. 2015. pH, 食物和光周期对福寿螺生长发育和繁殖的影响[J]. 生态学报, 35(8): 2644-2651.
Accorsi A, Ottaviani E, Malagoli D. 2014. Effects of repeated hemolymph withdrawals on the hemocyte populations and hematopoiesis inPomaceacanaliculata[J]. Fish & Shellfish Immunology, 38(1): 56-64.
Albrecht E, Koch E, Carreo N,etal. 2005. Control of the seasonal arrest of copulation and spawning in the apple snailPomaceacanaliculata(Prosobranchia: Ampullariidae): differential effects of food availability, water temperature, and day length[J]. Veliger, 47(3): 169-174.Burlakova LE, Padilla DK, Karatayev AY,etal. 2010. Differences in population dynamics and potential impacts of a freshwater invader driven by temporal habitat stability[J]. Biological Invasions, 12(4): 927-941.
Carlsson NO, Joshi R, Sebastian L. 2006. Invasive golden apple snails are threatening natural ecosystems in southeast Asia[M]// Joshi RC, Sebastian LS. Global advances in ecology and management of golden apple snails. Nueva Ecija: Philippine Rice Research Institute: 61-72.
Costil K, Bailey S. 1998. Influence of water temperature on the activity ofPlanorbariuscorneus(L.)(Pulmonata, Planorbidae)[J]. Malacologia, 39(1-2): 141-150.
Crowl TA, Schnell GD. 1990. Factors determining population density and size distribution of a freshwater snail in streams: effects of spatial scale[J]. Oikos, 59(3): 359-367.
Darby PC, Bennetts RE, Miller SJ,etal. 2002. Movements of Florida apple snails in relation to water levels and drying events[J]. Wetlands, 22(3): 489-498.
Dong S, Zheng G, Yu X,etal. 2012. Biological control of golden apple snail,Pomaceacanaliculataby Chinese soft-shelled turtle,Pelodiscussinensisin the wild rice, Zizania latifolia field[J]. Scientia Agricola, 69(2): 142-146.
Estebenet AL. 1995. Food and feeding inPomaceacanaliculata(Gastropoda: Ampullariidae)[J]. The Veliger, 38(4): 277-283.
Estoy J, Gerardo F, Yusa Y,etal. 2002. Size and age at first copulation and spawning of the apple snail,Pomaceacanaliculata(Gastropoda: Ampullariidae)[J]. Applied Entomology and Zoology, 37(1): 199-205.
Fang L, Wong PK, Lin L,etal. 2010. Impact of invasive apple snails in Hong Kong on wetland macrophytes, nutrients, phytoplankton and filamentous algae[J]. Freshwater Biology, 55(6): 1191-1204.
Giorgi A, Feijoó C, Tell G. 2005. Primary producers in a Pampean stream: temporal variation and structuring role[J]. Biodiversity & Conservation, 14(7): 1699-1718.
Hara A, Hamasaki K, Yoshida K,etal. 2015. Canal type affects invasiveness of the apple snailPomaceacanaliculatathrough its effects on animal species richness and waterweed invasion[J]. Biological Invasions, 17(1): 63-71.
Hunter RD. 1990. Effects of low pH and low calcium concentration on the pulmonate snailPlanorbellatrivolvis: a laboratory study[J]. Canadian Journal of Zoology, 68(7): 1578-1583.
Ichinose K, Tochihara M, Wada T,etal. 2002. Influence of common carp on apple snail in a rice field evaluated by a predator-prey logistic model[J]. International Journal of Pest Management, 48(2): 133-138.
Ichinose K, Wada T, Yusa Y,etal. 2000. Influence of habitat differences brought about by environmental changes on the densities of adults and eggs ofPomaceacanaliculata[J]. Proceedings of the Association for Plant Protection of Kyushu, 46(1): 78-84.
Kwong KL, Wong PK, Lau SS,etal. 2008. Determinants of the distribution of apple snails in Hong Kong two decades after their initial invasion[J]. Malacologia, 50(1): 293-302.
Levin P, Cowie RH, Taylor JM,etal. 2006. Apple snail invasions and the slow road to control: ecological, economic, agricultural, and cultural perspectives in Hawaii[M]// Joshi RC, Sebastian LS. Global advances in ecology and management of golden apple snails. Nueva Ecija: Philippine Rice Research Institute: 325-335.
Mochida O. 1988. Nonseedborne rice pests of quarantine importance[C]// International Workshop on Rice Seed Health. Los Banos: International Rice Research Institute: 117-129.
Moles AT, Gruber MA, Bonser SP. 2008. A new framework for predicting invasive plant species[J]. Journal of Ecology, 96(1): 13-17.
Robert HC. 2002. Apple snails (Ampullariidae) as agricultural pests: their biology, impacts and management[M]// Barker GM. Molluscs as crop pests. Wallingford: CABI Publishing: 145-178.
Salleh NHM, Arbain D, Daud MZM,etal. 2012. Distribution and management ofPomaceacanaliculatain the northern region of Malaysia: mini review[J]. Apcbee Procedia, 2(3): 129-134.
Seuffert ME, Burela S, Martín PR. 2010. Influence of water temperature on the activity of the freshwater snailPomaceacanaliculata(Caenogastropoda: Ampullariidae) at its southernmost limit (southern Pampas, Argentina)[J]. Journal of Thermal Biology, 35(2): 77-84.
Seuffert ME, Martín PR. 2010. Dependence on aerial respiration and its influence on microdistribution in the invasive freshwater snailPomaceacanaliculata(Caenogastropoda, Ampullariidae)[J]. Biological Invasions, 12(6): 1695-1708.
Seuffert ME, Martín PR. 2013. Distribution of the apple snailPomaceacanaliculatain Pampean streams (Argentina) at different spatial scales[J]. Limnologica-Ecology and Management of Inland Waters, 43(2): 91-99.
Shea K, Chesson P. 2002. Community ecology theory as a framework for biological invasions[J]. Trends in Ecology & Evolution, 17(4): 170-176.
Sih A. 1987. Predators and prey lifestyles: an evolutionary and ecological overview[M]// Kerfoot WC, Sih A. Predation: direct and indirect impacts on aquatic communities. London: University Press of New England: 203-224.
Sin TS. 2003. Damage potential of the golden apple snailPomaceacanaliculata(Lamarck) in irrigated rice and its control by cultural approaches[J]. International Journal of Pest Management, 49(1): 49-55.
Sin TS. 2006. Evaluation of different species of fish for biological control of golden apple snailPomaceacanaliculata(Lamarck) in rice[J]. Crop Protection, 25(9): 1004-1012.
Teo SS. 2004. Biology of the golden apple snail,Pomaceacanaliculata(Lamarck, 1822), with emphasis on responses to certain environmental conditions in Sabah, Malaysia[J]. Molluscan Research, 24(3): 139-148.
Thompson W. 1929. On natural control[J]. Parasitology, 21(3): 269-281.
Tietze E, De Francesco CG. 2010. Environmental significance of freshwater mollusks in the southern Pampas, Argentina: to what detail can local environments be inferred from mollusk composition?[J]. Hydrobiologia, 641(1): 133-143.
Turner RL. 1996. Use of stems of emergent plants for oviposition by the Florida applesnail,PomaceaPaludosa, and the implications for marsh management[J]. Biological Sciences, 19(1): 34-49.
Vega IA, Gamarra-Luques C, Koch E,etal. 2005. A study of corpuscular DNA and midgut gland occupancy by putative symbiotic elements inPomaceacanaliculata(Caenogastropoda, Ampullariidae)[J]. Symbiosis, 39(1): 37-45.
Wang Z, Tan J, Tan L,etal. 2012. Control the egg hatchling process ofPomaceacanaliculata(Lamarck) by water spraying and submersion[J]. Acta Ecologica Sinica, 32(4): 184-188.
Werner EE, Gilliam JF, Hall DJ,etal. 1983. An experimental test of the effects of predation risk on habitat use in fish[J]. Ecology, 64(6): 1540-1548.
Wong PK, Kwong KL, Qiu JW. 2009. Complex interactions among fish, snails and macrophytes: implications for biological control of an invasive snail[J]. Biological Invasions, 11(10): 2223-2232.
Yamanishi Y, Yoshida K, Fujimori N,etal. 2012. Predator-driven biotic resistance and propagule pressure regulate the invasive apple snailPomaceacanaliculatain Japan[J]. Biological Invasions, 14(7): 1343-1352.
Yusa Y, Sugiura N, Wada T. 2006a. Predatory potential of freshwater animals on an invasive agricultural pest, the apple snailPomaceacanaliculata(Gastropoda: Ampullariidae), in southern Japan[J]. Biological Invasions, 8(2): 137-147.
Yusa Y, Wada T, Takahashi S. 2006b. Effects of dormant duration, body size, self-burial and water condition on the long-term survival of the apple snail,Pomaceacanaliculata(Gastropoda: Ampullariidae)[J]. Applied Entomology and Zoology, 41(4): 627-632.
Yusa Y. 2006. Genetics of sex-ratio variation inferred from parent-offspring regressions and sib correlations in the apple snailPomaceacanaliculata[J]. Heredity, 96(1): 100-105.
Effects of Environment Factors on Density Variation ofPomaceacanaliculata
DUAN Qingxing, LI Xiang, WANG Benjun, LIU Chunhong, GAO Xia, JING Kai*
(Engineering Research Center of Sustainable Development and Utilization of Biomass Energy, Ministry of Education,School of Life Sciences, Yunnan Normal University, Kunming 650500, China)
Biological invasion has become a global environmental issue. Invasion ofPomaceacanaliculatahas great impacts on local agricultural and wetland ecosystems. Environment factors of the invasion site are crucial for the invasive species. Density of theP.canaliculataand the environment factors were investigated to study the effects of the environment factors on the density variation ofP.canaliculataby quadrate samples in Kunming, Yunnan province in 2015. The results showed that: 1. There was a significant difference inP.canaliculatadensities among the different areas, as well as the environment factors such as vegetation height, vegetation coverage, vegetation width at the waterside, mud snail (Cipangopaludinacahayensis) density, fish occurrence, water depth, water temperature, pH, and concentration of NH3-N. 2. The density ofP.canaliculatawas positively related to vegetation height, vegetation coverage, vegetation width at the waterside, water temperature, pH, and mudsnail density, but negatively related to water depth, concentration of NH3-N, and fish occurrence. 3. Vegetation coverage, pH, and fish occurrence played important roles on the density variation ofP.canaliculata.
Pomaceacanaliculata; density variation; environment factor
2016-04-18 接受日期:2016-06-14 基金项目:云南省生物多样性保护专项云环通[2013]74号
段清星, 男, 硕士研究生, 研究方向:动物学, E-mail:173552075@qq.com
*通信作者Corresponding author, E-mail:dunlin@sina.com
10.11984/j.issn.1000-7083.20160090
Q959
A
1000-7083(2016)04-0503-08

