孕激素对子宫内膜腺癌细胞RL95-2中骨桥蛋白表达的影响
顾方乐,卢丹,汪萍,孔祥,张艳馨,黄夏曼,吕芳,刘凯峰,张晓梅*
(1.苏北人民医院妇产科,扬州 225001;2. 扬州大学临床医学院,扬州 225001)
孕激素对子宫内膜腺癌细胞RL95-2中骨桥蛋白表达的影响
顾方乐1,卢丹1,汪萍1,孔祥1,张艳馨1,黄夏曼2,吕芳1,刘凯峰1,张晓梅1*
(1.苏北人民医院妇产科,扬州225001;2. 扬州大学临床医学院,扬州225001)
【摘要】目的探讨孕酮对人子宫内膜细胞RL95-2骨桥蛋白(OPN)表达的调节作用及其临床意义。方法利用免疫荧光方法观察OPN在RL95-2细胞的表达定位。将不同浓度的孕酮(1×10-9mol/L、1×10-7mol/L、1×10-5mol/L)处理RL95-2细胞24 h,采用逆转录聚合酶链反应(RT-PCR)技术和免疫印迹检测(Western blot)技术检测各组OPN mRNA和蛋白的表达水平,以不加孕酮的实验组为空白对照组。结果OPN定位表达于RL95-2细胞膜表面;与对照组相比,高浓度孕酮(1×10-5mol/L)组的OPN mRNA和蛋白的表达显著增加(P<0.05),低浓度孕酮(1×10-9mol/L)组则显著抑制OPN mRNA和蛋白的表达(P<0.05)。结论在一定浓度范围内,孕酮可双向调节子宫内膜表面骨桥蛋白的表达。
【关键词】孕酮;骨桥蛋白;子宫内膜;着床
(JReprodMed2016,25(3):253-257)
胚胎着床是母体和胎儿间的交互对话,卵巢甾体激素是其中的主要调控因素。正常月经周期中,子宫内膜只有排卵后6~8 d(“着床窗”期)内允许胚胎着床,此时雌孕激素达到峰值,子宫内膜以最大程度接受胚胎种植,这种状态称为“子宫内膜容受性”[1]。着床期雌孕激素上升均能提高子宫内膜腺体的分泌活性,但孕激素的作用占主导地位,孕激素使血管周围基质细胞增大并分泌多种生物学分子以促进胚胎粘附。这其中最有代表性的是骨桥蛋白(OPN)及其受体整合素[2],OPN通过自身的RGD(精氨酸、甘氨酸、天冬氨酸三肽)序列与整合素结合促进胚泡粘附并传递胞外信号[3],研究表明OPN在“着床窗”期呈高度的时空特异性[4-5],说明OPN的表达可能受孕激素调控。本研究通过孕激素对子宫内膜腺癌细胞(RL95-2)中OPN表达的影响,探讨OPN在胚胎着床中的作用。
材料与方法
一、细胞系及主要试剂
子宫内膜癌细胞株RL95-2购自中国科学院典型培养物保藏委员会细胞库。DMEM/F12培养基(Corning,美国),无酚红DMEM/F12培养基、胎牛血清、活性炭过滤胎牛血清、0.25%胰酶[含乙二胺四乙酸(EDTA)](GIBCO,美国),孕酮、胰岛素干粉、牛血清蛋白(BSA)和DABCO封片剂(Sigma,美国),小鼠抗人OPN抗体、山羊抗小鼠IgG-FITC抗体(Santa Cruz,美国),4%多聚甲醛(Solarbio,中国),逆转录及荧光定量试剂盒(Takala,日本),Trizol试剂(Invitrogen,美国),蛋白抽提试剂盒、BCA蛋白测定试剂盒及KCTM化学发光试剂盒(上海康成),免疫印迹(Western blot)用小鼠抗人OPN抗体(Abcam,美国),兔抗小鼠二抗(上海康成)。
二、实验方法
1.细胞培养及激素处理:RL95-2细胞用DMEM/F12培养基(含10% 热失活的胎牛血清、2 mmol/L L-谷氨酰胺、青链霉素以及5 μg/ml胰岛素)培养,培养环境均为37℃、5% CO2的潮湿环境,每2~3 d传代1次。
将处于对数生长期的RL95-2细胞消化,并以5×105/ml密度接种于12孔培养板,次日更换无酚红DMEM/F12和10% 活性炭过滤胎牛血清的培养基继续培养24 h后,在细胞培养基中加入不同浓度的孕酮并依次分组为1×10-9mol/L组、1×10-7mol/L组、1×10-5mol/L组,以不加孕酮的实验组为空白对照组,处理24 h后收集细胞用于逆转录聚合酶链反应(RT-PCR)和免疫印迹检测(Western blot)实验。
2.免疫荧光检测法:将未处理的RL95-2细胞消化接种于铺有细胞爬片的24孔板,待细胞60%~70% 汇合后进行以下染色步骤:用4% 多聚甲醛固定30 min,磷酸盐缓冲液(PBS)清洗3次,用0.1% Triton×100透化20 min,PBS清洗3次,用1% BSA封闭1.5 h,加入小鼠抗人OPN一抗(稀释倍数 1∶100) 4℃孵化过夜。用加入0.1% Tween-20的磷酸盐缓冲液(PBST)冲洗3次,每次5 min,随后加入FITC标记的山羊抗小鼠IgG二抗(稀释倍数1∶100),37℃下遮光孵化2 h。PBST冲洗3次,每次5 min,加入二脒基苯基吲哚DAPI(0.5 μg/ml)染核10 min,用三乙烯二胺(DABCO)进行封片,在蔡司LSM 710共聚焦显微镜下观察染色效果,用蔡司ZEN成像软件获得图像。
3. 实时荧光定量PCR:(1)逆转录反应(RT):按照Trizol试剂说明书提取各组细胞的总RNA,分光光度计测算各组总RNA浓度。取1 μg进行逆转录,加入5×PimeScript RT Master Mix 4 μl,焦炭酸二乙酯 (DEPC)水补足总反应体系为20 μl,置于 37℃ 15 min,再置于 85℃ 5 s,快速冷却至4℃;(2)引物设计:本实验所用引物是根据Genbank的人目的基因cDNA (NM00582.2)设计,由上海英骏生物有限公司合成,序列分别为:OPN(149 bp):5’-TGGCCGAGGTGATAGTGTG-3’,5’-CGGGGATGGCCTTGCATG-3’。内参β-actin(234 bp):5’-AAGACCTGTACGCCAACACAGT-3’,5’-AGA AGCATTTGCGGTGGACGAT-3’;(3)实时荧光定量PCR:取RT的cDNA 2 μl,加入2×SYBR Premix Ex Taq 10 μl,50×ROX Reference Dye 及上下游引物各0.4 μl,DEPC水补足总反应体系为20 μl。置于ABI 7500 PCR仪中,95℃预变性30 min后执行40个循环:95℃变性5 s,60℃退火34 s,溶解曲线分析:95℃ 15 s,60℃ 1 min,95℃ 15 s;(4)数据分析:SDS系统分析得到各组CT值后,利用2-ΔΔCT公式测定各组细胞OPN的mRNA相对表达量,ΔΔCT=(实验组CT值-实验组内参CT值)-(对照组CT值-对照组内参CT值),对照组ΔΔCT为 0,因此 2-ΔΔCT值为 1。当实验组2-ΔΔCT值<1,该药物视为有抑制作用,当实验组2-ΔΔCT值>1,该药物视为有促进作用。
4. Western blot:各组RL95-2细胞用胰酶消化后计数置于微量离心管(EP管)中,按107个细胞中加入1 ml抽提试剂的比例,加入预冷的蛋白质抽提试剂(1 ml抽提试剂中加入5 μl蛋白酶抑制剂混合液,5 μl苯甲基磺酰氟和5 μl磷酸酶混合液),冰浴下摇动15 min进行裂解。将裂解液在4℃中12 000g离心15 min,取上清液,用BCA法测定蛋白浓度并用酶标仪测定浓度,将等质量蛋白(50 μg)加入上样缓冲液后煮沸,进行SDS-PAGE,80 V电泳 1.5 h。转移至聚偏二氟乙烯(PVDF)膜上,200 mA 转移2 h。用5% 脱脂奶粉室温封闭4 h,将膜置于小鼠抗人OPN抗体(稀释浓度1∶1 000)4℃过夜,用TBST清洗3次,将膜置于辣根过氧化物酶(HRP)标记的兔抗小鼠二抗(稀释浓度1∶5 000)孵育1 h,TBST清洗3次,用KCTM化学发光试剂盒进行定影显影,X光胶片曝光。用Image J分析软件检测图片中各特异条带灰度值进行定量分析。
三、统计学分析
结果
一、OPN在RL95-2细胞的定位表达
免疫荧光结果显示:OPN为绿色荧光标记,细胞核由DAPI染为蓝色,可以看到在未处理的RL95-2细胞质和细胞膜表面均有绿色荧光,但在细胞膜表面表达较明显(图1),推测OPN定位表达于RL95-2细胞膜表面,可能为胚胎粘附做准备。
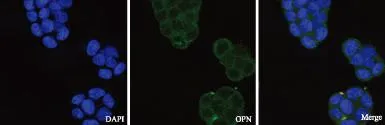
DAPI:DAPI染色;OPN:OPN蛋白检测;Merge:合并图图1 OPN在RL95-2细胞中的表达定位 免疫荧光法 ×200
二、不同浓度的孕酮对OPN mRNA表达的影响
RT-PCR结果显示,与对照组相比,高浓度孕酮(1×10-5mol/L)组的OPN mRNA的表达显著增加(P<0.05),低浓度孕酮(1×10-9mol/L)组则显著抑制OPN mRNA的表达(P<0.05)(图2)。

10-5:孕酮浓度为1×10-5 mol/L组,10-7:孕酮浓度为1×10-7 mol/L组,10-9:孕酮浓度为1×10-9 mol/L组与对照组比较,*P<0.05图2 各组RL95-2细胞中OPN mRNA的表达比较
三、不同浓度的孕酮对OPN蛋白表达的影响
Western blotting结果显示,与对照组相比,OPN蛋白的表达随着孕酮作用浓度的升高而增加。高浓度孕酮(10-5mol/L)OPN 蛋白的表达水平显著高于对照组(P<0.05),低浓度孕酮(10-9mol/L)OPN蛋白的表达水平则显著低于对照组(P<0.05)(图3),与OPN mRNA表达的变化趋势是一致的。
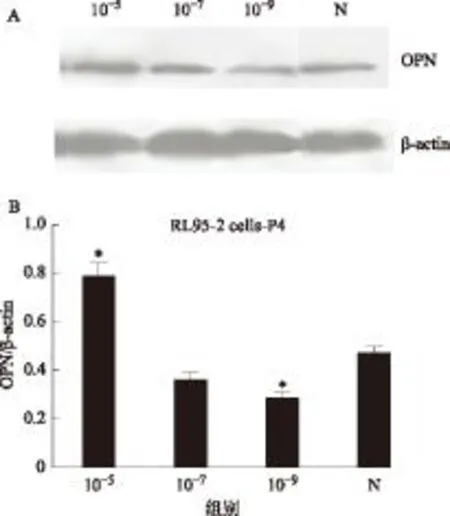
A:Western blotting条带;B:各组灰度值分析10-5:孕酮浓度为1×10-5 mol/L组,10-7:孕酮浓度为1×10-7 mol/L组,10-9:孕酮浓度为1×10-9 mol/L组,N:对照组。与对照组相比,*P<0.05图3 各组RL95-2细胞中OPN蛋白的表达
讨论
从世界第一例试管婴儿的出生到现在,辅助生殖技术已经解救了越来越多的不孕症夫妇,然而目前IVF的临床妊娠率仍然处于较低的水平,如何提高胚胎着床成功率是关键。成功的胚胎着床需要胚胎与子宫内膜的同步发育,相较胚胎质量而言,子宫内膜的影响因素更复杂,因而更难以调控。研究发现在“着床窗”期子宫内膜在卵巢甾体激素的靶向作用下会分泌大量有粘附活性的细胞因子[6-7]。
OPN及其受体整合素是子宫内膜分泌的粘附分子。OPN是一种具有多种生物学活性的分泌型磷酸蛋白,在体内多个分泌性组织中广泛地分布。在“着床窗”期,胚胎滋养层细胞及子宫内膜腺上皮细胞均合成整合素和OPN并分泌至细胞表面,两者特异性结合形成识别复合物,OPN成为连接子宫和胚胎的桥接分子,促进子宫内膜与滋养层细胞的粘附,这就是著名的胚泡植入“三明治”模型理论[8]。本研究所选用的子宫内膜腺癌细胞RL95-2具有强粘附性,并对卵巢甾体激素等的作用敏感[9],研究结果发现OPN定位表达于RL95-2细胞的膜表面,说明OPN在子宫内膜的表面分布,为胚胎的起始粘附做好准备,进一步验证了“三明治”理论。
卵巢甾体激素中,雌激素主要以正反馈作用诱发LH峰促进排卵,并调节局部子宫防御机制使囊胚植入不受母体的免疫攻击[10]。而孕激素主要作用于子宫内膜,一方面使其呈分泌期形态为植入的胚胎提供必要的物质基础,另一方面分泌期子宫内膜具有更大的生物学活性利于容纳胚胎[11-12]。为证实OPN基因的表达是否受孕激素调节,本研究用不同浓度的孕激素处理RL95-2细胞后发现,孕激素对RL95-2细胞OPN mRNA和蛋白表达的调节作用呈现浓度依赖性:孕激素浓度升高可显著上调OPN的表达,由此推测“着床窗”期孕激素升高可上调子宫内膜OPN的表达,有利于胚胎着床。也有研究发现胚胎着床需要黄体支持[13-14];孕激素浓度降低明显下调OPN的表达,由此可解释临床上胚胎着床时缺乏孕酮往往会导致着床失败的原因[15-16]。
本研究发现孕激素对RL95-2细胞OPN mRNA和蛋白的表达呈现双向调节作用,不仅为临床上IVF术后黄体支持提供了实验依据,也为不孕症患者克服胚胎着床障碍提供了理论基础。孕激素调控下的OPN参与着床的具体作用机制有待进一步研究。深入研究这些着床相关因素对于提高助孕技术,开拓避孕的新途径有着长远的意义。
【参考文献】
[1]Lessey BA. Assessment of endometrial receptivity [J]. Fertil Steril,2011,96:522-529.
[2]顾方乐,张晓梅. 整合素αvβ3、骨桥蛋白对子宫内膜容受性的影响[J]. 中国生育健康杂志,2013,24:174-176.
[3]Johnson GA,Burghardt RC,Bazer FW,et al. Osteopontin:roles in implantation and placentation [J]. Biol Reprod,2003,69:1458-1471.
[4]Apparao KB,Murray MJ,Fritz MA,et al. Osteopontin and its receptor alphavbeta(3) integrin are coexpressed in the human endometrium during the menstrual cycle but regulated differentially [J]. J Clin Endocrinol Metab,2001,86:4991-5000.
[5]Liu N,Zhou C,Chen Y,et al. The involvement of osteopontin and β3 integrin in implantation and endometrial receptivity in an early mouse pregnancy model[J]. Eur J Obstet Gynecol Reprod Biol,2013,170:171-176.
[6]高明霞,薛石龙,张学红,等. 子宫内膜容受性的评估与干预[J]. 生殖医学杂志,2013,22:13-19.
[7]刘雪梅,朱桂金,钟刚. 雌、孕激素及肝素结合生长因子对Ishikawa细胞HOXA10基因表达的调节[J]. 生殖医学杂志,2007,16:35-39.
[8]Lessey BA,Castelbaum AJ. Integrins and implantation in the human[J]. Rev Endocr Metab Disord,2002,3:107-117.
[9]Nannan NJ,Paiva P,Dimitriadis E,et al. Models for study of human embryo implantation:choice of cell lines? [J]. Biol Reprod,2010;82:235-245.
[10]石玉华,陈子江. 雌激素的生理意义[J]. 首都医科大学学报,2013,34:530-534.
[11]Wetendorf M,DeMayo FJ. Progesterone receptor signaling in the initiation of pregnancy and preservation of a healthy uterus [J].Int J Dev Biol,2014,58:95-106.
[12]Large MJ,DeMayo FJ. The regulation of embryo implantation and endometrial decidualization by progesterone receptor signaling[J].Mol Cell Endocrinol,2012,358:155-165.
[13]Labarta E,Martínez-Conejero JA,Alamá P,et al. Endometrial receptivity is affected in women with high circulating progesterone levels at the end of the follicular phase:a functional genomics analysis[J].Hum Reprod,2011,26:1813-1825.
[14]Zhang XM,Lv F,Wang P,et al. Estrogen supplementation to progesterone as luteal phase support in patients undergoing in vitro fertilization:systematic review and meta-analysis[J].Medicine(Baltimore),2015,94:e459.
[15]Young SL. Oestrogen and progesterone action on endometrium:a translational approach to understanding endometrial receptivity[J/OL]. Reprod Biomed Online,2013,27:497-505.
[16]Lessey BA,Young SL. Homeostasis imbalance in the endometrium of women with implantation defects:the role of estrogen and progesterone [J]. Semin Reprod Med,2014,32:365-375.
[编辑:郭永]
Effect of progesterone on expression of osteopontin in endometrial adenocarcinoma cell line RL95-2
GUFang-le1,LUDan1,WANGPing1,KONGXiang1,ZhangYan-xin1,HUANGXia-man2,LYUFang1,LIUKai-feng1,ZHANGXiao-mei1*
1.NorthernJiangsuPeople’sHospital,Jiangsu,Yangzhou225001;
2.ClinicalMedicalCollegeofYangzhouUniversity,Jiangsu,Yangzhou225001
【Abstract】
Objective: To investigate the effect of progesterone on the expression of osteopontin (OPN) gene in endometrial adenocarcinoma cells cell line RL95-2.
Methods: The localization of OPN of RL95-2 cells was detected by immunofluorescence staining. RL95-2 cells were incubated with different concentrations of progesterone(1×10-9mol/L、1×10-7mol/L、1×10-5mol/L)for 24 hours,while the control group were treated with medium only. The expression of OPN gene was detected by reverse transcriptase-polymerase chain reaction (RT-PCR) and Western blotting respectively.
Results: OPN was obviously expressed on the membrane surface of RL95-2 cells. High concentration of progesterone(1×10-5mol/L)significantly up-regulated the OPN expression(P<0.05),and low concentration of progesterone(1×10-9mol/L)significantly down-regulated OPN expression in RL95-2 cells(P<0.05).
Conclusions: Progesterone in a certain concentration rage can dual-directionally regulate the OPN expression on the membrane surface of endomentium.
Key words:Progesterone;Osteopontin;Endomentium;Implantation
【作者简介】顾方乐,女,江苏涟水人,硕士生,妇产科学专业.(*通讯作者,Email:zhangxiaomeiyz@163.com)
【基金项目】国家自然科学基金青年基金项目(81100421);江苏省六大人才高峰项目(2014-WSW-080);扬州市自然科学基金项目(YZ2014050)
【收稿日期】2015-08-05;【修回日期】2015-11-03
DOI:10.3969/j.issn.1004-3845.2016.3.011

