羽衣甘蓝自交不亲和与自交亲和系种子萌发期DNA甲基化的动态变化
张 旸 胡中影 赵月明 李 娜 解莉楠,*
1东北林业大学生命科学学院,黑龙江哈尔滨 150040;2黑龙江生物科技职业学院,黑龙江哈尔滨 150025
羽衣甘蓝自交不亲和与自交亲和系种子萌发期DNA甲基化的动态变化
张旸1胡中影1赵月明1李娜2解莉楠1,*
1东北林业大学生命科学学院,黑龙江哈尔滨 150040;2黑龙江生物科技职业学院,黑龙江哈尔滨 150025
摘要:自交不亲和系植株的种子往往出现退化现象,为了研究种子的退化现象是否与甲基化相关,因此本文采用甲基化敏感扩增多态性(methylation sensitive amplification polymorphism,MSAP)技术,以羽衣甘蓝自交不亲和系9#种子、自交亲和系14#种子为研究对象,对其生长发育过程种子基因组DNA甲基化水平变化情况进行研究。采用改良的CTAB法提取种子萌发不同时期DNA,然后通过MSAP分析、统计扩增条带,比较二者之间的差异。对9#种子DNA甲基化状态分析表明,萌发前期(0~2 d)发生甲基化位点数目持续增多,但萌发后期(2~8 d)发生去甲基化的数目大量增加,整个萌发期去甲基化位点数目是甲基化位点数目的11倍,说明9#种子萌发过程中DNA甲基化修饰是基因表达的重要调控方式之一;在相同发育时期,9#在总甲基化、全甲基化、半甲基化水平上均不同程度高于14#。随着种子的萌发,9#全甲基化水平明显上升,半甲基化水平几乎不变,而14#变化趋势与9#相反,半甲基化水平明显上升,全甲基化水平几乎不变。
关键词:羽衣甘蓝;自交不亲和性;自交亲和性;DNA甲基化
本研究由中央高校基本科研业务费专项资金项目(DL09AB13)和哈尔滨市科技创新人才研究专项资金项目(青年科技创新人才) (2013RFQXJ036)资助。
This study was supported by the Basic Scientific Research Expenses of the Higher Education Institutions of Central Government,China (DL09AB13) and the Subject of Innovative Talents for Science and Technology research in Harbin (Youth Talents in Science and Technology Innovation) (2013RFQXJ036).
第一作者联系方式:E-mail:summerzhang@126.com
羽衣甘蓝(Brassica oleracea var.acephala D.C.)别名牡丹草、花甘蓝、花菜、花苞菜等[1],观赏期达3~4个月,其叶型丰富,叶色绚丽缤纷,在我国作为花坛、花境及盆栽的重要观赏花卉[2]。羽衣甘蓝原产于地中海地区,早在公元前200年古希腊和古罗马就广为栽培,目前已成为一种常见的园林绿化植物[3]。近年来,国家蔬菜工程技术研究中心从美国、德国、荷兰等国引进优良羽衣甘蓝品种,经过系统选育,培育出了叶色深绿、风味浓、品质优、抗逆性强、产量高的新品种“开乐”,其维生素、可溶性钙、类胡萝卜素含量丰富,是一种高营养价值的新型蔬菜。
被子植物在长期进化过程中形成了一种有利于异花授粉、阻碍自体受精的生殖隔离机制——自交不亲和性(self-incompatibility,SI)[4],即指雌雄二性配子均有正常生活受精能力,在不同基因型的株间授粉能正常结籽,但花期自交不能结籽或结籽率极低的特性[5]。目前普遍认为,自交不亲和性由S基因控制,当雌雄性器官具有相同的S基因时,交配不亲和,雌雄双方的S基因不同时交配能亲和[6-7]。根据花器官的形态,SI可分为同型自交不亲和(homomorphic incompatibility)和异型自交不亲和(heteromorphic incompatibility)两大类[8]。在同型SI中,同一物种内所有不同个体花形态相同,此类型在被子植物中较为普遍,如白菜、甘蓝等[9];而在异型SI中,主要表现在雌、雄蕊的相对长度上,异型SI植物主要分布于雨久花科、报春科、茜草科等[10],同型SI植物分布较为广泛普遍。SI作为植物自花授粉的遗传屏障,是植物采取的一种促进异交、避免自交、防止物种退化的精密且有效的机制,在植物进化过程中起着非常重要的作用[11]。我们在育种过程中发现羽衣甘蓝经过多代自交后,自交不亲和系后代有严重退化现象,种子的千粒重几乎是亲和系种子的一半,且生长势衰退,易感病。这些不利因素,都给杂交育种带来困难,严重影响了羽衣甘蓝新品种的创新。目前对羽衣甘蓝自交不亲和系种子退化这一现象的研究非常少,如何有效的保持自交后代的品质是我们急需解决的难题。
DNA甲基化(DNA methylation)是基因组DNA的一种重要表观遗传修饰方式,也是最早发现的基因修饰途径,其作用机制是在DNA甲基转移酶(DNA methyltransferase,DNMT)的催化作用下,以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)为甲基供体,从而将甲基转移到特定碱基上的过程[12]。DNA甲基化现象广泛存在于细菌[13]、植物和动物[14]中,参与生物体的多种生物学过程,包括复制、转录、DNA修复、转基因和细胞分化,是调节基因功能的重要手段之一[15]。在植物中,DNA甲基化主要发生在对称序列CG中,在CHG和CHH (H=A、C 或T)序列中也有发生,异染色质区域的DNA甲基化程度较高。植物基因组的CpG以及CpNpG、CpNpN序列上的C会在MET1 (Dnmt1同源蛋白)或CMT3 DNA甲基转移酶的作用下发生甲基化修饰。同时MET1和CMT3也参与DNA的甲基化,含MET1和CMT3突变的拟南芥胚芽发育不良,说明DNA的甲基化对于植物胚芽和种子发育起到了重要的作用[16]。因此,认为自交不亲和性的自交个体后代易退化现象是由于自交使个体DNA甲基化程度积累产生。
本研究从机理和研究技术都比较成熟的基因组DNA甲基化水平分析入手,选用羽衣甘蓝自交不亲和系9#与自交亲和系14#种子为试材,分析不同时期DNA甲基化状态,从总体上掌握自交不亲和系种子在萌发过程中基因组DNA甲基化的动态变化,探讨DNA甲基化在种子萌发过程中控制基因表达的作用,以期了解自交不亲和系种子退化现象与甲基化的相关性。
1 材料与方法
1.1材料与试剂
东北林业大学花卉生物工程研究所从日本引进的羽衣甘蓝“赤兔”和“白波”两个品种,经九代自交纯化选育,从“赤兔”品种的自交后代中选育出自交不亲和系9#;从“白波”品种的后代中选育出自交亲和系14#。9#和14#经多代严格套袋自交后,收获成熟种子,挑取饱满籽粒,实验室4℃保存。
在干净的培养皿中加2层滤纸,用蒸馏水充分浸湿,将9#与14#种子分别放入培养皿中,每皿30粒,在全自动光照培养箱内培养(22℃,光/暗为16 h/8 h)。取9#种子萌发过程中的第0、第0.5、第1、第2、第4和第8天的种子或幼苗,用液氮冷冻后放入-80℃冰箱保存。取9#与14#种子及萌发2 d的幼苗,用液氮冷冻后放入-80℃冰箱保存。
MSAP试验所用接头和引物均由华大基因合成。MSAP试验所用酶类包括T4连接酶,EcoR I、Hap II、Msp I、rTaq Mix和rATP,均购自TaKaRa公司。聚丙烯酰胺凝胶电泳所有试剂:三羟甲基氨基甲烷(tris)、尿素(urea)、丙烯酰胺(acrylamide)、N’-N’甲叉双丙烯酰(bis-acrylamide)、四甲基乙二胺(TEMED)、亲和硅烷(bind-silane)、剥离硅烷(repel-silane)均购自MYM公司;苯酚、β-巯基乙醇、聚乙烯吡咯烷酮(PVP)、乙二胺四乙酸二钠(EDTA·Na2H2O)、过硫酸铵(AP)、溴酚蓝(bromophenol blue)、二甲苯青(xylene cyanol FF)、甲酰胺(formamide)均购自哈尔滨伊事达生物有限公司;氢氧化钠、冰醋酸、无水乙醇均为分析纯试剂,购自天津市永大化学试剂有限公司;硼酸、硫代硫酸钠(Na2S2O3·5H2O)购自天津市光复科技发展有限公司;无水碳酸钠购自天津市科密欧化学试剂有限公司;氯仿、异戊醇购自北京化工厂;甲醛购自北京益利精细化学品有限公司;十六烷基三甲基溴化铵(CTAB)购自Amresco公司;硝酸银购自上海试一化学试剂有限公司;RnaseA、柱式DNA纯化回收试剂盒,购自北京天根生化技术有限公司。
1.2羽衣甘蓝基因组总DNA提取
采用改良的CTAB法,提取羽衣甘蓝自交不亲和系9#种子萌发过程不同时期(0、0.5、1、2、4和8 d)的基因组DNA及自交亲和系14#种子及萌发2 d种子的基因组,采用NanoDrop ND-2000微量核酸测定仪测定DNA浓度和纯度,并用0.8% (w/v)琼脂糖凝胶电泳检测DNA质量,若主带明亮并且没有拖尾和杂带的现象,则DNA可用于后续试验。
1.3MSAP体系的建立
MSAP分析参考Xiong等的方法[17]。试验采用的接头序列、预扩增引物及选择性扩增引物见表1。
(1)双酶切反应体系25 μL (EcoR I+Hpa II酶切体系):5×R/L缓冲液5 μL,基因组DNA 1 μg,EcoR I (10 U) 0.63 μL,Hpa II (10 U) 0.67 μL,ddH2O补充体积至25 μL。EcoR I+Msp I酶切体系:5×R/L缓冲液5 μL,基因组DNA 1 μg,EcoR I 0.63 μL,Msp I 0.72 μL,ddH2O补充体积至25 μL。37℃酶切2 h,取10 μL酶切产物用0.8% (w/v)琼脂糖凝胶电泳检测,成功的酶切条带成完全弥散状。
(2)连接反应体系25 μL:5 pmol μL-1EcoR I接头0.5 μL,50 pmol μL-1Hpa II/Msp I接头0.5 μL,rATP 1 μL,5×R/L缓冲液2 μL,ddH2O 0.5 μL,1 U μL-1T4 DNA连接酶0.5 μL;酶切产物5 μL。在16℃酒精浴中过夜连接16 h后4℃保存。EcoR I接头5'-CTCGTAGA CTGCGTACC-3',3'-CATCTGACGCATGGTTAA-5';Hpa II/Msp I接头5'-GATCATGAGTCCTGCT-3',3'-AGTACTCAGGACGAGC-5'。
(3)预扩增反应体系25 μL:稀释好的模板DNA 2.5 μL,EcoR I预选引物(8.3 μm) 1 μL;Hpa II/Msp I预选引物(8.3 μm) 1 μL,rTaq Mix 12.5 μL,ddH2O 8 μL。充分混匀后进行PCR预扩增,反应程序如下:94 ℃ 2 min,94℃ 30 s;56℃ 60 s,72℃ 60 s,21个循环;72℃ 7 min,10℃+∞。取预扩增PCR产物,用0.8% (w/v)的琼脂糖凝胶进行电泳检测,理想扩增效果为DNA条带成弥散状分布,-20℃保存。
(4)选择性扩增体系25 μL:稀释好的预扩增产物,0.5 μL;EcoR I选择引物(10 μm) 1 μL,Hpa II/Msp I选择引物(10 μm) 1 μL,rTaq Mix 12.5 μL,ddH2O 10 μL。充分混匀后进行PCR扩增,反应程序如下:94℃10 s,65℃ 30 s (-0.7℃/cycle),72℃ 60 s,13个循环;94℃ 10 s,56℃ 30 s,72℃ 60 s,25个循环。72℃ 7 min,10℃+∞。选择扩增产物变性后进行6% (w/v)聚丙烯酰胺凝胶电泳分离,硝酸银染色后进行泳道条带数及带型统计分析。
1.4MSAP差异条带的统计分析
同裂酶Hpa II和Msp I对基因组DNA的CCGG位点甲基化敏感性不同,Hpa II能识别并切割非甲基化和单链甲基化位点,但不能切割双链甲基化位点;而Msp I可以切割单链或双链上内甲基化位点,但不能切割外甲基化位点。所以在变性聚丙烯酰胺凝胶上,同一基因组DNA序列分别用EcoR I/Hpa II(记为H)和EcoR I/Msp I (记为M)酶切后,都可能出现以下4种谱带情况:I型(H+M+,记为11):均有带,代表该位点无甲基化;II型(H+M-,记为10):H有带,而M无带,代表该位点为单链外侧胞嘧啶甲基化;III型(H-M+,记为01):M有带,而H无带,代表该位点为双链内侧胞嘧啶甲基化。IV型(H-M-,记为00):均无带,代表无CCGG位点或该位点为双链外侧胞嘧啶甲基化或双链内外侧胞嘧啶甲基化。
由于Hpa II和Msp I两个同裂酶对CCGG位点胞嘧啶的甲基化敏感存在差异,将限制性内切酶不能识别、切割且没有扩增产物标记为“0”,而能被同裂酶识别、切割且有扩增产物标记为“1”。对9#种子萌发过程中的后一个生长阶段DNA甲基化状态与前一个生长阶段DNA甲基化状态进行比较,根据带型的有无,将DNA甲基化位点模式分为两大类:一类是单态性位点,即同一CCGG位点带型相同,甲基化模式保持不变,包括D1~D2;一类是多态性位点,即带型有差异,显示多态性条带。将多态性位点又细划分为五类:A类为去甲基化类型,包括从甲基化状态到非甲基化状态,以及从双链外侧、双链内外侧甲基化状态到单链外侧、双链内侧甲基化状态;B类为甲基化类型,即从非甲基化状态到甲基化状态,以及从单链外侧、双链内侧甲基化状态到双链外侧、双链内外侧甲基化状态;C类为不定向变异类型,包括从单链外侧甲基化到双链内侧甲基化和从双链内侧甲基化到单链外侧甲基化。
本试验甲基化条带计算公式:(1)扩增条带总数:I+II+III型条带数;表示引物扩增出的CCGG位点总数。(2)甲基化条带总数:II+III型条带数,表示CCGG位点中发生了甲基化的位点总数。(3)甲基化比率(MSAP%):II+III型条带数占总扩增条带数的比例,表示基因DNA的整体甲基化水平。(4)半甲基化条带数及半甲基化比率:II型条带数;II型条带数占总扩增条带数的比例,表示半甲基化水平。全甲基化条带数及全甲基化比率:III型条带数;III型条带数占总扩增条带数的比例,表示全甲基化水平。

表1 接头和引物序列Table 1 Sequences of adaptors and primers
2 结果与分析
2.1羽衣甘蓝自交不亲和系种子萌发过程基因组DNA甲基化水平
提取种子萌发不同时期基因组DNA,建立6个DNA反应体系,分别用限制性内切酶组合EcoR I/Hpa II和EcoR I/Msp I进行消化、连接、预扩增和选择性扩增等步骤,从90对引物组合中筛选出20对扩增结果多态性高、重复性好、可获得清晰条带的引物组合,对大小位于200~1000 bp范围内的DNA片段进行谱带统计(表2)。I为H、M酶切均有位点;II为H酶切有位点,M酶切无位点;III为M酶切有位点,H酶切无位点。
9#种子在萌发过程中扩增出的条带总数为676~712,其中甲基化条带总数为162~202,全甲基化条带数为91~130,半甲基化条带数为62~80,由此可见,萌发过程中双链内侧胞嘧啶甲基化程度始终高于单链外侧胞嘧啶甲基化程度。9#种子萌发过程中各个时期的DNA甲基化水平有差异,总甲基化水平呈现出先缓慢上升再明显下降的趋势,在萌发2 d时达到最高为28.9%,萌发8 d时达到最低为22.7%,且低于0 d时的总甲基化水平25.4%;双链全甲基化水平变化趋势与总甲基化水平变化相似,也是先上升再下降,不同的是在萌发1 d时达到最高为18.7%;单链半甲基化水平变化较为复杂,在0~1 d半甲基化水平逐渐降低,1 d时达到最低为8.9%,随后在2 d时明显升高到11.4%,然后又缓慢下降到萌发8 d时为9.9%,且比0 d半甲基化水平11.1%低。从整个萌发阶段比较,9#种子在萌发2 d时总甲基化、半甲基化水平最高,在萌发8 d时甲基化、半甲基化、全甲基化水平最低。

表2 9#种子萌发过程不同时期基因组DNA甲基化水平Table 2 Methylation levels of 9#at different development stages during seeding germination
2.2羽衣甘蓝自交不亲和系种子萌发过程中相邻发育时期基因组DNA甲基化模式
对9#种子萌发过程中的后一个生长阶段DNA甲基化状态与前一个生长阶段DNA甲基化状态进行比较,统计甲基化模式变化类型的数目(表3)。多态性位点占甲基化位点比例越高,说明在此发育阶段内甲基化模式发生变化越多,也就是在此发育阶段内发生甲基化和去甲基化过程越多。9#种子在萌发过程中,相邻发育时期多态性比例分别为15.0%、16.4%、20.3%、22.6%和10.0%,表明大部分甲基化位点并未发生甲基化模式变异。其中0~4 d发育阶段内,多态性比例逐渐升高,并在萌发4 d时比例达到最高,表明在0~4 d内随着种子的萌发甲基化模式发生变异增多,暗示发生甲基化和去甲基化过程增多;而在4~8 d这一发育阶段,多态性比例快速下降(29.1%、13.3%),表明甲基化模式变异减少。种子萌发过程中,A类型在多态性位点数的比例分别为65.7%、54.7%、50.8%、72.3%和91.7%,呈现先缓慢减小再快速增大的趋势,可以看出在0~2 d这一阶段发生甲基化数目持续增多,但在2~8 d这一阶段发生去甲基化的数目大量增加,最终导致去甲基化位点数目是甲基化位点数目的11倍。无论是种子萌发过程中的哪一个时期,A类型都是多态性位点的最主要类型,发生去甲基化的位点数高于发生甲基化的位点数,可见9#种子在萌发过程中同时存在DNA的甲基化和去甲基化作用,从整体上来看,以去甲基化为主。羽衣甘蓝自交不亲和系9#种子发育过程中的同一位点甲基化的反复变化可以说明部分基因在其发育过程中经历了反复的表达和沉默,这些位点高频率的变化可能与发育有关,这些位点的具体功能还需要后续测序并对其进行功能性的验证。
2.3羽衣甘蓝自交不亲和与自交亲和系种子基因组DNA甲基化差异分析
对羽衣甘蓝自交不亲和系9#种子萌发过程不同时期的基因组DNA甲基化水平研究发现,9#种子在萌发2 d时基因组DNA甲基化水平达到最高。为探究自交不亲和系与自交亲和系种子萌发过程中基因组DNA甲基化水平的差异,选取萌发2 d这一特殊的发育时期,以9#与14#种子萌发0 d和2 d为试材,进行MSAP分析,统计扩增条带(表4)。
由表可知,相同发育时期的9#与14#相比较,9#总甲基化、全甲基化、半甲基化水平均高于14#;无论是9#还是14#,萌发2 d时的总甲基化、全甲基化、半甲基化水平均高于0 d。从0~2 d,9#总甲基化水平上升幅度(25.4%~28.9%)与14#总甲基化水平上升幅度(21.3%~24.4%)接近,9#全甲基化水平上升幅度(14.3%~17.4%)明显高于14#(13.6%~14.1%),而14#半甲基化水平上升幅度(7.7%~10.3%)明显高于9#(11.1%~11.4%)。在9#和14#种子发芽0 d和2 d这2个时期,全甲基化水平均高于半甲基化水平,表明在这一发育阶段中,双链内侧胞嘧啶甲基化为9#和14#基因组DNA甲基化主要方式。
3 讨论
DNA甲基化在植物的生长发育及基因表达调控等过程中发挥着重要作用[18],是植物表观遗传修饰的主要方式之一[19-20]。大量的证据表明,在植物发育不同阶段,植物主要以胞嘧啶甲基化来调控基因表达[21],与其他植物一样,羽衣甘蓝种子的生长发育实际上就是基因有序调控表达的过程,因此本试验采用MSAP方法对羽衣甘蓝种子胞嘧啶甲基化水平进行研究。在植物种子胚胎发生早期,正确的甲基化模式是确保合子正常分裂并最终发育成有生命活力种子的基础[22]。为了研究羽衣甘蓝自交不亲和系种子退化与DNA甲基化的相关性,就要明确种子萌发过程中DNA甲基化的变化规律和特点。从本文研究结果中可看到,羽衣甘蓝9#种子在萌发过程中,其甲基化水平变化明显,模式变化频繁、样式众多、涉及位点也较多。
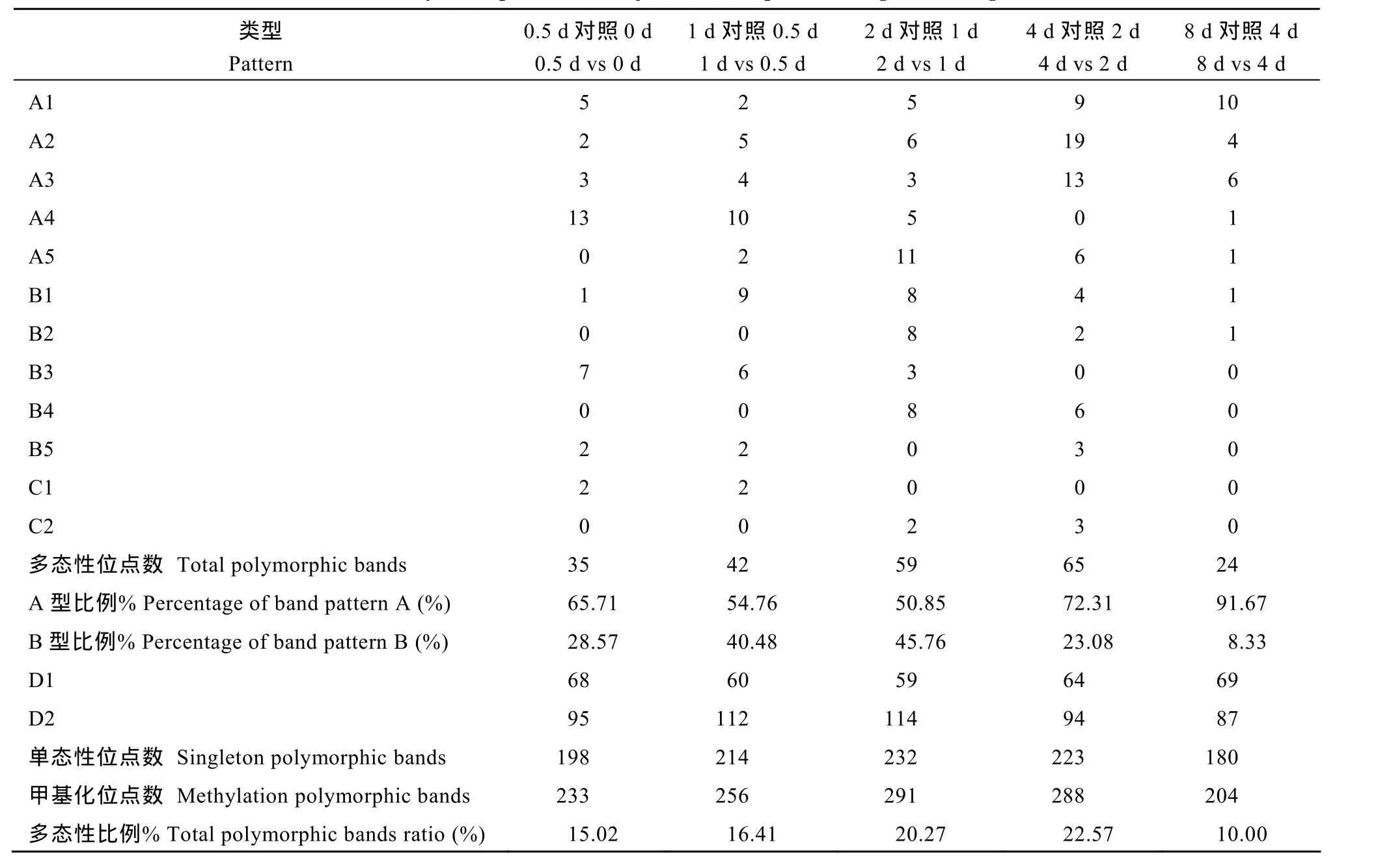
表3 9#种子萌发过程中相邻发育时期DNA甲基化变化模式Table 3 DNA methylation patterns of adjacent developmental stages in seed germination

表4 9# 与14#种子在萌发0 d、2 d基因组DNA甲基化水平Table 4 Methylation levels of 0 h and 48 h at seeding stages of 9#and 14#
在高等植物中,种子胞嘧啶甲基化水平因植物种类而异,油菜种子甲基化水平为15.7%[23],大麦种子甲基化水平为60.5%[24],不同生态型的拟南芥中为35.0%~43.0%[25]。这些不同物种间种子DNA甲基化水平的差异,一方面可能与检测方法、试验条件有关,另一方面可能是遗传控制的结果。本研究结果显示,无论在9#种子萌发的哪一个时期中,全甲基化水平均高于半甲基化水平,表明双链内侧胞嘧啶甲基化程度始终高于单链外侧胞嘧啶甲基化程度,9#种子在萌发过程中CCGG位点发生甲基化的方式主要是以双链内侧胞嘧啶甲基化为主,这与甘蓝型油菜种子萌发过程一致[23]。从甲基化模式变化上来看,在萌发早期(0~2 d),发生甲基化的多态性条带占多态性条带比例逐渐升高,并在萌发48 h时比例达到最高,表明在0~2 d内随着种子的萌发,甲基化发生增多;在萌发后期(2~8 d),发生甲基化的多态性条带比例快速下降并在萌发8 d时比例达到最低,表明在2~8 d内随着种子的萌发,去甲基化发生增多,从而可能导致在植物生长发育中部分必要的基因表达关闭,这可能与自交不亲和系种子退化现象有关;在萌发后期(2~8 d)主要发生大量去甲基化过程,激活部分基因的表达,整体上来看,9#种子萌发过程中,主要发生去甲基化事件。这一结果和陆光远等在油菜种子萌发过程中DNA甲基化的MSAP分析一致[24]。
前人的研究资料表明,植物在发育过程中,胞嘧啶的甲基化对基因具有重要的表达调控作用,在基因的内部或邻近区域发生甲基化可以抑制这些基因的表达,而去甲基化后又可以激活基因的表达,因此,对于这些基因而言,去甲基化似乎是基因表达的必须步骤。羽衣甘蓝种子萌发过程中检测到大量的去甲基化事件,是与种子萌发后启动了大量基因的表达相一致的。在种子萌发过程中同时还观察到少量的甲基化事件,暗示部分基因正在关闭。这表明,植物通过DNA甲基化和去甲基化的方式实现基因的有序表达。
成长于相同环境下的2个羽衣甘蓝品种自交不亲和系9#和自交亲和系14#在种子活力、幼苗长势、植株表型等方面有着不同的表现,尽管大多数的表型变异来自于自然遗传变异,但是否与种子萌发过程中甲基化变化情况有关,这仍需我们研究探索。目前已有对相同植物种属的不同品种间甲基化修饰水平的研究报道,如在对大麦2个品种Steptoe (六棱饲草大麦,高度休眠)和Morex (六棱啤酒大麦,无休眠)种子成熟和萌发过程中全基因组DNA甲基化多样性的研究发现,表观遗传变异(15%)高于基因组遗传变异(6.9%),在大麦种子成熟和萌发不同时期,Morex的DNA甲基化水平略高于相应时期StePtoe的DNA甲基化水平[25]。对4个烟草品种云烟85、北卡89、K326、云烟87的基因组DNA甲基化研究发现[26],同一地点同一取样时间的不同品种间甲基化情况有很大差异,表明相同植物种属的不同品种间甲基化修饰水平不同。本试验对相同种属的2个不同品种9#与14#种子萌发0 d和2 d全基因组DNA甲基化情况进行研究,旨在探索自交不亲和系9#种子退化现象与甲基化的相关性。试验结果表明,羽衣甘蓝自交亲和系与自交不亲和系这两个品系之间所表现出来的较大的甲基化状态差异,可能会影响基因在种子发育过程中经历表达和沉默,而这些基因表达的开启和关闭,可能是自交不亲和9#种子退化,植株发育退化的原因之一。
4 结论
利用MSAP技术,对羽衣甘蓝自交不亲和系9#种子萌发过程不同时期基因组DNA甲基化差异的研究中得到:萌发过程中总甲基化水平呈现出先缓慢上升再明显下降的趋势;同时发生甲基化与去甲基化,但是去甲基化占主导地位;此外在种子发育过程中还发现同一位点甲基化模式的反复变化现象。对羽衣甘蓝自交不亲和系9#种子与自交亲和系14#种子的DNA甲基化差异研究中得到:在相同发育时期,9#的总甲基化、半甲基化、全甲基化水平在不同程度上均高于14#,二者CCGG位点发生甲基化的方式都主要以双链内侧胞嘧啶甲基化为主;随着种子的萌发,9#全甲基化水平明显升高,半甲基化水平几乎无变化;而14#半甲基化水平明显升高,全甲基化水平几乎无变化。这些结果为进一步探讨羽衣甘蓝生长发育及器官分化过程中甲基化与去甲基化对相关基因表达调控的作用奠定了基础。
References
[1]黄凌晖.不同品种羽衣甘蓝观赏性状,硫苷含量及抗虫性状研究.浙江农林大学硕士学位论文,浙江杭州,2012 Huang L H.Ornamental Traits,Glucosinolates Content and Insect-Resistant Traits Research of Brassica oleracea var.acephala D.C.in Different Varieties.MS Thesis of Zhejiang A&F University,Hangzhou,China,2012
[2]赵秀枢,李名扬,张文玲,刘凡.观赏羽衣甘蓝高频再生体系的建立.基因组学与应用生物学,2009,28:141-148 Zhao X S,Li M Y,Zhang W L,Liu F.The establishment ofhigh-frequency regeneration system in Brassica oleracea var.acephala D.C.Genom Appl Biol,2009,28:141-148
[3]李惠芬,钱芝龙.羽衣甘蓝创新种质形态学特征研究.北方园艺,2005,(3):56-58 Li H F,Qian Z L.The morphological features researches of new germplasm in Brassica oleracea var.acephala D.C.Northern Hortic,2005,(3):56-58
[4]Zhang Y J,Zhao Z H,Xue Y B.Roles of proteolysis in plant self-incompatibility.Annu Rev Cell Dev Biol,2009,60:21-42
[5]寇小培.分子标记辅助选育甘蓝型油菜自交不亲和系.华中农业大学硕士学位论文,湖北武汉,2012 Kou X P .Molecular Marker Assisted Breeding B.napus Rape of Selfing Incompatibility.MS Thesis of Huazhong Agricultural University,Wuhan,China,2012
[6]何余堂,涂金星,傅廷栋,陈元宝.芸薹属自交不亲和基因的分子生物学及进化模式.植物学通报,2004,20:513-521 He Y T,Tu J X,Fu T D,Chen Y B.Molecular biology and evolution mode of selfing incompatibility gene in Brassica.Chin BullBot,2004,20:513-521
[7]孟金陵,刘定副,罗鹏.植物生殖遗传学.北京:科学出版社,1995 Meng J L,Liu D F,Luo P.Plant Reproductive Genetics.Beijing:Science Press,1995
[8]于晓敏.羽衣甘蓝SRK和SCR的克隆表达及克服自交不亲和性的研究.东北林业大学硕士学位论文,黑龙江哈尔滨,2007 Yu X M.Cloning and Overcome the Selfing Incompatibility the Research of SRK and SCR in Brassica oleracea var.acephala D.C.MS Thesis of Northeast Forestry University,Harbin,China,2007
[9]薛勇彪,崔海洋,赖钊,胡适宜.不亲和性和自交不亲和性及其分子生物学基础:被子植物受精生物学.北京:科学出版社,2002.pp 128-148 Xue Y B,Cui H Y,Lai Z,Hu S Y.Molecular Biological Basis of Incompatibility and Self Incompatibility:Fertilization Biology of Angiosperms.Beijing:Science Press,2002.pp 128-148
[10]景欣.羽衣甘蓝自交亲和系及自交不亲和系的基因组DNA甲基化水平差异分析.东北林业大学硕士学位论文,黑龙江哈尔滨,2010 Jing X.Genomic DNA Methylation Level Variance Analysis of SC and SI in Brassica oleracea var.acephala D.C.MS Thesis of Northeast Forestry University,Harbin,China,2010
[11]王嘉为.羽衣甘蓝自交不亲和性克服探讨.现代园艺,2015,(4):4 Wang J W.Overcome selfing incompatibility of Brassica oleracea var.acephala D.C.Modern Hort,2015,4:4
[12]Berger F,Chaudhury A.Parental memories shape seeds.Trends Plant Sci,2009,14:550-556
[13]Grafstrom R H,Yuan R,Hamilton D L.The characteristics of DNA methylation in an in vitro DNA synthesizing system from mouse fibroblasts.Nucl Acids Res,1985,13:2827-2842
[14]Martienssen R A,Colot V.DNA methylation and epigenetic inheritance in plants and filamentous fungi.Science,2001,293:1070-1074
[15]李娜,张旸,解莉楠,李玉花.植物DNA甲基化研究进展.植物生理学报,2012,48:1027-1036 Li N,Zhang Y,Xie L N,Li Y H.The research progress of plant DNA methylation.Plant Physiol Commun,2012,48:1027-1036.
[16]Xiao W,Custard K D,Brown R C,Lemmon B E,Harada J J,Goldberg R B,Fischera R L.DNA methylation is critical for Arabidopsis embryogenesis and seed viability.Plant Cell,2006,18:805-814
[17]Xiong L Z,Xu C G,Maroof M A S,Zhang Q.Patterns of cytosine methylation in an elite rice hybrid and its parental lines,detected by a methylation-sensitive amplification polymorphism technique.Mol General Genet,1999,261:439-446
[18]杨金兰,柳李旺,龚义勤,黄丹琼,王峰,何玲莉.镉胁迫下萝卜基因组DNA甲基化敏感扩增多态性分析.植物生理与分子生物学学报,2007,33:219-226 Yang J L,Liu L W,Gong Y Q,Huang D Q,Wang F,He L L.Radish genomic DNA methylation sensitive amplification polymorphism analysis under Cadmium stresses.J Plant Physiol Mol Biol,2007,33:219-226
[19]Ikeda Y,Kinoshita T.DNA demethylation:a lesson from the garden.Chromosoma,2009,118:37-41
[20]Zilberman D.The evolving functions of DNA methylation.Curr Opin Plant Biol,2008,11:554-559
[21]Zheng X,Pontes O,Zhu J,Miki D,Zhang F,Li W X,Lida K,Kapoor A,Pikaard C S,Zhu J K.ROS3 is an RNA-binding protein required for DNA demethylation in Arabidopsis.Nature,2008,455:1259-1262
[22]Gehring M,Bubb K L,Henikoff S.Extensive demethylation of repetitive elements during seed development underlies gene imprinting.Science,2009,324:1447-1451
[23]Xiao W,Custard K D,Brown R C,Lemmon B E,Harada J J,Goldberg R B,Fischer R L.DNA methylation is critical for Arabidopsis embryogcnesis and seed viability.Plant Cell,2006,18:805-814
[24]陆光远,伍晓明,陈碧云,高桂珍,许鲲,李响枝.油菜种子萌发过程中DNA甲基化的MSAP分析.科学通报,2005,50:2750-2756 Lu G Y,Wu X M,Chen B Y,Gao G Z,Xu K,Li X Z.MSAP analysis of DNA methylation in germination process of rape seed.Chin Sci Bull,2005,50:2750-2756
[25]乔幸.大麦种子成熟和萌发过程DNA甲基化多样性分析.四川农业大学硕士学位论文,四川成都,2011 Qiao X.Analyzing the Diversity of DNA Methylation of Barley Seed in Maturation and Germination Processes.MS Thesis of Sichuan Agricultural University,Chengdu,China,2011
[26]Cervera M T,Ruiz-Garcia L,Martinez-Zapater J M.Analysis of DNA methylationin Arabidopsis thaliana based on methylation-sensitive AFLP markers.Mol Genet Genom,2002,268:543-552
URL:http://www.cnki.net/kcms/detail/11.1809.S.20151218.0915.016.html
DNA Methylation Dynamic Analysis of Self Compatible Line and Self-Incompatible Line of Brassica oleracea var.acephala at Seed Germination Stage
ZHANG Yang1,HU Zhong-Ying1,ZHAO Yue-Ming1,LI Na2,and XIE Li-Nan1,*1College of Life Sciences,Northeast Forestry University,Harbin 150040,China;2Heilongjiang Vocational College of Biology and Technology,Harbin 150025,China
Abstract:The seed of self-incompatible line often degraded.This study aims to clarify the relationship between the degradation of the seeds and methylation.In this experiment,methylation sensitive amplification polymorphism (MSAP) was used to study the status and patterns of the DNA methylation at different periods in seed germination of self-incompatible line 9#and self-compatible line 14#.The improved CTAB method is adopted to extract seed germination in different periods of DNA,and then through the MSAP analysis,statistical amplification bands,compare the differences between 9#and 14#.The results are shown as follows:DNA methylation modification throughout the whole process of seed germination of 9#,at the early stage of the germination (0 to 2 days) methylation sites continued to increase;at the later stage (2 to 8 days) demethylation increased apparently,and eventually the number of demethylation was 11 times more than methylation.It was proved that DNA methylation modification was an important way to regulate the gene expression during seed germination of self-incompatible line 9#.Self-incompatible line 9#and self-compatible line 14#had different DNA methylation status clearly at the respectively periods of 0 and 2 days after seed germination.The proportion of total methylation,full-methylation and semi-methylation of 9#was all higher than of 14#at the same period.As seedings continued to grow after germination,in 9#,the proportion of full-methylation increased clearly and almost that of semi-methylation did not change,while in 14#,the proportion of semi-methylation increased clearly andbook=533,ebook=72almost that of full-methylation did not change.
Keywords:Brassica oleracea var.acephala;Self-incompatibility;Self-compatibility;DNA methylation
收稿日期Received():2015-07-21;Accepted(接受日期):2015-11-20;Published online(网络出版日期):2015-12-18.
*通讯作者(
Corresponding author):解莉楠,E-mail:linanxie@126.com
DOI:10.3724/SP.J.1006.2016.00532

