地诺单抗在骨巨细胞瘤治疗中的应用研究进展
何韶辉 许炜 肖建如
作者单位:200003 上海,第二军医大学附属长征医院骨肿瘤外科通信作者:肖建如,Email:jianruxiao83@163.com
A brief review of denosumab for the therapeutical application of giant cell tumor of the bone
HE Shao-hui,XU Wei,XIAO Jian-ru.Department of Orthopedic Oncology,Changzheng Hospital,the second Military Medical University,Shanghai,200003,PRC
地诺单抗在骨巨细胞瘤治疗中的应用研究进展
何韶辉 许炜 肖建如
作者单位:200003 上海,第二军医大学附属长征医院骨肿瘤外科通信作者:肖建如,Email:jianruxiao83@163.com
A brief review of denosumab for the therapeutical application of giant cell tumor of the bone
HE Shao-hui,XU Wei,XIAO Jian-ru.Department of Orthopedic Oncology,Changzheng Hospital,the second Military Medical University,Shanghai,200003,PRC
【关键词】骨巨细胞瘤;核因子 κB 受体活化因子;药理作用;地诺单抗
2013 年,美国食品药品监督局 (FDA) 正式批准denosumab (地诺单抗,商品名叫 Xgeva 或 Prolia) 用于复发、手术不可完全切除及发生转移的骨巨细胞瘤 (giant cell tumor,GCT) 患者的临床治疗[1]。denosumab 作为全人源性单克隆抗体,对外科手术无法干预的 GCT 患者有着很好的疗效及生物安全性。笔者通过将“denosumab”、“RANKL”、“骨巨细胞瘤”、“骨相关事件”等作为关键词,计算机检索数据库 Pubmed、EMBASE、中国知网、维普中文科技期刊数据库,重点回顾近 5 年来关于denosumab 的作用机制及在治疗 GCT 的临床应用和最新研究进展。
一、GCT
1.流行病学概况:目前认为 GCT 多数具有局部侵袭性,少数可有多中心病灶或发生肺转移[2-4],而关于多中心病灶是单个病变多发转移还是多个原发病变目前尚不明确[5-6]。GCT 约占所有骨原发肿瘤的 4%~5%[7],在中国GCT 更为常见,约占所有原发骨肿瘤的 20%[8],常见于20~40 岁的女性,好发于长骨干骺端,约 50% 发生在股骨下端和胫骨上端,其中少数严重者可侵犯至软骨下,出现关节受累,需要更大范围的手术切除[8],中轴骨是 GCT的另一个好发部位,其中以骶骨最多见,约占 GCT 总数的 2%~8%[9],极少部分可见于指骨[10]。
2.临床诊疗现状:GCT 在 X 线片上为密度较低的溶骨性损害而无明显的钙化[11]。Campanacci 等[12]根据其影像学表现将其分为 3 级:1 级:潜在性,边界清楚,可见一薄硬化带,少见但预后较好;2 级:活跃性,最常见,皮质变薄,硬化带缺如;3 级:侵袭性,边界清楚,常伴皮质破坏和软组织肿块,预后较差。组织学上,GCT 表现为成片的卵圆形的单核瘤性细胞均匀分布于巨细胞样的破骨细胞之间,高表达核因子 κB 活化因子的配体 (receptor activator of nuclear factor κB ligand,RANKL)[13]。临床表现为肿胀、疼痛及骨相关事件 (skeletal related events,SREs),后者包括病理性骨折、脊髓压迫及骨质疏松等[14]。目前,针对原发 GCT 的治疗虽然仍以外科手术治疗为主,包括病灶内刮除和 en bloc 切除及瘤壁内灭活、植骨或骨水泥填塞[10,15],然而,长期随访显示外科治疗面临着较高的局部复发率,治疗效果往往较差,Errani 等[16]在一项单中心大样本 GCT 患者的回顾性统计分析中提到,病灶内刮除术后复发率达到了 16% (32/200),病灶切除术后复发率则为 12% (18/149);总的肺转移率达到 4% (14/349)。另一项统计分析显示原发性 GCT 行单纯病灶内刮除后,在平均 64.2 个月的随访期内局部复发率达到了 55% (140/256)[17]。对于手术无法切除、外科治疗后反复复发及发生转移的难治性 GCT 患者,手术的作用十分有限,首选非手术治疗[18]。而以 denosumab 为代表的细胞生物学治疗在上述类型的患者中表现出良好的疗效及生物全性。
二、denosumab 的研发与作用机制
denosumab 是一种全人源性的、具有对 RANKL 高度亲和性的单克隆抗体。RANKL 是细胞核因子 κB (receptor activator of nuclear factor κB,RANK) 受体特异性活化因子的配基,后者属于肿瘤坏死因子受体 (tumor necrosis factor receptor,TNFR) 超家族[19-20]。
1.RANKL 介导的骨代谢:RANK、RANKL 及骨保护素 (osteoprotegerin,OPG) 三者之间的联系是调节骨代谢最重要的因素,而三者作用的最终目的是保证破骨细胞和成骨细胞代谢处于平衡的状态[21]。通过观察实验小鼠RANK 基因敲除后骨代谢的情况发现,在正常情况下,成骨细胞可分泌 RANKL,后者可特异性地与表达在破骨细胞前体细胞膜上的 RANK 结合,促进破骨细胞的分化和成熟,同时 RANKL/RANK 还可增强破骨细胞的活性,而基因敲除后的小鼠破骨细胞出现成熟障碍,活性明显降低[22]。同样,OPG 基因缺陷的小鼠因为破骨细胞失去了拮抗机制而较早地出现骨质疏松和动脉硬化[1,23]。当体内破骨细胞活动过强或者成骨作用较弱时,OPG 作为 RANKL的内源性抑制因子,可以通过结合 RANKL 介导后者的溶解,阻止 RANKL 与 RANK 的结合从而抑制破骨细胞的成熟并降低其活性,使成骨与破骨活动趋于平衡,在 GCT 和其它骨转移瘤中,肿瘤细胞可分泌相关刺激因子直接或间接上调 RANKL 的表达,促进破骨细胞分化成熟并增加其活性,导致溶骨性损害及 SREs 的发生 (图 1)[24-25]。此外,相关实验也证明,通过体外抑制 RANKL 活性,可阻碍肿瘤细胞的增殖与转移[26]。因而总结来看,正是肿瘤细胞明显上调表达了 RANKL,大大超过了机体 OPG 对其溶解抑制作用,从而介导了骨质溶解。
2.denosumab 是基于 RANKL 的研发:1997 年,Amgen公司研究大鼠 cDNA 文库时发现了一种能够抑制破骨细胞活性并增加骨密度的细胞因子,即目前的 OPG,而后将OPG 作为探针,便找到了与其特异性结合的 RANKL[27]。正是基于 RANKL 在骨代谢中的靶点作用,Amgen 公司研究设计的全人源化 RANKL 的单克隆抗体通过模仿机体内源性 OPG 的作用机制,特异性结合 RANKL 使其溶解,阻止 RANKL/RANK 介导的破骨细胞的分化、成熟及活化,进而防止骨质溶解及骨相关事件的发生。denosumab 剂型一般为 120 mg/1.7 ml,给药一般为上臂、大腿或腹部皮下注射 120 mg/次,每 4 周 1 次,其吸收通过淋巴系统调节,生物利用度为 61%[24]。和其它单克隆抗体类似,Sohn 等[28]发现,正常对照组和晚期肿瘤组患者的药物代谢动力学曲线在低剂量下 (60 mg/次) 表现为非线性,而在高剂量下表现为剂量依赖性,且在不同肿瘤类型的患者中差异无统计学意义。血药浓度高峰出现在注射后 10 天左右,稳定期中位血药浓度维持在 20.5 μg/ml,中位半衰期为 29 天,而 denosumab 的消除主要通过网状内皮系统或者内皮细胞的蛋白水解作用,故不需要因为个体肾功能的差异而调整剂量,或因肾功能较差而视为用药禁忌。
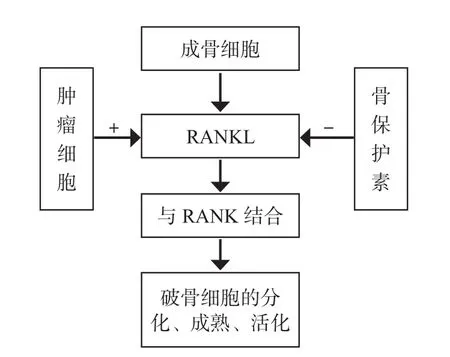
图 1 RANKL/RANK 介导的骨代谢Fig.1 Bone metabolism mediated by RANKL/RANK
三、denosumab 在 GCT 中的临床应用
目前,FDA 已经批准 denosumab 作为骨质疏松 (绝经后骨质疏松)、延缓骨转移癌患者骨相关并发症 (病理性骨折、脊髓压迫等) 的发生、恶性肿瘤患者高钙血症、芳香化酶和雄激素缺乏所诱导的骨质丢失以及 GCT 患者的临床治疗[1]。
2000 年,在相关研究指出 denosumab 可以抑制 GCT 的 RANKL 而达到抑制破骨细胞分化、成熟及活化后[29],一系列个案报道及临床试验也相继证明 denosumab 在 GCT患者中的良好疗效。Vaishya 等[30]报道了 3 例 GCT 个案(分别累及肱骨近端、骶骨和股骨近端):患者因手术无法切除或者术后复发、疼痛明显而接受 denosumab 皮下注射治疗 (120 mg/次,每 28 天 1 次),首月在注射后 8、15 天加注,随访 25 周,治疗后 6 个月出现良好的组织学和影像学反应,前者表现为病灶中出现纤维骨组织的沉积和钙化,受累骨皮质硬化,病灶中出现活性骨组织,后者为肿块无进展甚至缩小。Thomas 等[31]报道了在一项二期临床试验中,37 例术后复发或手术无法切除的 GCT 患者接受 denosumab 治疗 (方案同上),86% 的患者 (95% CI:70%~95%) 出现肿瘤学反应,其中接受组织学检查的 20 例至少 90% 的 GCT 被消除,而接受放射学检查的15 例中有 10 例提示肿瘤行为无影像学进展。而在另一项临床二期试验发现,denosumab 的术前应用有利于外科手术分期的下调,以至于不需要手术或者较低级别手术的治疗[32]。Branstetter 等[33]同样报道了一项 17 例 GCT 患者的临床二期试验,结果显示 denosumab 可明显减少或消除RANK 活化的肿瘤巨细胞,同时可降低病灶中增殖性肿瘤基质细胞的比例,代之以非增殖型分化良好的新骨组织。在另一项临床队列研究中,Broto 等[34]报道了对队列 1 的170 例手术无法切除的骨肿瘤患者 (主要为骶骨 GCT 及部分恶性肿瘤骨转移) 和队列 2 的手术切除可能存在严重并发症的 GCT 患者 (如关节切除、截肢及半骨盆切除等) 在接受 denosumab 治疗前后分别进行疼痛评分,结果显示治疗后 2 个月内,绝大多数患者临床相关的疼痛得到明显减轻,并且在整个随访过程中没有 1 例需要镇痛药的辅助。
目前,双膦酸盐 (bisphosphonates) 已成为临床上恶性肿瘤骨转移患者为防止或延缓 SREs 发生及骨质疏松症的首选用药[24],包括常见的乳腺癌、前列腺癌以及肺癌患者等[35-36],同时也被推荐治疗 GCT。Tse 等[37]在一项回顾性研究中也报道了双膦酸盐组治疗 GCT 较对照组局部复发率更低 (1/24 vs.6/20)。然而,与双膦酸盐相比,denosumab 显示出明显优越性,Lau 等[38]报道了两者在GCT 中的抗肿瘤效应,结果显示唑来膦酸可明显抑制正常细胞的增殖,呈现剂量依赖性,并可诱导细胞凋亡,而后者几乎不抑制细胞增殖或诱导细胞凋亡;同时唑来膦酸强烈抑制 RANKL 的 mRNA 表达水平,而蛋白质水平并无改变,后者在两个水平都不出现明显的抑制。另外,在其它骨肿瘤治疗中,denosumab 也具有更好的疗效及生物安全性。一项 Meta 分析报道,denosumab 在减少 SREs 的发生比双膦酸盐更有效[39-41]。而传统的常规化疗和干扰素治疗在相关研究中虽然同样对 GCT 有良好的反应,但这些有效性都是以明显增加肾毒性为代价的[42]。鉴于 denosumab 在 GCT 上的良好疗效和较低副作用,随着研究的进一步深入,未来临床上对 denosumab 的应用势必愈加广泛。
四、讨论与展望
尽管 denosumab 与其它药物相比显示出明显优越性及广泛的适应证,但是,目前关于 denosumab 在 GCT 中的临床应用仍存在着很多问题和局限性:GCT 患者接受denosumab 治疗的最佳时间是何时?对于不同类型的 GCT及其它疾病患者是否需要调整治疗方案,何时可以停药?停药后是否会出现肿瘤复发?长期用药疗效如何[1]?长期用药对骨密度是否会有影响?Karras 等[43]报道了 1 例10 岁患有转移性 GCT 女孩,其接受 20 个月的 denosumab治疗后出现骨质过度硬化的状态,增加了骨折的风险。相关的临床试验也提到 denosumab 对骨密度的不良影响[44]。denosumab 在治疗过程中易出现严重的低钙血症,一项研究显示,尽管事先给予患者口服维生素 D 和钙剂,denosumab组发生低钙血症的比例仍然高于唑来膦酸组 (9.6% vs.5.0%)[45],相关研究报道了 denosumab 还可引起下颌骨的骨坏死 (osteonecrosis of the jaw,ONJ) 及机体严重的过敏反应[46-47]。另外 denosumab 并不适用于严重的肾功能不全患者 (内生肌酐清除率<30 ml/min 或 CKD 4 期或5 期)[44,48];对于青少年 GCT 患者,denosumab 会严重影响牙齿和骨骼的发育,虽然也有报道称青少年群体能够良好耐受 denosumab 并有证据显示有效地延缓疾病的进程[49],但 denosumab 是否真的适用于骨骺尚未愈合的青少年人群仍需要大样本的临床试验来证明。对于孕妇而言,作为 FDA 规定的 C 类药,目前并没有足够的研究数据证明 denosumab 对妊娠期妇女及胎儿没有影响,相反地,一项动物实验提示,denosumab 对胎儿淋巴结发育及产后泌乳具有不良影响[50]。Fernández 等[51]指出长期使用denosumab 可增加泌尿系感染的风险。还需要注意的是,部分对 denosumab 反应较差的患者,应考虑到将巨细胞肉瘤或富含巨细胞的骨肉瘤误诊为 GCT 的可能性[31]。
虽然上述讨论提到 denosumab 仍存在很多问题,但作为全人源性高度亲和性的单克隆 RANKL 拮抗剂,其在手术无法切除、术后复发、多中心病灶及少数转移性 GCT患者中的疗效和生物安全性是肯定的。当然仍需要一系列临床多中心对照试验来进一步确定 denosumab 在不同 GCT患者中的规范治疗,同时避免相关并发症的发生。相信在未来,对于手术难以干预的 GCT 患者,denosumab 不失为绝佳选择之一。
参考文献
[1]Singh AS,Chawla NS,Chawla SP.Giant-cell tumor of bone:treatment options and role of denosumab.Biologics,2015,9:69-74.
[2]Du H,Xu H,Che G.Malignant giant cell tumor of the rib with lung metastasis in a man.J Thorac Dis,2014,6(9):1307-1310.
[3]Chan CM,Adler Z,Reith JD,et al.Risk factors for pulmonary metastases from giant cell tumor of bone.J Bone Joint Surg Am,2015,97(5):420-428.
[4]Tandra VS,Kotha KM,Satyanarayana MG,et al.Synchronous multicentric giant cell tumour of distal radius and sacrum with pulmonary metastases.Case Rep Oncol Med,2015,2015:354158.
[5]Wirbel R,Blumler F,Lommel D,et al.Multicentric giant cell tumor of bone:synchronous and metachronous presentation.Case Rep Orthop,2013,2013:756723.
[6]Leichtle CI,Leichtle UG,Gartner V,et al.Multiple skeletal metastases from a giant cell tumour of the distal fibula with fatal outcome.J Bone Joint Surg Br,2006,88(3):396-399.
[7]Hoch B,Inwards C,Sundaram M,et al.Multicentric giant cell tumor of bone.Clinicopathologic analysis of thirty cases.J Bone Joint Surg Am,2006,88(9):1998-2008.
[8]Szendroi M.Giant-cell tumour of bone.J Bone Joint Surg Br,2004,86(1):5-12.
[9]van der Heijden L,van de Sande MA,van der Geest IC,et al.Giant cell tumors of the sacrum--a nationwide study onmidterm results in 26 patients after intralesional excision.Eur Spine J,2014,23(9):1949-1962.
[10]van der Heijden L,Dijkstra PD,van de Sande MA,et al.The clinical approach toward giant cell tumor of bone.Oncologist,2014,19(5):550-561.
[11]Klenke FM,Wenger DE,Inwards CY,et al.Giant cell tumor of bone:risk factors for recurrence.Clin Orthop Relat Res,2011,469(2):591-599.
[12]Campanacci M,Baldini N,Boriani S,et al.Giant-cell tumor of bone.J Bone Joint Surg Am,1987,69(1):106-114.
[13]Cowan RW,Singh G.Giant cell tumor of bone:a basic science perspective.Bone,2013,52(1):238-246.
[14]Skov Dalgaard K,Gammelager H,Svaerke C,et al.Hospital use among patients with lung cancer complicated by bone metastases and skeletal-related events:a population-based cohort study in Denmark.Clin Epidemiol,2015,7:363-368.
[15]Luther N,Bilsky MH,Hartl R.Giant cell tumor of the spine.Neurosurg Clin N Am,2008,19(1):49-55.
[16]Errani C,Ruggieri P,Asenzio MA,et al.Giant cell tumor of the extremity:A review of 349 cases from a single institution.Cancer Treat Rev,2010,36(1):1-7.
[17]Becker WT,Dohle J,Bernd L,et al.Local recurrence of giant cell tumor of bone after intralesional treatment with and without adjuvant therapy.J Bone Joint Surg Am,2008,90(5):1060-1067.
[18]Naam NH,Jones SL,Floyd J,et al.Multicentric giant cell tumor of the fourth and fifth metacarpals with lung metastases.Hand (N Y),2014,9(3):389-392.
[19]Girolami I,Mancini I,Simoni A,et al.Denosumab treated giant cell tumour of bone:a morphological,immunohistochemical and molecular analysis of a series.J Clin Pathol,2015.
[20]Stopeck AT,Fizazi K,Body JJ,et al.Safety of long-term denosumab therapy:results from the open label extension phase of two phase 3 studies in patients with metastatic breast and prostate cancer.Support Care Cancer,2015.
[21]Pietschmann P,Mechtcheriakova D,Meshcheryakova A,et al.Immunology of osteoporosis:a mini-review.Gerontology,2015.
[22]Li J,Sarosi I,Yan XQ,et al.RANK is the intrinsic hematopoietic cell surface receptor that controls osteoclastogenesis and regulation of bone mass and calcium metabolism.Proc Natl Acad Sci USA,2000,97(4):1566-1571.
[23]Bucay N,Sarosi I,Dunstan CR,et al.osteoprotegerin-deficient mice develop early onset osteoporosis and arterial calcification.Genes Dev,1998,12(9):1260-1268.
[24]Dahiya N,Khadka A,Sharma AK,et al.Denosumab:A bone antiresorptive drug.Med J Armed Forces India,2015,71(1):71-75.
[25]Hanley DA,Adachi JD,Bell A,et al.Denosumab:mechanism of action and clinical outcomes.Int J Clin Pract,2012,66(12):1139-1146.
[26]Akiyama T,Dass CR,Shinoda Y,et al.Systemic RANK-Fc protein therapy is efficacious against primary osteosarcoma growth in a murine model via activity against osteoclasts.J Pharm Pharmacol,2010,62(4):470-476.
[27]Neve A,Corrado A,Cantatore FP.Osteoblast physiology in normal and pathological conditions.Cell Tissue Res,2011,343(2):289-302.
[28]Sohn W,Simiens MA,Jaeger K,et al.The pharmacokinetics and pharmacodynamics of denosumab in patients with advanced solid tumours and bone metastases:a systematic review.Br J Clin Pharmacol,2014,78(3):477-487.
[29]Huang L,Xu J,Wood DJ,et al.Gene expression of osteoprotegerin ligand,osteoprotegerin,and receptor activator of NF-kappaB in giant cell tumor of bone:possible involvement in tumor cell-induced osteoclast-like cell formation.Am J Pathol,2000,156(3):761-767.
[30]Vaishya R,Agarwal AK,Vijay V.‘Salvage treatment’ of aggressive giant cell tumor of bones with denosumab.Cureus,2015,7(7):e291.
[31]Thomas D,Henshaw R,Skubitz K,et al.Denosumab in patients with giant-cell tumour of bone:an open-label,phase 2 study.Lancet Oncol,2010,11 (3):275-280.
[32]Rutkowski P,Ferrari S,Grimer RJ,et al.Surgical downstaging in an open-label phase II trial of denosumab in patients with giant cell tumor of bone.Ann Surg Oncol,2015,22(9):2860-2868.
[33]Branstetter DG,Nelson SD,Manivel JC,et al.Denosumab induces tumor reduction and bone formation in patients with giant-cell tumor of bone.Clin Cancer Res,2012,18(16):4415-4424.
[34]Martin-Broto J,Cleeland CS,Glare PA,et al.Effects of denosumab on pain and analgesic use in giant cell tumor of bone:interim results from a phase II study.Acta Oncol,2014,53(9):1173-1179.
[35]Strobl S,Korkmaz B,Devyatko Y,et al.Adjuvant bisphosphonates and breast cancer survival.Annu Rev Med,2015.
[36]Alford SH,Rattan R,Buekers TE,et al.Protective effect of bisphosphonates on endometrial cancer incidence in data from the Prostate,Lung,Colorectal and Ovarian (PLCO) cancer screening trial.Cancer,2015,121(3):441-447.
[37]Tse LF,Wong KC,Kumta SM,et al.Bisphosphonates reduce local recurrence in extremity giant cell tumor of bone:a casecontrol study.Bone,2008,42(1):68-73.
[38]Lau CP,Huang L,Wong KC,et al.Comparison of the antitumor effects of denosumab and zoledronic acid on the neoplastic stromal cells of giant cell tumor of bone.Connect Tissue Res,2013,54(6):439-449.
[39]Peddi P,Lopez-Olivo MA,Pratt GF,et al.Denosumab in patients with cancer and skeletal metastases:a systematic review and meta-analysis.Cancer Treat Rev,2013,39(1):97-104.
[40]Fizazi K,Carducci M,Smith M,et al.Denosumab versus zoledronic acid for treatment of bone metastases in men withcastration-resistant prostate cancer:a randomised,double-blind study.Lancet,2011,377(9768):813-822.
[41]Stopeck AT,Lipton A,Body JJ,et al.Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer:a randomized,doubleblind study.J Clin Oncol,2010,28(35):5132-5139.
[42]Kaban LB,Troulis MJ,Ebb D,et al.Antiangiogenic therapy with interferon alpha for giant cell lesions of the jaws.J Oral Maxillofac Surg,2002,60(10):1103-1111.
[43]Karras NA,Polgreen LE,Ogilvie C,et al.Denosumab treatment of metastatic giant-cell tumor of bone in a 10-yearold girl.J Clin Oncol,2013,31(12):e200-202.
[44]McClung MR,Lewiecki EM,Geller ML,et al.Effect of denosumab on bone mineral density and biochemical markers of bone turnover:8-year results of a phase 2 clinical trial.Osteoporosis International,2012,24(1):227-235.
[45]Lipton A,Siena S,Rader M,et al.Comparison of denosumab versus zoledronic acid (Za) for treatment of bone metastases in advanced cancer patients:an integrated analysis of 3 pivotal trials.Ann Oncol,2010,21:380-380.
[46]Adler RA,Gill RS.Clinical utility of denosumab for treatment of bone loss in men and women.Clin Interv Aging,2011,6:119-124.
[47]Kurata T,Nakagawa K.Efficacy and safety of denosumab for the treatment of bone metastases in patients with advanced cancer.Jpn J Clin Oncol,2012,42(8):663-669.
[48]Lewin J,Thomas D.Denosumab:a new treatment option for giant cell tumor of bone.Drugs Today (Barc),2013,49(11):693-700.
[49]Enqellau J,Chawla S,Grimer R,et al.Denosumab treatment for giant cell tumor of bone (GCTB) in adolescent patients:interim results from a phase II study.Eur J Cancer,2011,47:15-16.
[50]Lippuner K.The future of osteoporosis treatment-a research update.Swiss Medical Weekly,2012,142:w13624.
[51]Silva-Fernández L,Rosario MP,Martinez-Lopez JA,et al.Denosumab for the treatment of osteoporosis:a systematic literature review.Reumatol Clin,2013,9(1):42-52.
(本文编辑:王萌)
【Abstract】Giant cell tumor (GCT) of the bone is currently defined as a local-aggressive tumor in clinical practice,which has been confirmed that its biological behavior is a borderline or hard to distinguish.Patients with GCT are of osteolytic lesions mediated by the receptor activator of nuclear factor κB ligand (RANKL) expressed by giant cells.RANKL helps in the formation and functioning of osteoclasts.Surgery remains the primary choice of the treatment.However,no definite effective treatment options are widely accepted for postoperative recurrence reduction,multi-centric refractory tumor as well as other unresectable tumors.Non-surgical therapy is of greater significance.Denosumab,as a fully humanised monoclonal antibody directly inhabiting RANKL,can inhibit osteoclast-mediated osteolysis directly to prevent the occurrence of skeletal related events (SREs),including pathologic fractures,spinal cord compressing and osteoporosis,etc.Relevant studies also demonstrate denosumab has more favorable effects than bisphosphonates.More remarkable are the effects on uncertain tumor-free surgical margin or paliative resectional GCT.
【Key words】Giant cell tumor of bone; Receptor activator of nuclear factor-kappa B; Pharmacologic actions; Denosumab
(收稿日期:2015-11-09)
Corresponding author:XIAO Jian-ru,Email:jianruxiao83@163.com
DOI:10.3969/j.issn.2095-252X.2016.01.008
中图分类号:R738.1

