固载化羟肟酸过渡金属配合物催化氧化乙苯的性能*
王蕊欣,雷彩萍,史小慧,王洪静
(中北大学 化工与环境学院, 太原 030051)
固载化羟肟酸过渡金属配合物催化氧化乙苯的性能*
王蕊欣,雷彩萍,史小慧,王洪静
(中北大学 化工与环境学院, 太原 030051)
摘要:采用付-克烷基化反应,使水杨羟肟酸(SHA)键合到氯甲基化聚苯乙烯微球(CMCPS)表面,制得SHA功能化聚苯乙烯微球(SHA/CPS);再以SHA/CPS为配体,与过渡金属离子M(Co(Ⅱ)、Cu(Ⅱ)、Fe(Ⅲ)、Mn(Ⅱ))配位,制备了M-SHA/CPS配合物固体催化剂。研究了M-SHA/CPS在氧气非均相氧化乙苯中的催化行为。结果表明,M-SHA/CPS可有效地催化分子氧氧化乙苯。中心金属离子的电子结构对配合物催化性能有较大影响,其中Fe-SHA/CPS对乙苯氧化为EBHP的催化活性和选择性最高,在100 ℃下EBHP的含量高达14%。催化剂浓度、助剂四甘醇浓度和温度对Fe-SHA/CPS催化剂的活性和选择性有较大影响。此外,Fe-SHA/CPS具有较好的重复使用性。
关键词:水杨羟肟酸过渡金属配合物;交联聚苯乙烯微球;固载;催化氧化;乙苯
0引言
羟肟酸也称异羟肟酸,是一类重要的金属络合剂,可与金属离子络合形成稳定的五元环配合物[1]。近年来,异羟肟酸过渡金属配合物作为抗癌剂[2]、仿单加氧酶催化剂[3]、模拟铁载体蛋白[4]等的应用已得到了广泛的关注。在仿单加氧酶研究中,金属卟啉、金属酞菁和Schiff 碱过渡金属配合物是研究最为广泛的人工模型化合物。这些模型化合物能够克服传统强氧化剂条件苛刻、选择性差、环境污染等问题,具有高效、高选择性、环境友好的特点。然而金属卟啉、金属酞箐存在合成困难、产率低、自身易氧解失活的缺点[5],而Schiff 碱配合物的催化活性又较差[6],限制了它们的应用。异羟肟酸过渡金属配合物作为一类新型的仿单加氧酶模型[7-9],具有合成简便、结构可调性大、价格便宜、抗氧化能力强等特点,能够在较温和的条件下,催化烃类化合物转化为高附加值的含氧化合物。
然而,目前这类异羟肟酸过渡金属配合物都是作为均相催化剂使用。实现均相催化剂的固载化,即变均相催化剂为非均相催化剂,是克服均相催化剂难分离、不能够重复使用、热稳定性差等缺点,实现催化过程的环境友好、提高催化过程效率的重要途径[10],已成为催化剂科学的重要发展趋势。本文以聚苯乙烯微球为基质,制备了固载化水杨羟肟酸过渡金属配合物,并以其为非均相催化剂,氧气为氧源,研究其在乙苯氧化中的催化活性。研究结果在促进烃类化合物绿色、高效的转变为高附加值的含氧化合物方面,在促进非均相仿生催化剂发展方面,提供了有价值的参考。
1实验
1.1药品与仪器
乙苯(EB,天津市光复精细化工研究所),分析纯;冰乙酸(天津市天力化学试剂有限公司),分析纯;交联聚苯乙烯微球(即白球),(CPS,医药级,日本三菱公司):交联度4%, 粒径0. 315~0. 450 mm;氯甲基化聚苯乙烯微球(CMCPS,氯含量15%)按文献[11]方法自制;水杨羟肟酸(SHA,上海伊卡生物技术有限公司),分析纯;四甘醇(国药集团化学试剂有限公司),分析纯;其它物质均为市售分析纯试剂。
美国Perk in-Elmer 公司的1700 型傅里叶红外光谱仪;美国Thermo SoLAAR-AA原子吸收光谱仪;美国TJA公司的Atomscan 16型电感耦合等离子体质谱仪(ICP-MS);美国Perkin-Elmer 2400CHN 型元素分析仪;上海HP 6890型气相色谱仪(GC)。
1.2SHA在CPS微球上的固载化
将0.5 g CMCPS置于40 mL DMF浸泡12 h使之充分溶胀后,再加入0.32 g SHA和0.06 mL SnCl4,60 ℃恒温反应13 h后,抽滤分离出产物,先用稀盐酸洗涤,再用乙醇和蒸馏水交替洗涤,真空干燥至恒重,即得水杨羟肟酸功能化聚苯乙烯微球SHA/CPS。通过元素分析法测定SHA/CPS上的N含量,从而确定SHA的键合量为2.8 mmol/g。采用KBr压片法,测定SHA-CPS微球的红外光谱,对其结构进行表征。
1.3CPS固载化水杨羟肟酸过渡金属配合物的制备
将0.5 g SHA/CPS加入到25 mL DMF中浸泡12 h后,向体系中加入0.5 g 金属盐(CoCl2·6H2O、CuCl2·4H2O、MnCl2·4H2O或FeCl3·6H2O),100 ℃恒温反应2 h后,过滤分离出产物,用蒸馏水反复洗涤,真空干燥至恒重,即得固载化的水杨羟肟酸过渡金属配合物催化剂M-SHA/CPS(M=Co、Cu、Mn或Fe)。原子吸收分光光度法测得M-SHA/CPS中金属离子的含量分别为Co=6.44×10-5mol/g(0.38%),Cu=6.56×10-5mol/g (0.42%),Mn=6.73×10-5mol/g(0.37%),Fe=7.14×10-5mol/g (0.4%)。
1.4M-SHA/CPS催化分子氧氧化乙苯的实验
在反应瓶中加入EB、M-SHA/CPS(M=Co、Cu、Mn或Fe)及四甘醇,常压下以固定的流速将氧气鼓泡通入反应体系中,恒温搅拌反应,间隔一定时间取样,用碘量法测定反应混合物中乙苯氢过氧化物(EBHP)的含量[12],GC测定反应中副产物的含量[13]。过滤分离出M-SHA/CPS,用乙醇反复洗涤,真空干燥至恒重,回收催化剂。GC的分析条件为: HP-PLOTQ 毛细管柱,柱温200 ℃,以高纯氮气为载气,分离的产物由氢火焰离子化检测器检测,以1,4-二氯苯作为内标。
碘量法测定EBHP的含量: 取 0.5~1.0 mL反应混合物,准确称重后溶于25 mL冰醋酸中,加入1 mL饱和KI溶液,用氮气吹扫后,密闭置于暗处10 min。取出后用 0.05 mol/L 的Na2S2O3溶液滴定至棕红色接近消失时,加25 mL水和1 mL淀粉指示剂,继续滴定至终点,记下所用Na2S2O3溶液的体积,按下式计算EBHP的含量

(1)
式中,M为EBHP 的分子量,取138 g/mol;V为滴定消耗Na2S2O3溶液的体积, mL;c为Na2S2O3溶液的浓度,mol/ L;W为试样的质量,g 。
GC测定反应中副产物(苯乙酮、α-甲基苄醇)的含量。依据文献[13],测定α-甲基苄醇时,先将产物中的EBHP在三苯基膦作用下全部转化为α-甲基苄醇,然后通过GC法测定全部的α-甲基苄醇的含量,此含量与EBHP转化的α-甲基苄醇含量的差值即为氧化反应产物中α-甲基苄醇的含量。依据下式分别计算EB的转化率和EBHP的选择性。
EB的转化率/%=
(2)
EB的选择性/%=
(3)
上述两式中,C(EBHP)、C(苯乙酮)、C(α-甲基苄醇)分别为EBHP、苯乙酮和α-甲基苄醇的摩尔浓度, mol/L;C(0EB) 为乙苯的起始摩尔量,mol/L。
2结果与讨论
2.1M-SHA/CPS的制备过程
首先通过CMCPS表面的氯甲基与SHA上的苯环发生亲核取代反应,使SHA键合在CPS上,制得了微球SHA/CPS;然后通过SHA上的羟肟酸基团与过渡金属离子之间的配位反应,形成了固载有水杨羟肟酸过渡金属配合物的微球M-SHA/CPS(M=Co、Cu、Mn或Fe)。制备过程如图式1所示。
(1) Bonding SHA on CPS microspheres
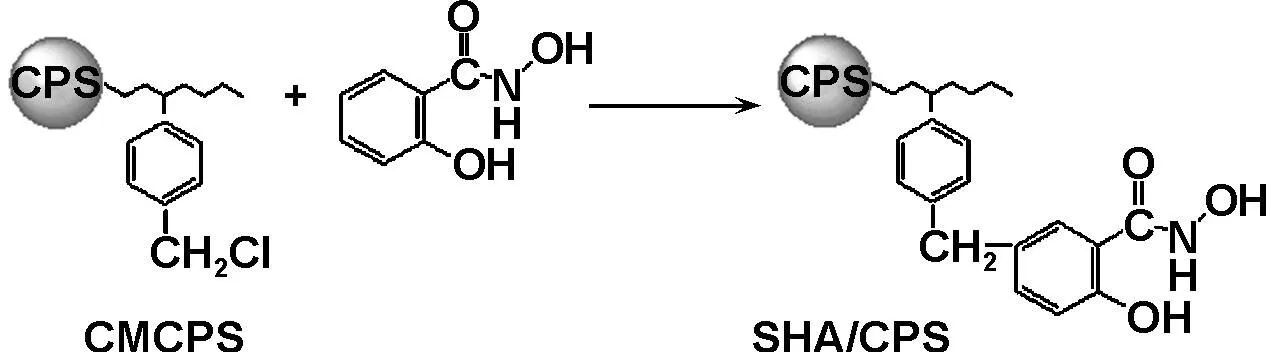
(2) Coordination reaction between SHA/CPS microspheres and metal ions
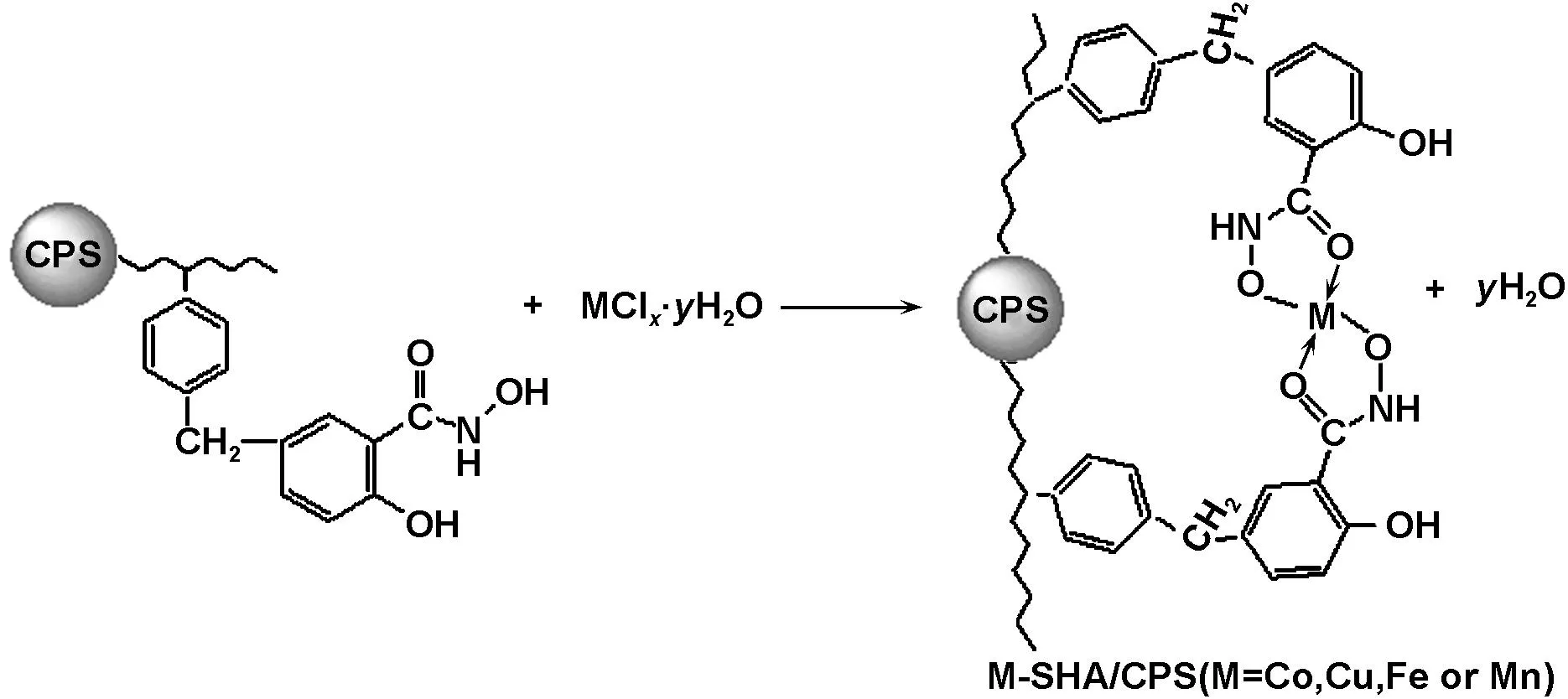
图式1 固体催化剂M-SHA/CPS的制备过程
2.2M-SHA/CPS的红外光谱
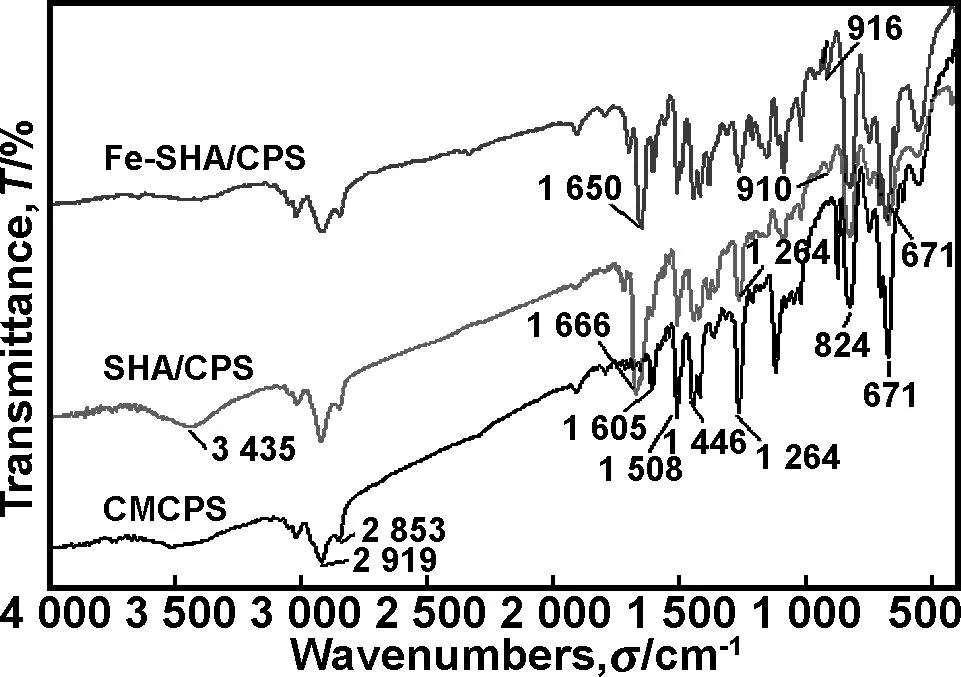
图1CMCPS、SHA/CPS和Fe-SHA/CPS 3种微球的红外光谱图
Fig 1 Infrared spectra of CMCPS, SHA/CPS and Fe-SHA/CPS microspheres
2.3M-SHA/CPS催化分子氧氧化乙苯的活性
图2(a)给出了不同金属中心的催化剂下EB转化率随反应时间的变化曲线,图2(b)和(c)分别为EBHP的含量及其选择性随反应时间的变化曲线。由图2(a)可知,加有少量M-SHA/CPS的体系,尤其是加有Fe-SHA/CPS的体系,EB的转化率随反应时间的延长不断增大,同时生成的EBHP的质量百分含量也不断增大(如图2 (b)),其最高含量达14%,与文献[12]相当;反应的转化数高达1178。这说明羟肟酸过渡金属配合物固载化形成非均相催化剂后,仍能够有效活化分子氧,在分子氧氧化乙苯的过程中表现出明显的催化活性,使得乙苯在常压100 ℃下即可较高效地转变为EBHP。依据文献[14-15],羟肟酸过渡金属配合物首先与双氧配位,生成的异羟肟酸过渡金属二氧加合物从底物摘取氢而引发自由基,进而生成主产物氢过氧化物, 故推测羟肟酸过渡金属配合物催化氧化乙苯的机理如图式2所示。本研究所使用的SHA其羰基与苯环相连,且其邻位的羟基供电子性,使得产生的p-π效应增大了羟肟酸配体的π-授予性,从而使中心金属离子的电子云密度增大,有利于活性中间体—异羟肟酸过渡金属二氧加合物[16]的形成与稳定,能够有效催化氧气氧化乙苯。而图2 (c)则显示EBHP的选择性在反应8 h后开始下降,这是因为在此催化氧化反应过程中伴随着氢过氧化物的分解(如图式2),生成苯乙酮等其它副产物。
(1) 自由基的产生

(2) 氢过氧化物的形成

(3) 氢过氧化物的分解

图式2羟肟酸过渡金属配合物催化氧化乙苯的机理
Scheme 2 Mechanism of oxidation of phenylethane catalyzed by hydroxamic acid-transitionmetal complex
此外,由图2(b)和(c)可知,EB的转化率和EBHP的生成量随M-SHA/CPS中心金属离子不同而变化,即表现出不同的催化活性,其催化活性顺序为Fe ≫ Mn>Co>Cu,铁配合物的催化活性最高。这可能是因为反应过程中金属离子的价态变化及电子(特别是3d 电子) 结构等因素导致含不同中心金属离子的M-SHA/CPS空间构型及大小不同,从而使其与O2结合形成的活性中间体——异羟肟酸过渡金属二氧加合物的难易程度不同,因此催化剂活化分子氧的能力不同,导致最终催化剂的催化活性不同。
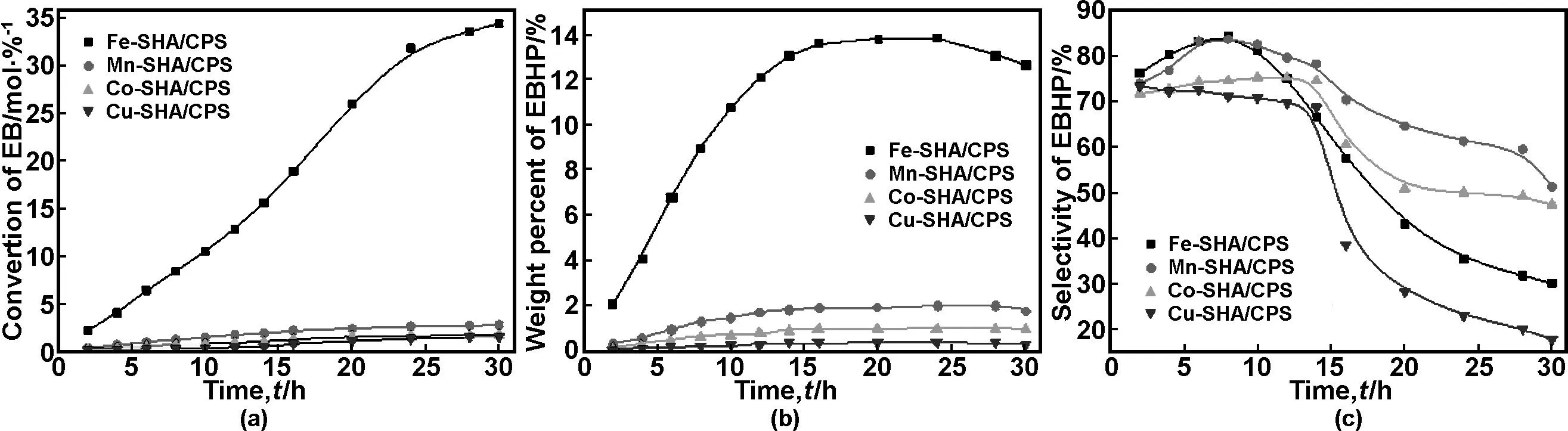
图2中心金属离子对催化活性的影响
Fig 2 Effect of central metal cation on catalytic properties, reaction temperature: 100 ℃, catalyst concentration: 0.55 mmol/L, tetraglycol concentration: 0.0463 mol/L
2.4各种因素对Fe-SHA/CPS催化乙苯氧化反应的影响
2.4.1催化剂浓度的影响
图3为不同催化剂浓度下EBHP积累浓度随时间的变化。由图可知,随着催化剂浓度增加,相同反应时间内EBHP的含量提高,这是因为催化剂浓度增大,导致其与氧分子配位产生异羟肟酸二氧加合物活性中间体的机会增加,与底物的碰撞几率也相应增大,从而加快了反应速度,使EBHP的含量提高。当催化剂浓度为0.55 mmol/ L时,产物体系中EBHP的含量高达14%,继续增大催化剂的浓度,EBHP的含量几乎不再变化,因此,确定催化剂的适宜浓度为0.55 mmol/L。
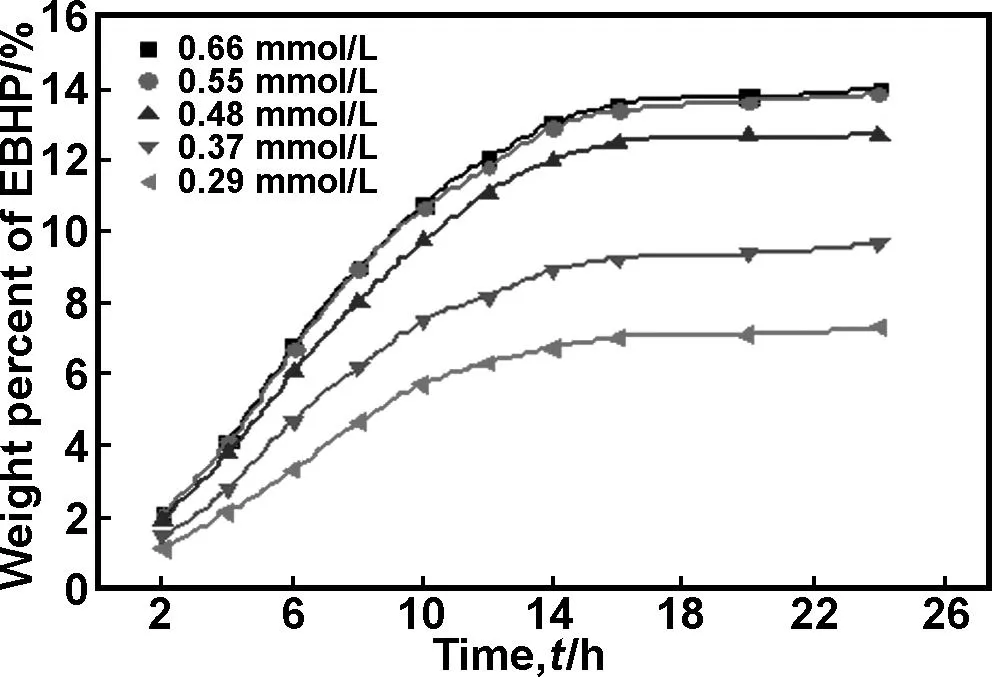
图3 催化剂浓度对Fe-SHA/CPS催化活性的影响
Fig 3 Effect of catalyst concentration on catalytic properties of Fe-SHA/CPS, reaction temperature: 100 ℃, tetraglycol concentration: 0.0463 mol/L
2.4.2助剂浓度的影响
图4显示了助剂四甘醇的浓度对Fe-SHA/CPS催化活性的影响。由图4可知,当体系中无助催化剂时,EBHP的含量较小;随着四甘醇加入量的增加,EBHP的含量不断增大,当四甘醇用量为0.0463 mol/L时,EBHP的含量可高达14%;继续增加四甘醇的用量,EBHP的含量反而减小。添加具有电子给予能力的助剂(D)对中心金属离子(M)的配位环境(通过电子效应和空间效应) 有较大影响,通过形成ML2·D (L为配体)物种,从而改善催化剂的活性及选择性。依据以分子氧为氧源的异羟肟酸过渡金属配合物催化氧化烃类化合物的原理,催化氧化过程中,既要保证活性物种异羟肟酸过渡金属二氧加合物容易形成,同时也要使该活性物种结合的氧能够释放出来,从而转移给底物使底物氧化,即要控制使该活性物种的稳定性适中。助剂浓度过低时,形成稳定的活性物种异羟肟酸过渡金属二氧加合物,不利于活性物种中氧到底物的转移;而助剂浓度过高时,助剂与金属离子的结合能力过强,不利于活性物种异羟肟酸过渡金属二氧加合物的形成;因此只有当助剂浓度适中时,催化剂的活性才最好,这与图4显示的实验结果一致。
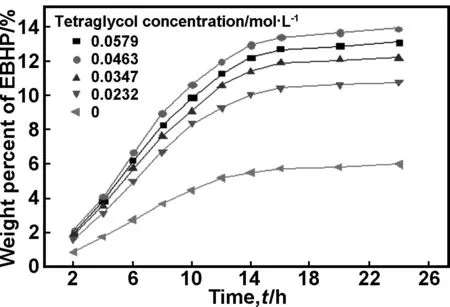
图4四甘醇的浓度对Fe-SHA/CPS催化性能的影响
Fig 4 Effect of tetraglycol concentration on catalytic properties of Fe-SHA/CPS,reaction temperature: 100 ℃, catalyst concentration: 0.55 mmol/L
2.4.3温度的影响
以Fe-SHA/CPS为催化剂,考查不同温度下EBHP积累浓度的变化,如图5所示。由图可知,随着温度的提高,EBHP的含量增大;超过100 ℃后,EBHP的含量反而减小。由实验现象可知,当温度超过100 ℃后,产物中有少量苯乙酮生成,即催化剂对EBHP的选择性降低。这是因为过高的温度会引起催化剂对EBHP的过早分解,从而降低对EBHP的选择性;且温度过高不利于氧在反应体系中的溶解,降低活性中间体异羟肟酸过渡金属二氧加合物的生成速率,从而使EBHP的生成量减少。

图5 温度对Fe-SHA/CPS催化性能的影响
Fig 5 Effect of temperature on catalytic properties of Fe-SHA/CPS catalyst concentration: 0.55 mmol/L, tetraglycol concentration: 0.0463 mol/L
2.5Fe-SHA/CPS的循环使用次数与催化活性
固体催化剂Fe-SHA/CPS通过回收并经简单处理后,重复用于催化氧气氧化乙苯的反应,通过体系中生成EBHP的含量考察Fe-SHA/CPS的重复使用性,结果如图6所示。对Fe-SHA/CPS在第一次使用前后用ICP-MS检测其金属含量,测得催化剂第一次使用前铁离子的含量为0.32%,而在第一次使用后铁离子的含量为0.29%,第二次使用后铁离子的含量为0.28%。由图6可知,Fe-SHA/CPS在前2次使用后EBHP的含量略有下降,结合ICP-MS检测的铁离子含量的变化,表明Fe-SHA/CPS在此催化氧化过程中受到了一定程度的破坏,但之后的每次催化反应,铁离子的含量几乎不变,生成的EBHP的含量也基本不变,表明固载化的水杨羟肟酸过渡金属催化剂Fe-SHA/CPS具有较好的稳定性,能够重复使用。
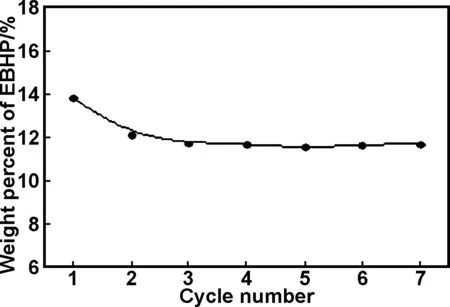
图6循环使用次数对Fe-SHA/CPS催化性能的影响
Fig 6 Effect of cycle number on catalytic properties of Fe-SHA/CPS reaction temperature: 100 ℃, catalyst concentration: 0.55 mmol/L, tetraglycol concentration: 0.0463 mol/L
3结论
将SHA键合到CPS微球表面,成功制得功能化微球SHA/CPS;并将其与过渡金属离子M(Co(Ⅱ)、Cu(Ⅱ)、Fe(Ⅲ)、Mn(Ⅱ))配位,制备了M-SHA/CPS固体催化剂。所得M-SHA/CPS可有效地催化分子氧氧化EB生成EBHP。不同中心金属离子的配合物,其催化性能不同,活性顺序为: Fe-SHA/CPS≫Mn-SHA/CPS>Co-SHA/CPS>Cu-SHA/CPS,在一定范围内,催化剂浓度和四甘醇浓度越大、温度越高,Fe-SHA/CPS的催化活性越高。此外,Fe-SHA/CPS具有较好的可重复使用性。
致谢:感谢山西省留学回国人员科技活动择优资助项目,山西省高等学校优秀青年学术带头人资助项目!
参考文献:
[1]Qiu X Y, Gao Y D. Investigation of action mechanism between benzylhydroximic acid and columbite-tantalite [J]. Nonferrous Metals, 2005, (6):37- 40.
[2]Helmick J S, Martin K A, Heinrich J L. Mechanism of the reaction of carbon and nitrogen nucleophiles with the model carcinogens O-pivaloyl-N-arylhydroxylamines: competing SN2 substitution and SN1 solvolysis [J]. Journal of the American Chemical Society, 1991, 113:3459-3466.
[3]Li H B, Qin C, Liang W, et al. Studies on the catalytic oxidation in xylene by cobalt (Ⅱ) halogen-substituted hydroxamates [J]. Journal of Molecular Catalysis, 2009, 23(1): 62-66.
[4]Raymond K N. Biomimetic metal encapsulation [J]. Coordination Chemistry Reviews, 1990, 105, 135-153.
[5]Mukherjee M, Ray A R. Biomimetic oxidation of L-arginine with hydrogen peroxide catalyzed by the resin-supported iron (Ⅲ) porphyrin [J]. Journal of Molecular Catalysis A: Chemical, 2007, 266(1-2):207-214.
[6]Han Z J, Zhou H, Chen H W, et al. Studies of synthesis and oxygenation mechanism of cobalt schiff base complexes [J]. Journal of Inorganic Chemistry, 1992, 8(4):421-426.
[7]Barlan A U, Zhang W, Yamamoto H. Development and application of versatile bis-hydroxamic acids for catalytic asymmetric oxidation [J]. Tetrahedron, 2007, 63(27):6075-6087.
[8]Gharah N, Chattopadhyay B, Maiti S K, et al. Synthesis and catalytic epoxidation potential of oxodiperoxo molybdenum (Ⅵ) complexes with 2-hydroxybenzohydroxamate and 2-hydroxybenzoate: the crystal structure of PPh4[MoO(O2)2(HBA)][J]. Transition Metal Chemistry, 2010, 35(5):531-539.
[9]Sun B, Qin S Y. Catalytic performance of transition metal complexes with hydroxamate in 4-chloro-toluene oxidation [J]. Chemical Research and Application, 2011, 23(1):92-95.
[10]Yao Y Y, Sheng F X, Wu X P, et al. Catalytic oxidation of 2-mercaptoethanol by activated carbon fibers supported cobalt phthalocyanine [J]. Journal of Functional Materials, 2011, 42(12): 2171-2175.
[11]Lv C L, Gao B J, Liu Q, et al. Preparation of two kinds of chloromethylated polystyrene particle using 1,4-bis (chloromethoxy) butane as chloromethylation reagent [J]. Colloid Polymer Science, 2008, 286(5):553-561.
[12]Lv Z F, Zhan F T, Qin S Y. Study on catalytic properties of hydroxamic acid transition metal complexes in phenylethane oxidation [J]. Modern Chemical Indust ry, 2000, 20(5):32-36.
[13]Ramón Alcántara, Laureano Canoira, Pedro Guilherme Joao, et al. Ethylbenzene oxidation with air catalysed by bis(acetylacetonate)nickel(Ⅱ) and tetra-n-butylammonium tetrafluoroborate [J]. Applied Catalysis A: General, 2000, 203: 259-268.
[14]Toribio P P, Campos-Martin J M, Fierro J L G. Liquid-phase ethylbenzene oxidation to hydroperoxide with barium catalysts[J]. Journal of Molecular Catalysis A: Chemical, 2005, 227:101-105.
[15]Li H B, Hao M A, Qin C, et al. An efficient aerobic oxidation for p-xylene to p-toluic acid catalyzed by cobalt (Ⅱ) hydroxamates with benzo-15-crown-5[J]. Reaction Kinetics and Catalysis Letters, 2007, 91:299-306.
[16]Huang S T, Li J Z, Feng F M, et al. Synthesis and catalytic oxidation performance of cobalt(Ⅱ) hydroxamate and thire dioxygen addcuts [J]. Journal of Southwest University for Nationalities, 2004, 30(2):148-151.
Catalytic property of immobilizedsalicyl hydroxamic acid-transition metal complex in oxidation of ethylbenzene by molecular oxygen
WANG Ruixin, LEI Caiping, SHI Xiaohui, WANG Hongjing
(School of Chemical and Environmental Engineering, North University of China, Taiyuan 030051, China)
Abstract:Salicylhydroxamic acid (SHA) was covalently bounded onto the chloromethylated cross-linked polystyrene microspheres (CMCPS) through the Friedel-Crafts alkylation reaction, obtained SHA-functionalized CPS (SHA/CPS). Then the supported catalyst M-SHA/CPS was prepared by the coordination between SHA/CPS ligand and metal ions (Co(Ⅱ), Cu(Ⅱ), Fe(Ⅱ), or Mn(Ⅱ)). Catalytic performances of M-SHA/CPS for the heterogenous oxygen oxidation of ethylbenzene in the absence of solvent were investigated and compared in detail. The results showed that M-SHA/CPS could effectively activate dioxygen and obviously catalyze the oxidation of ethylbenzene. The electronic structure of central metal ion had a strong effect on the catalytic properties of M-SHA/CPS,and the yield of EBHP obtained using Fe-SHA/CPS as catalyst was up to 14% at 100 ℃. The catalytic activity was affected by the Fe-SHA/CPS concentration, additive concentration, and temperature. In addition, Fe-SHA/CPS had a good reusability.
Key words:salicylhydroxamic acid - transition metal complex; crosslinked polystyrene microspheres; supporting; catalytic oxidation; ethylbenzene
DOI:10.3969/j.issn.1001-9731.2016.02.049
文献标识码:A
中图分类号:O643. 3
作者简介:王蕊欣(1981-),女,山西万荣人,副教授,硕导,主要从事功能高分子材料的改性研究。
基金项目:国家青年科学基金资助项目(21307116);山西省自然科学基金资助项目(2014011017-5)
文章编号:1001-9731(2016)02-02253-05
收到初稿日期:2015-01-20 收到修改稿日期:2015-08-23 通讯作者:王蕊欣,E-mail: wrx0212@126.com

