一次离心运动对大鼠骨骼肌线粒体移动相关蛋白表达的影响
于 滢,于 亮,李云广,李俊平,周 越,王宏坤,武俸羽,王瑞元
◀运动人体科学
一次离心运动对大鼠骨骼肌线粒体移动相关蛋白表达的影响
于 滢1,于 亮2,李云广3,李俊平2,周 越2,王宏坤1,武俸羽1,王瑞元2
(1.哈尔滨体育学院运动科学与健康系,黑龙江哈尔滨150008;2.北京体育大学运动人体科学学院,北京100084;3.黑龙江科技大学体育部,黑龙江哈尔滨150022)
目的:观察一次离心运动后线粒体移动相关蛋白的表达变化。方法:42只SD大鼠经适应后随机分为安静组(6只)和离心运动组(36只)。离心运动组在跑台上进行90min速度为16m/min的离心运动,坡度-16°。运动后分别在即刻、6 h、12 h、24 h、48 h和72 h取材。Western blotting测定骨骼肌Miro1、Miro2、KIF5B、VDAC1、Dynlt1蛋白的表达。结果:一次离心运动后,与安静组相比,离心运动后各时间点Miro1、Miro2蛋白表达显著升高;KIF5B变化不显著;VDAC1在6 h、12 h、24 h和72 h显著升高;Dynlt1蛋白表达在运动后6 h和48 h显著升高。结论:一次离心运动后骨骼肌中Miro、VDAC1和Dynlt1蛋白表达上调,表明离心运动损伤后骨骼肌线粒体移动活跃,有利于离心运动导致的骨骼肌损伤修复。
离心运动;大鼠;骨骼肌;线粒体移动
线粒体是重要的细胞器,也是动态的细胞器[1]。其在细胞内也要进行运动,且需要相关的分子马达为动力才得以运动[2],驱动其在细胞内进行移动,进而到达其需要的位置,形成一定的分布形式,应对能量需求改变。对线粒体运动的研究很多集中在生殖细胞和神经组织,例如线粒体在生殖细胞尤其是卵细胞中的分布特点可以反映其成熟度。线粒体移动的机制研究刚刚起步,对于线粒体移动相关蛋白的影响研究尚属少见,对细胞中线粒体移动的变化及调控的分子机制认识尚不明确。本研究团队前期研究发现一次离心运动诱导骨骼肌损伤,同时观察到线粒体分布出现肌膜下聚集现象,提示线粒体发生了移动,且移动方向有向肌细胞膜方向移动的趋势,进而表现为肌膜下聚集。线粒体重新分布的直接动力自于分子马达蛋白及其相关的受体蛋白,因此有必要对线粒体移动相关马达蛋白及其受体蛋白在运动后不同时程的变化进行研究。
1 线粒体移动相关马达分子研究现状
机体的一切生命活动,如果追踪到分子水平,可以认为都是来源于具有马达功能的蛋白质大分子做功推动的结果,如细胞内部的运输、细胞分裂及肌肉的收缩等。这些功能蛋白质大分子是可以将化学能转变为机械能的,或者将机械能转变为化学能,因此被称为分子马达(molecular motor)或蛋白质马达(protein motor)等[3]。极性细胞类型中,线粒体移动是维持细胞健康的基础,且主要通过motor蛋白及adapter蛋白的配合来完成[4]。线粒体的运动需要动力源,为线粒体运动提供动力源的马达分子包括驱动蛋白(kinesin)、动力蛋白(dynein)和肌球蛋白(myosin)。在哺乳类动物细胞内的线粒体移动是由前两者参与进行的[5]。
1.1 驱动蛋白
驱动蛋白(KIF)家族通过系谱分析包括15个蛋白,从Kinesin1到Kinesin 14B。所有驱动蛋白头部结构域都含有相似的氨基酸序列[6]。传统的驱动蛋白,如驱动蛋白-1,是由两条重链(KHCs;120 KDa),以及两条轻链(KLCs;64 KDa)和螺旋缠绕(coiled-coil)的尾部组成的。Kinesin1是第一个被鉴定出来的驱动蛋白马达,其重链被称作KIF5[7]。KIF5有三个亚型,分别是KIF5 A、KIF5B、KIF5C。KIF5 A、KIF5C是神经特异性的亚型,而KIF5B几乎在大部分组织都存在[8]。一项阿尔海默茨病神经病理研究线粒体运动指出Kinesin1中KHC与线粒体结合协助线粒体移动[9]。也有研究报道神经组织中KIF1Bα和KIF5是转运线粒体的主要驱动蛋白[10-11]。研究认为细胞中不同马达蛋白亚型运送不同货物,以此保证生命机体内部的复杂细胞器定位[12]。
线粒体与kinesin相联需要adaptor蛋白参与。哺乳动物中kinesin潜在adaptor为milton,其受体蛋白是Miro。从酵母到人类,Miro是一种保守的线粒体Rho GTPase,Miro属于小GTPase家族。Miro在人类中有两种同源物:hMiro1和hMiro2。它们的结构中都含有两个不同的GTP酶结构域、两个EF手形(EF-hand)钙联区域和一段跨膜的C端尾巴。神经元线粒体运动调节蛋白Miro1,Miro2和Milton主要功能是调节神经元中线粒体的移动,保证线粒体的正确分布,并能够应对病理损伤[13]。KHC/milton/Miro形成的复合体是当前关于线粒体运动研究的最好模型。KHC与milton、Miro形成复合体时,KLC是独立的;果蝇敲除KLC基因后,不影响线粒体转运,这表明KIF5B的招募和线粒体运输是独立于KLC的,其是可有可无的自己的运动[14],可能承载转运其他货物的使命。研究发现KIF5B定位主要在骨骼肌Z-disks和M线周围,显示它的作用可能与肌原纤维组装或是与肌原纤维的定位有关,且KIF5B在肌肉发育过程中发挥了重要作用[15]。另一项研究发现,驱动蛋白kinesin-1(KIF5B)缺乏会导致线粒体的核周聚集,线粒体分布出现异常[16]。有报道Miro-1突变会抑制线粒体的运输,进而导致线粒体聚集成簇,并会形成丝状线粒体[17]。Miro有可能感知细胞的变化,从而影响线粒体的运动[18]。Miro1可直接与马达蛋白KIF5结合[19]。对线粒体移动的分子调控机制,可能是通过改变马达蛋白的募集、活性变化或锚定来进行的。
1.2 动力蛋白
胞质动力蛋白(Dynein)是真核细胞内沿微管进行负向运动的主要马达蛋白。其行使功能时,总是与dynactin(动力激活蛋白)相结合。胞质动力蛋白复合体的核心是两条重链多肽以及相关的中间体,轻中间体和轻链多肽构成的同型二聚体。其功能之一就是参与到各种膜细胞器的运输。dynein的马达结构域是由六个AAA(ATPase associated with various cellular activities)结构域形成的六聚体排列环[20]。一项关于大鼠肺组织的研究表明,dynein敲除会使线粒体在核周聚集[21]。
Dynlt1也称TCTEX1,是动力蛋白轻链的一种[22]。对心肌中动力蛋白轻链Dynlt1的研究发现其与线粒体相关联,具有减轻缺氧早期心肌线粒体通透性转换的作用[23]。以FITC(绿)标记抗体显示胞浆中的Dynlt分布,以Rhodamine(红)标记抗体显示胞浆中线粒体线粒体的电压依赖性阴离子通道1(VDAC1)的分布,结果发现Dynlt1与VDAC1有着紧密的共区域分布特征。Dynlt1作为动力蛋白Dynein的组成分子之一,与线粒体外膜蛋白VDAC1间的共同定位关系提示在线粒体功能和线粒体胞内运输等方面,Dynlt1对其可能有重要影响[24]。
以上研究认为KHC和Miro形成的复合体,以及Dynlt1与线粒体的VDAC1相互作用,可以共同调控线粒体的移动,并且Dynlt1上调可以对线粒体的功能具有一定的保护作用。对于骨骼肌中线粒体移动的相关研究较少,而对骨骼肌细胞中线粒体移动和分布调控分子机制的研究更少。
2 材料与方法
2.1 实验动物的分组与损伤模型建立
实验动物为SPF级雄性8周龄SD大鼠,体重为(213.57±10.12)g,购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2012-0001。大鼠饲养和训练均在北京体育大学科学研究中心的动物房内进行。大鼠适应环境3 d后进行后续实验。大鼠按体重随机分为2大组:对照组(C组,n=6)和一次离心运动组(E组,n=36)。一次离心运动组大鼠按照运动后不同时间,又随机分为离心运动后即刻组(E0 h组,n=6)、离心运动后6 h组(E6 h组,n=6)、离心运动后12 h组(E12 h组,n=6)、离心运动后24 h组(E24 h组,n=6)、离心运动后48 h组(E48 h组,n=6)和离心运动后72 h组(E72 h组,n=6)。运动方案根据Armstong的离心运动模型[25],采取在跑台上持续性下坡跑,坡度为-16°,速度为16m/min,运动时间为90 min。运动组进行3 d速度为16 m/min的适应性跑台运动。第1天坡度0度跑台运动5 min,第2天坡度0°跑台运动10 min;第3天休息;第4天进行正式实验,坡度-16°跑台运动90 min。
2.2 测试样本的收集
各组大鼠在其对应的时间点进行处理,大鼠称重后,水合氯醛(0.8 m l/100 g)进行腹腔麻醉。将腹主动脉血抽取干净,迅速分离比目鱼肌,做好标记,锡纸包裹,立刻投入到液氮罐中进行暂时保存。待取材完成后将比目鱼肌标本转移至-80℃冰箱保存,备用。
2.3 Western blot测试指标
100 mg冻存骨骼肌组织使用液氮在研钵中研磨成粉末,后将其加入到1 m l含蛋白酶抑制剂和PMSF的裂解液中。进行电泳前以4:1比例加入5倍的上样缓冲液,煮沸10 min。蛋白含量测定按试剂盒说明(BCA法)进行。各蛋白电泳上样量为20 μg,电泳后采用湿法进行蛋白质电转印,5%BSA封闭液室温孵育2 h。用5%BSA封闭液稀释一抗Miro1(1:200,Santa),Miro2(1:500,Santa),KIF5B(1:2000,abcam),VDAC1(1:2000,abcam),Dynlt1(1:500,Santa),4℃过夜。以5%BSA封闭液稀释二抗(1:4000,中杉金侨公司),室温孵育2 h。用ECL发光试剂在凝胶成像系统中使用Image Lab 4.1软件
拍摄条带照片。使用Gelpro软件对目的蛋白进行光
密度相对定量分析,以GAPDH为内参。
2.4 数据统计方法
所有数据用SPSS 17.0统计软件包进行处理,数据以平均值±标准差的形式表示。采用单因素方差(One-ANOVA)分析,方差齐性时用LSD方法,方差不齐性时用Tamhane’s方法。显著性水平定为P<0.05,非常显著性水平定为P<0.01。
3 结果
3.1 一次离心运动后不同时相Miro1蛋白表达的变化
实验结果显示,一次离心运动组在干预后Miro1蛋白表达呈现上升趋势,各时刻点与安静对照组相比差异具有显著性(P<0.01),运动后即刻Miro1蛋白的表达即出现升高,在6h和12 h又出现下降,运动后24 h又出现升高,运动后72 h达到峰值。

表1 一次离心运动后骨骼肌M iro1蛋白表达变化

图1 一次离心运动后骨骼肌M iro1蛋白表达变化
3.2 一次离心运动后不同时相Miro2蛋白表达的变化
实验结果显示一次离心运动组在干预后Miro2蛋白的表达呈现上升趋势,与安静组相比,各时间点差异均具有显著性(P<0.01)。运动后即刻Miro2蛋白的表达升高,在24 h出现峰值。

图2 一次离心运动后骨骼肌M iro2蛋白表达变化
3.3 一次离心运动后不同时相KIF5B蛋白表达的变化
实验结果显示一次离心运动组干预后各组KIF5B蛋白的表达变化有下降趋势,但各组间无显著性差异。

图3 一次离心运动后骨骼肌K IF5B蛋白表达变化
3.4 一次离心运动后不同时相VDAC1蛋白表达的变化
实验结果显示,一次离心运动组VDAC1蛋白的表达呈现升高趋势。6 h(P<0.01)、12 h(P<0.05)、24 h(P<0.01)、72 h(P<0.01)组VDAC1蛋白的表达与安静对照组相比差异具有显著性。
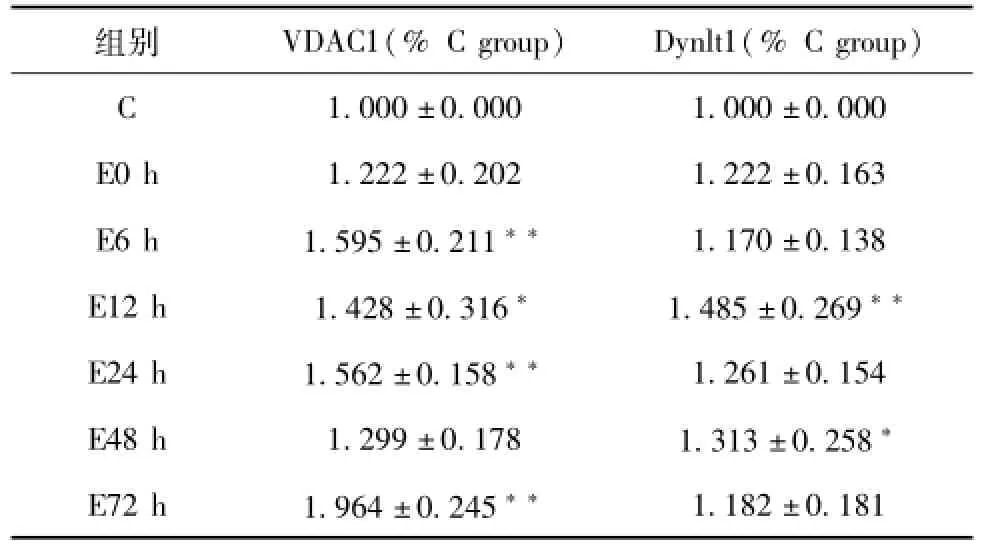
表2 一次离心运动后骨骼肌VDAC1、Dynlt1蛋白表达变化

图4 一次离心运动后骨骼肌VDAC1蛋白表达变化
3.5 一次离心运动后不同时相Dynlt1蛋白表达的变化
实验结果显示,一次离心运动组Dynlt1蛋白的表达也呈现升高趋势,12 h(P<0.01)和48 h(P<0.05)Dynlt1蛋白的表达与安静对照组相比升高明显,差异具有显著性。

图5 一次离心运动后骨骼肌Dynlt1蛋白表达变化
4 分析与讨论
4.1 神经组织线粒体移动相关分子马达的研究
极性细胞类型中,线粒体移动是维持细胞健康的基础,且主要通过motor蛋白及adaptor蛋白的配合来完成[26]。一项对果蝇的研究发现,驱动蛋白和动力蛋白是果蝇运动神经元轴突线粒体快速运输的基本动力[27]。而马达分子与线粒体相连依靠adaptor蛋白,常见的adaptor蛋白有Miro、Syntabulin和Milton[28]。驱动蛋白kinesin和动力蛋白dynein负责细胞内货物的长距离运输,包括线粒体的运输,而这个过程依赖细胞骨架微管。线粒体运动调控机制研究尚处于探索研究阶段,关于具体调控机制尚不明确,但有一点是肯定的,那就是一个复杂调控体系[29]。线粒体的长距离运动受到这两类马达蛋白的调控,但有的研究也指出当机体功能异常时,kinesin也会向相反的方向运动[30]。
姚斌彬以坐骨神经夹持大鼠损伤模型模拟临床中周围神经的压迫损伤,通过推拿干预后,检测了脊髓中Dynein、Kinesin的表达,发现推拿能够提高坐骨神经损伤大鼠脊髓中马达蛋白的表达。认为马达蛋白从动力层面促进了轴浆的运输,并从神经营养物质传递层面改善了轴浆运输的功能,认为是推拿治疗周围神经损伤起效的机理之一[31]。分子马达参与营养物质的运输,而推拿可以提高分子马达的蛋白表达,保证损伤部位的能源物质提供,可以促进损伤的恢复。于晓伟报道8周有氧运动可以上调6月龄APP/PS1双转基因小鼠(阿尔茨海默病模型)皮层线粒体顺向转运马达蛋白Kinesin重链和轻链的表达,并改善线粒体顺向轴浆转运障碍,增加线粒体在突触末梢的分布,进而改善突触结构和功能,认为Kinesin重链和轻链的表达上调,是有氧运动促进APP/PS1转基因小鼠行为学能力的机制之一[32]。
4.2 一次离心运动对骨骼肌线粒体移动相关蛋白的影响
目前运动对于线粒体移动的相关蛋白的研究较少。Miro是GTPase家族成员,参与到线粒体移动的调节。有研究认为它也参与到了线粒体运动和动力学变化。刘慧君报道了小鼠一次中等强度负荷跑台运动后30 min、60 min、90 min和120 min后骨骼肌线粒体的移动相关基因Miro1表达,发现经过30 min、60 min、90 min和120 min急性运动后,骨骼肌中Miro1 mRNA表达与安静组相比显著升高,急性运动中骨骼肌MirolmRNA表达较安静时显著增加,认为这种变化可能有利于促进运动过程中的线粒体呼吸和ATP合成,并以此来应对细胞对能量的高需求[33]。本研究发现一次离心运动骨骼肌中Miro蛋白表达增加,与前人的研究结果一致。
KIF5B是细胞内参与线粒体移动的重要马达蛋白。一项6周耐力跑台训练对脲链霉素致糖尿病大鼠脊髓和坐骨神经KIF5B蛋白表达的研究发现,糖尿病组的KIF5B蛋白表达升高,耐力运动可调节KIF5B的蛋白表达,并使它们接近正常水平。耐力运动也可以调节非糖尿病组的KIF5B的蛋白表达。研究认为糖尿病可以使脊髓和坐骨神经KIF5B蛋白表达升高,而耐力运动可以改善这种状况,可能是运动使血糖降低的原因之一[34]。而本研究中一次离心运动对KIF5B的蛋白表达影响不明显。
VDAC1是存在于线粒体外膜上的膜蛋白,当前关于其的研究大部分集中在对疾病的研究,并且认为其是启动线粒体介导细胞凋亡的重要原因之一[35],也参与到了自噬的过程[36]。但是作为线粒体的离子通道,也可以促进ATP释放,参与细胞氧化还原反应,对维持细胞的氧化还原平衡状态有重要影响。心肌中VDAC1与Dynlt1关联,且上调Dynlt1表达后可以稳定缺氧状态下的线粒体通透性。在神经组织中,VDAC1与Dynlt1关联是神经系统内的线粒体运动的主要调节方式之一。本研究发现一次离心运动干预后VDAC1蛋白的表达呈现升高趋势,且具有波动性,在6 h、12 h、24 h、72 h时间点与安静组有显著性差异。单纯运动组Dynlt1蛋白的表达也呈现明显升高趋势。VDAC1与Dynlt1均有上调,有利于运动后线粒体的重新分布,对于骨骼肌能量生成、转运起到良好的作用,是机体在运动后的一种有利于恢复的调节过程。
一次离心运动可以使Miro、VDAC1和Dynlt1蛋白表达升高。结果提示一次离心运动使骨骼肌内线粒体移动相关蛋白的表达增高,因而线粒体移动的动力源得以保证,同时可以使线粒体的移动活跃,推测由于向膜下方向运动的线粒体较多,进而导致了肌膜下线粒体积聚。而这一过程是由线粒体移动相关蛋白协助线粒体向膜下运动结果,推测膜下线粒体的积聚与这些蛋白的表达改变有密切关系。此外,运动使骨骼肌内的能源物质消耗增多,肌膜的活动增强,线粒体需要移动到肌膜下,有利于快速的获取氧和能源物质,满足活动时的能量需求,进而出现肌膜下线粒体聚集,而线粒体的这种分布与Miro、VDAC1和Dynlt1蛋白表达升高有关联。由于一次离心运动时可以导致细胞内的内环境发生复杂的变化,蛋白之间的相互作用可能会受到影响,因此具体的调节机制有待于进行深入的研究。
5 结论
一次离心运动不同时相骨骼肌Miro、VDAC1、Dynlt1蛋白表达出现上调,表明离心运动后骨骼肌线粒体移动活跃,有利于运动后骨骼肌损伤的修复。
[1]JoséM G.Mitochondrial structure,composition,and dynamics[M]//Mitochondria and Their Role in Cardiovascular Disease. Springer,US,2013:29-57.
[2]Nogales E.Structural insights intomicrotubule function[J].Annual Review of Biochemistry,2000,69(1):277-302.
[3]徐荣归.分子马达运动机制的动力学研究[D].上海:东华大学,2006.
[4]Hollenbeck P J,Saxton W M.The axonal transport ofmitochondria[J].Journal of Cell Science,2005,118(23):5411-5419.
[5]Leidel C P.Measuringmolecularmotor forces to probe transport regulation in vivo[D].Austin:The University of Texas,2013.
[6]于琨,韩英荣,展永,等.分子马达的调节机制[J].现代物理知识,2008,20(4):24-28.
[7]Cai Q,Sheng Z H.Mitochondrial transport and docking in axons[J].Experimental neurology,2009,218(2):257-267.
[8]Miki H,Setou M,Kaneshiro K,et al.All kinesin superfamily protein,KIF,genes in mouse and human[J].Proceedings of the National Academy of Sciences,2001,98(13):7004-7011.
[9]Vicario-Orri E,Opazo C,Muñoz F J.The pathophysiology of axonal transport in alzheimer’s disease[J].Journal of Alzheimer’s Disease,2015,43(4):1097-1113.
[10]Nobutaka Hirokawa.From electronmicroscopy tomolecular cell biology,molecular genetics and structural biology:intracellular transport and kinesin[J].Journal of Electron Microscopy 60(Supplement1)2011:S63-S92.
[11]Istvan R.Boldogh,Liza A.Pon.Mitochondria on the move[J]. TRENDS in Cell Biology,2007,17(10):502-510.
[12]Santama N,Connie P N,Ong L L,et al.Distribution and functions of kinectin isoforms[J].Journal of Cell Science,2004,117(19):4537-4549.
[13]邵建林,彭沛华,周银燕,等.HO-1对氧糖剥夺海马神经元线粒体运动调节蛋白的影响[J].昆明医科大学学报,2012(4):4-7.
[14]Glater E E,Megeath L J,Stowers R S,et al.Axonal transport ofmitochondria requires milton to recruit kinesin heavy chain and is light chain independent[J].The Journal of Cell Biology,2006,173(4):545-557.
[15]Wang Z.Kinesin-1 in skeletalmuscle[D].Hong Kong:The University of Hong Kong,2008.
[16]Tanaka Y,Kanai Y,Okada Y,et al.Targeted disruption ofmouse conventional kinesin heavy chain kif5B,results in abnormal perinuclear clustering of mitochondria[J].Cell,1998,93(7):1147-1158.
[17]FranssonÅ,Ruusala A,Aspenström P.Atypical Rho GTPases have roles in mitochondrial homeostasis and apoptosis[J].Journal of Biological Chemistry,2003,278(8):6495-6502.
[18]YiM,Weaver D,Hajnóczky G.Controlofmitochondrialmotility and distribution by the calcium signal a homeostatic circuit[J].The Journal of Cell Biology,2004,167(4):661-672.
[19]Macaskill AF,Rinholm JE,Twelvetrees AE,et al.Miro1 is a calcium sensor for glutamate receptor-dependent localization of mitochondria at synapses[J].Neuron,2009,61(4):541-555.
[20]王圣柳,孙飞.Dynactin辅助dynein进行细胞内物质运输的研究进展[J].生物物理学报,2012,28(10):785-793.
[21]Al-Mehdi A B,Pastukh V M,Swiger B M,et al.Perinuclear mitochondrial clustering creates an oxidant-rich nuclear domain required for hypoxia-induced transcription[J].Science signaling,2012,231(5):1-20.
[22]Williams JC,Siglin A E,Lightcap CM,et al.Structural analysis of dynein intermediate and light chains[J].Dyneins:Structure,Biology and Disease,2011:157.
[23]房亚东.MAP4上调DYNLT1减轻缺氧早期线粒体通透性转换的作用及机制研究[D].重庆:第三军医大学,2009.
[24]Fang Y,Xu X,Dang Y,etal.MAP4 mechanism that stabilizesmitochondrial permeability transition in hypoxia:microtubule enhancement and DYNLT1 interaction with VDAC1[J].PloSOne,2011,6(12):e28052.
[25]Armstong RB.Eccentric exercise-induced injury to skeletalmuscle[J].Appl Phyiol,1983,54:80-93.
[26]Hollenbeck P J,Saxton W M.The axonal transport ofmitochondria[J].Journal of Cell Science,2005,118(23):5411-5419.
[27]Pilling A D,Horiuchi D,Lively C M,et al.Kinesin-1 and Dynein are the primarymotors for fast transportofmitochondria in Drosophilamotor axons[J].Molecular Biology of the Cell,2006,17(4):2057-2068.
[28]陈邵宏,庞效云,孙飞.线粒体运动及其相关的细胞骨架和蛋白[J].生物物理学报,2011,27(12):1019-1029.
[29]Zinsmaier K E,Babic M,Russo G J.Mitochondrial transport dynamics in axons and dendrites[M].Berlin:Springer Berlin Heidelberg,2009:361-381.
[30]Fuchs F,Westermann B.Role of Unc104/KIF1-related motor proteins in mitochondrial transport in neurospora crassa[J].Molecular Biology of the Cell,2005,16(1):153-161.
[31]姚斌彬.基于马达蛋白及NGF探寻推拿对坐骨神经损伤大鼠轴浆运输功能的影响及机理[D].北京:北京中医药大学,2013.
[32]于晓伟,解玉珍,顾博雅,等.有氧运动调节驱动蛋白改善AD模型皮层线粒体轴突转运[J].北京体育大学学报,2016(6):63-68.
[33]刘慧君,翟克敏,赵斐,等.线粒体移动相关基因miro1在急性运动中的表达特征[J].中国运动医学杂志,2010(2):173-176.
[34]Masoud R,Reza G,Mansoureh M,et al.Treadmill trainingmodifies KIF5B motor protein in the STZ-induced diabetic rat spinal cord and sciatic nerve[J].Arch Iran Med,2015,18(2):94-101.
[35]Tajeddine N,Galluzzi L,Kepp O,et al.Hierarchical involvement of Bak,VDAC1 and Bax in cisplatin-induced cell death[J].Oncogene,2008,27(30):4221-4232.
[36]Geisler S,Holmström K M,Skujat D,et al.PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1[J].Nature Cell Biology,2010,12(2):119-131.
责任编辑:郭长寿
Effect of an Eccentric Exercise on M itochond rial M ovem ent Related Proteins in Skeletal M uscle of Rats
YU Ying1,YU Liang2,LIYunguang3,LI Junping2,ZHOU Yue2,WANG Hongkun1,WU Fengyu1,WANG Ruiyuan2
(1.Department of Sports Science and Health,Harbin Institute of P.E.,Heilongjiang 150008,Harbin,China;2.Kinesiology School,Beijing Sport University,Beijing 100084,China;3.Dept of P.E.,Heilongjiang University of Science and Technology,Harbin 150022,Heilongjiang,China)
Objective:M itochondriamovement related proteins are observed after an eccentric exercise.Methods:42 SD rats are random ly divided into quiet group(6 rats)and an eccentric exercise group(36 rats)after adaptation.Exercise group rats should run on the treadm ill,-16°,16m/m in,90m in.Experimental samp lings are taken after exercise immediately,6 hours,12 hours,24 hours,48 hours and 72 hours.Western blotting is used to detect M iro1,M iro2,KIF5B,VDAC1 and Dynlt1 protein expression.Results:Compared with the quiet group,the protein expressions of M iro1 and Miro2 are increased significantly and the change of KIF5B is not significant after an eccentric exercise.The protein expressions of VDAC1 are increased in exercise group after6 hours,12 hours,24 hours,48hours and 72 hours significantly and Dynlt1 are increased after 6 hours and 48 hours.Conclusion:The increase of M iro,VDAC1 and Dynlt1 protein expression after an eccentric exercise in skeletalmuscle showed thatmitochondriawere active after exercise,which was beneficial to the repairof skeletalmuscle damage after exercise.
eccentric exercise;rat;skeletalmuscle;mitochondriamovement
G804.2
A
1004-0560(2016)06-0059-06
2016-11-09;
2016-12-03
哈尔滨体育学院校级学术骨干课题(2016XJ007);国家自然科学基金项目(31471133);中央高校基本科研业务费专项资金资助北京体育大学自主科研课题(2015ZD004,2015YB007,2016yb018,2016RB010,2016yb047)。
于 滢(1979—),女,讲师,博士,主要研究方向为骨骼肌损伤。
王瑞元(1956—),教授,博士,博士生导师,主要研究方向为骨骼肌损伤。E-mail:Wangry@vip.sina.com。

