长链非编码核糖核酸牛磺酸上调基因1在乳腺癌中的表达及其对细胞增殖凋亡的影响
赵筱倩,陆肖玮
(江苏省无锡市妇幼保健院乳腺病科,江苏无锡214000)
长链非编码核糖核酸牛磺酸上调基因1在乳腺癌中的表达及其对细胞增殖凋亡的影响
赵筱倩,陆肖玮
(江苏省无锡市妇幼保健院乳腺病科,江苏无锡214000)
摘要:目的探讨长链非编码核糖核酸(lncRNA)牛磺酸上调基因1(TUG1)在乳腺浸润性导管癌(IDC)中的表达及其对乳腺癌细胞增殖及凋亡功能的影响。方法筛选2013年1月~12月该院乳腺病科行手术切除并经病理检查证实为IDC患者的乳腺癌及对应癌旁组织40例。运用荧光定量PCR(qRT-PCR)技术检测lncRNA-TUG1在IDC患者肿瘤及癌旁组织中的表达水平,整理分析lncRNA-TUG1表达与患者临床病例资料间的相关性;采用lncRNA-TUG1特异性siRNA转染人乳腺癌MCF-7细胞,采用CCK-8试验检测转染siRNA后MCF-7细胞增殖能力的变化;流式细胞仪检测转染后MCF-7细胞凋亡变化。采用qRT-PCR、Western-blot检测转染后P27表达变化。结果lncRNA-TUG1在IDC组织中表达水平显著高于对应癌旁组织(t =4.273,P<0.001),IDC组织中lncRNA-TUG1高表达与肿瘤直径增大(P=0.033)及高TNM分期(P= 0.045)显著相关;lncRNA-TUG1特异性siRNA转染MCF-7细胞后可显著抑制细胞增殖(P=0.041)并上调凋亡细胞比例(t=3.206,P=0.007);qRT-PCR及Western-blot结果证实,沉默lncRNA-TUG1后可显著促进P27 mRNA及蛋白表达水平(P<0.001)。结论lncRNA-TUG1在IDC组织中表达上调并与肿瘤恶性临床病理特征有关,lncRNA-TUG1可能通过下调抑癌基因P27的表达来促进IDC生长。
关键词:lncRNA-TUG1;乳腺浸润性导管癌;增殖;凋亡;P27
乳腺癌是女性生殖系统常见恶性肿瘤[1],由于其具有发病隐匿、进展快及术后易复发的特点,已成为危害我国女性身体健康的重大公共卫生问题[2]。乳腺浸润性导管癌(invasive ductal carcinoma,IDC)是乳腺癌较为常见且恶性程度较高的病理类型之一[3],对IDC细胞分子生物学特性的研究对于寻找IDC新的治疗靶点及提高我国乳腺癌诊治水平具有重要意义。
长链非编码核醣核酸(long noncoding ribonucleic acid,lncRNA)是一类长度大于200个核苷酸的非编码单链RNA[4]。越来越多的证据表明[5],lncRNA能够通过多种方式调节包括肿瘤生长、转移及血管生成在内的多种病理过程来促进恶性肿瘤的发生、发展。lncRNA的异常表达及其所发挥的生物学功能是近年来乳腺癌分子病理学的研究热点之一。最新研究指出,长链非编码核糖核酸牛磺酸上调基因1(long noncoding ribonucleic acid taurine up-regulated gene 1,lncRNA-TUG1)在癌症进展过程中具有重要的调节作用[6],而其在乳腺癌中的临床意义及生物学功能尚不清楚。本研究通过检测lncRNA-TUG1的表达及对乳腺癌MCF-7细胞增殖、凋亡过程的调控作用,研究lncRNA-TUG1在乳腺癌生长中的临床意义及作用机制,为乳腺癌的分子诊断与靶向治疗提供一定的理论依据。
1 资料与方法
1.1临床标本及主要试剂
筛选2013年1~12月于江苏省无锡市妇幼保健院乳腺病科行手术切除并经病理检查证实为IDC患者的乳腺癌及对应癌旁组织(距肿瘤边缘>2 cm)40例。平均年龄(51.2±1.1)岁。所有患者术前均未行新辅助放化疗。所得组织标本均保存于液氮当中。lncRNA-TUG1 siRNA及阴性对照siRNA均购自上海吉玛生物科技有限公司,CCK-8试剂盒及Annexin V-FITC细胞凋亡检测试剂盒均购自上海生工生物科技有限公司,lncRNA-TUG1引物(正向引物5'-TAGCAGTTCCCCAATCCTTG-3';反向引物5'-TA GCAGTTCCCCAATCCTTG-3'),P27引物(正向引物5'-GATGGACGCCAGACAAGC-3';反向引物5'-CTC CTGCCATTCGTATCTGC-3'),β-actin引物(正向引物5'-CTCCATCCTGGCCTCGCTGT-3';反向引物5'-GCTGTCACCTTCACCGTTCC-3')由上海生工生物科技有限公司合成,RNA提取试剂盒fast200购自上海飞捷生物科技有限公司,逆转录聚合酶链反应(RT-PCR)试剂盒[PrimeScriptTMRT reagent Kit (Perfect Real Time)]及实时定量聚合酶链反应(Real-time PCR)试剂盒[SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus)]均购自宝生物工程(大连)有限公司,兔抗人P27多克隆抗体及鼠抗人β-actin单克隆抗体购自美国CST公司,胎牛血清购自浙江天杭生物科技有限公司,1×DMEM液体培养基购自美国HyClone公司,人正常乳腺上皮细胞MCF-10A及乳腺癌细胞MCF-7购自中国科学院上海生命科学研究院细胞资源中心,转染试剂Lipofectamine 2000购自美国Invitrogen公司,RIPA裂解液、BCA蛋白定量试剂盒及ECL试剂盒均购自上海碧云天生物技术研究所。
1.2RNA提取及荧光定量聚合酶链反应(qRT-PCR)
按fast200说明书分别提取癌、癌旁组织及MCF-10A、MCF-7细胞中总RNA,经紫外分光光度计检测,OD260/OD280者为合格样品。取500 ng总RNA为模板,按RT-PCR试剂盒说明书配制逆转录反应体系,采用Random 6及Oligo-dT双引物法逆转录细胞内lncRNA及mRNA。逆转录完成后,以2μl cDNA配制Real-time PCR体系,按Real-time PCR说明书要求扩增靶基因。
1.3细胞培养
MCF10A及MCF-7细胞均接种于含10%胎牛血清的1×DMEM培养基中,在含5%二氧化碳CO2的37℃培养箱中以饱和湿度进行培养。待细胞稳定传代2~3代后,取对数生长期细胞进行后续试验。
1.4细胞转染
MCF-7细胞接种于6孔板中,接种密度以过夜培养后融合度可达50%为准。依据Lipofectamine®2000说明书,以无血清DMEM培养基按表1配制转染体系,分别向MCF-7细胞中转染lncRNA-TUG1 siRNA及NC siRNA。转染6 h后更换为含10%胎牛血清的完全培养基。

表1 6孔板转染体系(每孔)
1.5CCK-8检测
分别收集转染24、48及72 h后的MCF-7细胞,重悬后以2 000/孔接种于96孔板中,调整细胞悬液体积为100μl/孔,培养至细胞贴壁。每孔加入10μl CCK-8溶液,继续孵育2 h,弃上清液,15 min内用酶标仪检测450 nm波长下的光密度(optical density,OD)值。
1.6细胞凋亡检测
MCF-7细胞转染72 h后使用PBS溶液洗涤细胞2次,按试剂盒说明书要求,采用Binding buffer (1×)重悬细胞并调整细胞密度至2×105/ml,于检测管中加入195μl细胞悬液后加入5μl Annexin V-FITC,避光孵育15 min后,使用200μl Binding buffer(1×)洗涤细胞并以1 000 r/min离心细胞3 min,再次以190μl Binding buffer(1×)溶液重悬细胞后加入10μl Propidium Iodide,避光孵育15 min后于流式细胞仪上进行检测。
1.7Western blot检测
收集转染72 h的MCF-7细胞,使用RIPA裂解液裂解细胞,BCA法测定总蛋白浓度。垂直电泳分离蛋白后,以1∶1 000稀释的P27及β-actin一抗结合相应目的蛋白,以1∶5 000稀释的HRP标记羊抗兔二抗结合一抗,ECL法发光检测蛋白相对表达量。
1.8统计学方法
所有数据均采用SPSS 21.0统计软件进行分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验或ANOVA检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1IDC及癌旁组织中lncRNA-TUG1的表达差异
IDC组织中lncRNA-TUG1的相对表达量为(5.186±0.231),而对应癌旁组织中lncRNA-TUG1表达量仅为(1.644±0.047)。Student-t检验证明两组标本间lncRNA-TUG1表达差异具有统计学意义(t=4.273,P<0.001),见图1。
表2 lncRNA-TUG1表达与乳腺癌患者临床病理特征的关系(n=40,±s)
注:†P<0.05
项目 lncRNA-TUG1相对表达量 P值年龄<50岁 5.179±0.201 0.737 ≥50岁 5.281±0.132绝经与否已绝经 5.193±0.111 0.868未绝经 5.134±0.207肿瘤直径<2 cm 3.483±0.097 0.033†≥2 cm 6.959±0.114肿瘤数量1个 5.374±0.211 0.068 ≥2个 5.937±0.182组织学分级G1~G2 5.089±0.107 0.083 G3 5.313±0.132淋巴结转移无5.043±0.037 0.057 有5.588±0.071 TNM分期无4.117±0.068 0.045†有5.883±0.120
2.2IDC组织中lncRNA-TUG1异常表达与患者临床特征间的相关性
为探究IDC组织中lncRNA-TUG1的异常表达是否会影响IDC患者的临床病理表现,笔者对表2所列的临床病理特征进行二分类,并计算lncRNA-TUG1相对表达量。经统计学分析发现,IDC组织中高表达水平的lncRNA-TUG1与肿瘤直径增大(>2 cm)及高TNM分期(III+IV期)具有一定的相关性。提示lncRNA-TUG1在乳腺癌进展过程中可能具有一定的生物学功能。
2.3沉默lncRNA-TUG1对MCF-7细胞增殖凋亡的影响
笔者通过PCR检测证实,乳腺癌MCF-7细胞中lncRNA-TUG1的相对表达量高于人正常乳腺上皮细胞MCF-10A(P<0.001),见图2A,其表达差异约2.31倍。然后,笔者采用瞬时转染技术,以Lipo-fectamine®2000为媒介,将lncRNA-TUG1特异性siRNA或NC siRNA转染入MCF-7细胞中。通过qRT-PCR检测证实,lncRNA-TUG1特异性siRNA能敲低细胞内lncRNA-TUG1的表达水平(P<0.001),见图2B。

图2 siRNA沉默MCF-7细胞lncRNA-TUG1表达
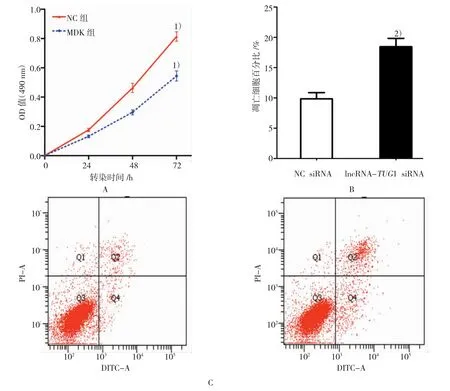
图3 沉默lncRNA-TUG1对MCF-7细胞增殖凋亡的影响
成功沉默MCF-7细胞内lncRNA-TUG1表达后,笔者首先采用CCK-8法检测lncRNA-TUG1表达水平变化对MCF-7细胞增殖能力的影响。如图3A所示,与NC组比较,敲低lncRNA-TUG1后可显著抑制MCF-7细胞增殖能力(P=0.041)。如图3B、3C所示,进一步通过流式细胞仪检测发现沉默lncRNA-TUG1对MCF-7细胞的凋亡具有显著的促进作用[(18.435±1.377)vs(9.833±1.024),t =3.206,P=0.007]。
2.4下调lncRNA-TUG1对MCF-7细胞中P27表达的影响
P27是一种具有细胞周期蛋白依赖性激酶(cyclin dependent kinases,CDKs)活性抑制作用的蛋白,能通过与细胞周期蛋白-CDK复合物结合来抑制细胞周期进展,最终抑制细胞增殖。笔者在MCF-7细胞内沉默lncRNA-TUG1表达后,通过qRT-PCR和Western-blot检测发现,P27 mRNA及蛋白水平均较NC组出现升高(P<0.001),见图4A、4B,提示lncRNA-TUG1可能是通过抑制P27表达而现促肿瘤细胞生长作用的。

图4 沉默lncRNA-TUG1对MCF-7细胞P27表达的影响
3 讨论
在全球,女性乳腺癌年患病人数逾百万。目前,无论是我国[7]还是西方发达国家[8],乳腺癌发病率均占女性恶性肿瘤发病首位。随着分子生物学技术的进步,生物靶向治疗已成为乳腺癌重要的辅助治疗手段,曲妥珠单抗(Trastuzumab,商品名赫赛汀)及帕妥珠单抗(Omnitarg,商品名奥密塔克)已在乳腺癌治疗上获得巨大成功[9-10]。因而,寻找和研究有效的的乳腺癌分子治疗靶点对改善广大乳腺癌患者预后具有重要意义。
目前,越来越多的证据显示,包括微小核糖核酸(microRNA)及lncRNA在内的多种非编码核糖核酸(noncoding RNA,ncRNA)对细胞的生理及病理过程具有重要影响。并且,针对ncRNA在疾病中的异常表达,具有极大的药物研发潜力,目前已有miR-122 和miR-34 2个microRNA进入了临床研究阶段[11]。lncRNA-TUG1是近年来新发现的1种lncRNA,其对于组织发育及多种良恶性疾病的发展均具有调控作用,在小鼠大脑皮层发育的多个关键时期均能够检测到lncRNA-TUG1表达的显著上调[12]。而在恶性肿瘤中,lncRNA-TUG1的异常表达具有重要的临床治疗监测及预后评价意义,Zhang等[13]的研究表明,lncRNA-TUG1在骨肉瘤组织中的表达显著上调且与肿瘤体积增大、术后化疗抵抗及高Enneking分期显著相关,生存分析曲线结果也证实高表达的lncRNA-TUG1预示着较短的术后无瘤生存时间和总生存时间。因而,lncRNA-TUG1表达水平的改变被认定与肿瘤进展、转移和复发密切相关。
在本研究中,笔者首先在临床组织标本中检测证实,lncRNA-TUG1高表达于浸润性乳腺导管癌组织当中。以患者不同临床病理特征为亚组的分析表明,lncRNA-TUG1高表达与IDC患者肿瘤直径增大及高TNM分期密切相关,本研究结果与在骨肉瘤、膀胱癌[14]及脑胶质瘤[15]中的研究结果相一致。为进一步探讨lncRNA-TUG1在乳腺癌细胞中的生物学功能,笔者应用siRNA特异性敲低MCF-7细胞中lncRNA-TUG1表达,通过CCK-8试验及流式细胞仪分析证实沉默lncRNA-TUG1能够抑制细胞增殖并促进细胞凋亡的发生。组织学及细胞学实验结果一致表明,lncRNA-TUG1在乳腺癌细胞生长过程中具有一定的促进作用。
位于人类染色体12p12.0~12p13.1处的P27基因,能编码1个长度为198个氨基酸的多肽。P27能分别与Cyclin E-CDK2和Cyclin D-CDK4结合形成三元复合物而抑制CDK的活性,通过阻碍细胞周期进展而实现抗细胞增殖效应[16]。研究表明[15],多梳蛋白抑制复合物2(polycomb repressive complex 2,PRC2)能通过对P27启动子H3K27位点进行甲基化修饰而抑制P27的表达。而肝细胞癌中的lncR-NA-TUG1能够通过与PRC2复合物中EZH2和SUZ12两种组分的结合而将PRC2募集至抑癌因子KLF2的启动子区域,进而促进HCC的生长和转移[17]。综上,笔者推测,lncRNA-TUG1的促乳腺癌细胞生长作用可能是在表观遗传学层面通过启动子区域甲基化修饰作用而抑制P27的表达来实现的。为证实这一假说,笔者通过siRNA转染技术,特异性敲低MCF-7细胞内lncRNA-TUG1的表达,通过qRT-PCR检测及Western-blot检测发现,沉默lncRNA-TUG1可明显提高MCF-7细胞内P27的表达水平,初步探明了lncRNA-TUG1的作用机制。
综上所述,lncRNA-TUG1在浸润性乳腺导管癌组织中表达升高。lncRNA-TUG1可能通过下调P27的表达来抑制乳腺癌细胞的生长。因此,lncRNA-TUG1在乳腺癌生物靶向治疗中具有一定的研发价值。
参考文献:
[1]张磊,许培权.三阴性乳腺癌的系统治疗策略[J].现代肿瘤医学, 2015, 23(18): 2686-2690.
[2]莫文菊,丁小文,谢尚闹,等.紫杉醇通过mTOR信号通路影响乳腺癌细胞的增殖迁移[J].中国医师杂志, 2015, 17(7): 1005-1008.
[3]肖宇,雷玉涛,赵红梅,等. 41例双侧原发性乳腺癌的临床病理特征分析[J].现代肿瘤医学, 2014, 22(12): 2859-2863.
[4]王莹,辛彦. Hippo通路和相关长链非编码RNA(LncRNA)与肿瘤关系的研究进展[J].现代肿瘤医学, 2015, 23(21): 3190-3193.
[5] Sugihara H, Ishimoto T, Miyake K, et al. Noncoding RNA expression aberration is associated with cancer progression and is a potential biomarker in esophageal squamous cell carcinoma[J]. Int J Mol Sci, 2015, 16(11): 27824-27834.
[6]Özgür E, Mert U, Isin M, et al. Differential expression of long non-coding RNAs during genotoxic stress-induced apoptosis in HeLa and MCF-7 cells[J]. Clin Exp Med, 2013, 13(2): 119-126.
[7]郑莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志, 2013, 23(8): 561-569.
[8] Trotter K, Schneider SM, Turner BS. Group appointments in a breast cancer survivorship clinic[J]. J Adv Pract Oncol, 2013, 4 (6): 423-431.
[9] Tolaney SM, Barry WT, Dang CT, et al. Adjuvant paclitaxel and trastuzumab for node-negative, HER2-positive breast cancer[J]. N Engl J Med, 2015, 372(2): 134-141.
[10] Suparna BW, Sherry XY,王卓路,等.贝伐单抗联合化疗的乳腺癌新辅助治疗[J].中国普通外科杂志, 2013, 22(11): 1377-1378.
[11]徐艳敏,马清华,武佳,等.腺病毒介导miR-122联合化疗药物ADM对肝癌细胞杀伤作用的研究[J].浙江理工大学学报, 2010, 27(6): 919-923.
[12]牟丽丽,雷灿,钟小灵,等.长非编码RNA-Tug1在大脑皮层发育过程中的初步研究[J].中国科学:生命科学, 2015, 45(2): 156-165.
[13] Zhang Q, Geng PL, Yin P, et al. Down-regulation of long non-coding RNA TUG1 inhibits osteosarcoma cell proliferation and promotes apoptosis[J]. Asian Pac J Cancer Prev, 2013, 14 (4): 2311-2315.
[14] Han Y, Liu Y, Gui Y, et al. Long intergenic non-coding RNA TUG1 is over expressed in urothelial carcinoma of the bladder [J]. J Surg Oncol, 2013, 107(5): 555-559.
[15] Cai H, Xue Y, Wang P, et al. The long noncoding RNA TUG1 regulates blood-tumor barrier permeability by targeting miR-144 [J]. Oncotarget, 2015, 6(23): 19759-19779.
[16]刘镜文,魏茂富,邱小灵. P27在乳腺癌及正常乳腺组织中的表达及其意义[J].中国现代医生, 2012, 50(26): 92-93.
[17] Qiu M, Xu Y, Wang J, et al. A novel lncRNA, LUADT1, promotes lung adenocarcinoma proliferation via the epigenetic suppression of P27[J]. Cell Death Dis, 2015, 6: Doi: 10.1038/cddis. 2015.203.
(张蕾编辑)
论著
Expression of long noncoding RNA TUG1 and its role in cell proliferation and apoptosis of breast cancer
Xiao-qian Zhao, Xiao-wei Lu
(Department of Breast Diseases, Wuxi Maternal and Child Health-Care Hospital of Jiangsu Province, Wuxi, Jiangsu 214000, China)
Abstract:Objective To study the expression of long noncoding RNA TUG1 (lncRNA-TUG1) in invasive ductal carcinoma (IDC) and its role in regulating cell proliferation and apoptosis. Methods Fourty IDC and matched tumor adjacent tissues were collected between January and December in 2013. The expression of lncRNA-TUG1 tissues were detected by qRT -PCR. The relationship between lncRNA -TUG1 and clinical features was analyzed by student-t test. lncRNA-TUG1 siRNA was transfected into MCF-7 cells. CCK-8 assay and flow cytometry (FCM) were used to measure cell proliferation and apoptosis, respectively. The expression of P27 in transformed cells was detected by qRT-PCR and Western blot. Results The expression of lncRNA-TUG1 was significantly higher in IDC tissues than in tumor adjacent tissues (P < 0.001). High expression of lncRNA-TUG1 was positively associated with large tumor diameter (P = 0.033) and advanced TNM stage (P = 0.045). Knockdown of lncRNA-TUG1 significantly suppressed cell proliferation and induced apoptosis in MCF-7 cells (P < 0.05). P27 expression was upregulated when lncRNA-TUG1 was silenced (P < 0.05). Conclusions lncRNA-TUG1 is overexpressed in IDC tissues and associated with cell growth. lncRNA-TUG1 may promote IDC progression by inhibiting P27 expression.
Keywords:lncRNA-TUG1; invasive ductal carcinoma; proliferation; apoptosis; P27
[通信作者]陆肖玮,E-mail:zhaoxiaoq1980@126.com;Tel:13815100097
收稿日期:2015-10-30
文章编号:1005-8982(2016)08-0022-06
DOI:10.3969/j.issn.1005-8982.2016.08.005
中图分类号:R737.9
文献标识码:A

