缺氮对血球藻光系统II虾青素变化的影响
李金洵, 徐思源, 金 伟
(1 湖北工业大学轻工学部, 湖北 武汉 430068; 2 中国环境干部管理学院, 河北 秦皇岛 066000 )
缺氮对血球藻光系统II虾青素变化的影响
李金洵1, 徐思源2, 金伟2
(1 湖北工业大学轻工学部, 湖北 武汉 430068; 2 中国环境干部管理学院, 河北 秦皇岛 066000 )
[摘要]血球藻(Haematococcus pluvialis)是一种生活在淡水的单细胞生物,绿藻纲,被认为是理想的天然虾青素生产“工厂”。以代表性血球藻192.80为实验材料,研究缺氮条件下其光系统II(PSII)光化学变化与其次级代谢产物虾青素积累的变化之间的关系。实验结果显示,缺氮条件下,虾青素含量、叶绿素相对含量和细胞密度均显著低于全培养基处理组(P<0.05),而虾青素干重比值却显著高于全培养基处理组(P<0.05);藻细胞的最大光化学效率(Fv/Fm)下降到初始值85%左右后,在红色孢子中却呈现上升趋势,而rETR呈现先上升后下降的趋势。结果显示了血球藻响应氮胁迫的特殊保护机制。
[关键词]血球藻;虾青素;光系统II;缺氮
血球藻(Haematococcuspluvialis)是虾青素的天然来源。幼期的血球藻呈绿色,在营养盐限制、高光强、高盐浓度等恶劣的生长环境下,这些细胞将会发生形态学和生化方面的改变,转变成红色的厚壁孢子,同时开始积累虾青素[1-3]。
天然虾青素消除自由基和抗氧化的能力非常强,所以逐渐受到市场的重视和喜爱。能够对心脑血管疾病的治愈及术后修复产生积极的推动作用,在药物、保养品、营养品等多个领域都有着广阔的市场前景。而血球藻是生产天然虾青素的最好的生物来源,具有非常高的经济价值[3]。研究血球藻叶绿素荧光参数与虾青素含量的关系少有报道。大量研究表明,对植物叶绿素荧光的分析结果一定程度上反映了其光合作用情况[4],同时也可以反映其抵抗恶劣环境的能力。该方法测量速度较快且误差小,能同时反映植物的生长状态和光合作用情况[5-6]。
本次实验旨在通过叶绿素荧光技术对血球藻的叶绿素荧光变化规律的研究,将不同的生长环境作为变量,以此来研究与虾青素变化之间的关系,从而达到通过改变外界培养条件来优化血球藻的生长以及提高虾青素产量。
1材料和方法
1.1实验藻种
雨生红球藻(Haematoccuspluvialis192.80),来源于湖北工业大学(轻工学部)微藻实验室。
1.2微藻培养
实验使用量程为600 mL的column管( Φ4 cm)和 BG-11培养基培养,温度为(25±1)℃,光照强度为200 μmol/(m2·s),保证充分光照,持续通气培养,做好防止贴壁的措施。培养至对数生长期后离心收集绿色游动细胞,分别接入BG-11全培养基及无氮培养基中培养,其中接入BG-11无氮培养基的藻细胞在收集后用无氮培养基洗涤2次后接入,接种浓度OD550 nm(藻细胞在550 nm处的吸光度)设为0.2,每组分别设置4个平行。实验周期为14 d。每天同一时间取样,测量生长参数、叶绿素a、虾青素和叶绿素荧光各项参数。
1.3实验生长数据测量方法
1.3.1细胞计数细胞计数参考文献[7]的方法,使用血球计数板在显微镜下进行。
1.3.2干重测量前,先将Whatman GF/C滤膜置于烘箱内,干燥;再置于干燥皿中,滤膜冷却之后,称量滤膜重量(m1);精确量取藻液V藻液,使用称重后的滤膜进行抽滤;将附着有藻细胞的滤膜再次置于烘箱内,干燥;随后将滤膜置于干燥皿中,待滤膜完全冷却之后,对其进行称量(m2)。细胞干重
m=(m2-m1)×1000/V藻液
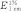
C2=C1×V2/V1
式中:C1表示上清液中叶绿素a的质量浓度,g/L;C2表示藻液中叶绿素a质量浓度,g/L;A666表示待测液中叶绿素a的吸光值;V1为藻液体积;V2为所用DMSO体积。

式中,C1表示上清液中虾青素的浓度,g/L;C2表示藻液中虾青素的浓度,g/L;A490表示待测液中虾青素的吸光值;V1表示藻液体积;V2表示所用DMSO体积。
1.3.5虾青素占干重体积分数虾青素占干重体积分数为
1.4光化学效率及快速光响应曲线测定
叶绿素荧光参数用可调制式荧光仪(PAM-WATER-ED, Walz,德国)测定[10~11]。藻样暗适应4 min,最大饱和脉冲设为4 000 μmol/(m2·s),光系统II的最大光化学效率(Fv/Fm),非光化学淬灭(NPQ分别计算如下:
Fv/Fm=(Fm-Fo)/Fm
NPQ=(Fm-Fm′)/Fm
Fm:荧光最大值,经过暗适应后,光合机构中PSII的所有反应中心呈现完全关闭状态下的荧光强度,此时所有的非光化学途径都处于最小。Fo:荧光初始值,经过暗适应后,光合机构中PSII的所有反应中心呈现完全开放状态下的荧光强度,这时所有的非光化学途径都处于最小。
Fv:暗适应之后,非光化学途径都处于最小时的最大可变荧光,Fv=Fm-Fo。

快速光响应动力学曲线(Rapid Light Curve,RLC)的测定,参考White等(1999)的方法[12],设定的光强梯度为0、141、217、320、489、730、1037、1441、2362 μmol/(m2s),光适应时间设定为20 s。
1.5快速叶绿素荧光动力学曲线的测定(OJIP诱导曲线)
室温下利用连续激发式荧光仪(Handy PEA,Hansatech,英国)获得叶绿素荧光诱导曲线。藻样暗适应时间4 min后,用Handy PEA按时检测记录实验材料照射激发光后10 μs至2 s内不同时间的荧光信号。实验材料经过一段时间暗适应后,再经过连续光照,叶绿素荧光强度随着光照时间变化的荧光曲线中的快相部分(时间为1 s左右)为OJIP诱导曲线。作图时,为了方便观察J点和P点变化,一般将横坐标(代表时间)改为对数坐标,得到典型的OJIP诱导曲线。
1.6数据统计与分析
用GraphPad Prism 5软件作图。所有实验数据采用SPSS17.0软件分别进行t检验(P<0.05视为两者差异显著)。
2实验结果
2.1缺氮对血球藻生长的影响
根据图1的描述,血球藻在缺氮条件下,细胞分裂停止并且虾青素开始积累(图1a、c、d)。接种后第3天,缺氮条件下藻细胞变成绿褐色不动状态,氮充足条件下藻细胞仍然是绿色游动状态;培养到第6 d,缺氮条件下藻细胞变为红色孢子状态,氮充足条件下藻细胞仍然可以观察到少量处于游动状态。相对于氮充足,在缺氮条件下血球藻叶绿素a几乎不增长(图1b)。在全培养基的整个培养周期中,雨生红球藻的生长较好, 当培养液中氮浓度逐渐消耗后, 所得到的最大细胞密度基本维持不变;缺氮时, 细胞密度基本维持稳定(图1a)。而在缺氮条件下,虾青素积累明显增加。培养14 d后,氮充足条件下单位体积的虾青素含量是缺氮条件下的1.84倍。缺氮条件下,细胞密度显著低于全培养基处理组(P<0.05),而缺氮条件下虾青素比干重比值显著高于全培养基处理组(P<0.05)。可以肯定的是,在缺氮这一单一因素影响下,扰乱了细胞的光合作用、呼吸以及代谢作用。因此,细胞分裂被抑制而且虾青素合成被激发。
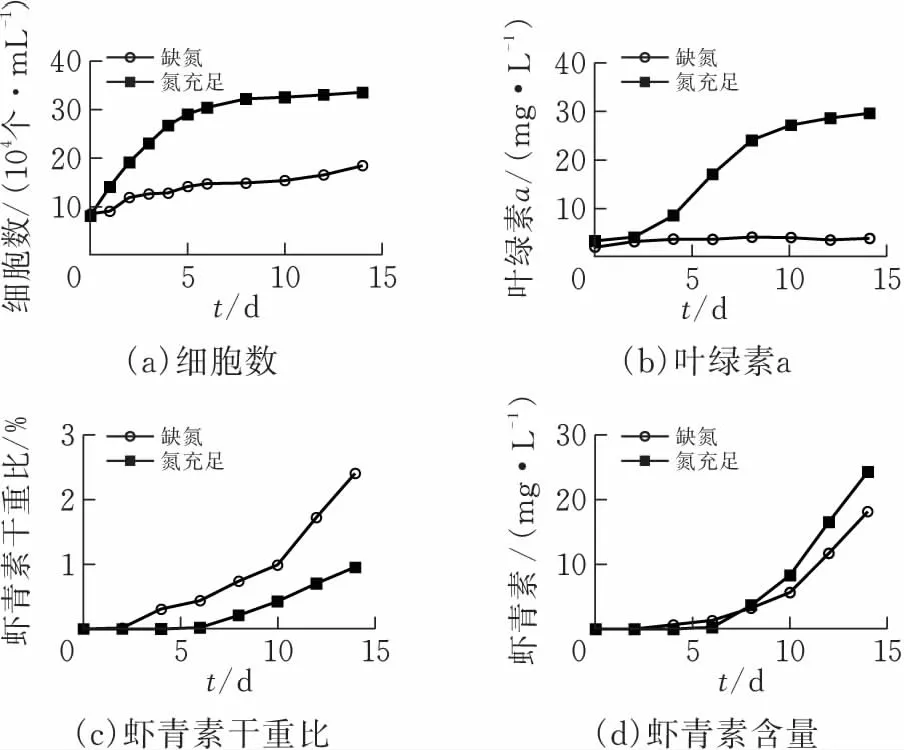
图1 血球藻在缺氮和氮充足条件下生长参数随时间变化的曲线
2.2叶绿素荧光参数的测定
图2为在缺氮条件下血球藻4个不同生长阶段,叶绿素荧光参数的变化。 藻细胞光合作用活性可以通过叶绿素荧光参数反映出来,尤其是PSII最大光量子产量,即Fv/Fm,刚刚接种的对数期游动绿细胞的Fv/Fm值最高,说明绿色对数期藻细胞的PSII的最大光量子产量最大。血球藻生长到红色孢子时期时,其Fv/Fm值下降了约12%(图2a)。在缺氮条件下,血球藻整个培养周期中,ΦFPSII和rETR参数呈现出同样的下降趋势,在绿褐色不动细胞中达到最低,rETR下降了10%,随后,rETR和Fv/Fm值均在红色孢子中呈现上升趋势 (图2a、d)。而NPQ表示的是非光化学猝灭,即PSII天线色素在光合作用过程中吸收的光能无法用于光合电子的传递而是通过热耗散的方式最终消耗掉,NPQ值从绿色游动细胞中的0.511上升到红色孢子细胞中的0.824,并且在绿色不动细胞和红色孢子细胞中较高(图2a)。
GV为绿色游动细胞;GR为绿色不动细胞;OR为绿褐色不动细胞;RC为红色孢子柱状图用平均值“±标准偏差”表示图 2 血球藻在缺氮条件下不同生长阶段的细胞中叶绿素荧光参数的测定
2.3快速叶绿素荧光诱导曲线(OJIP)
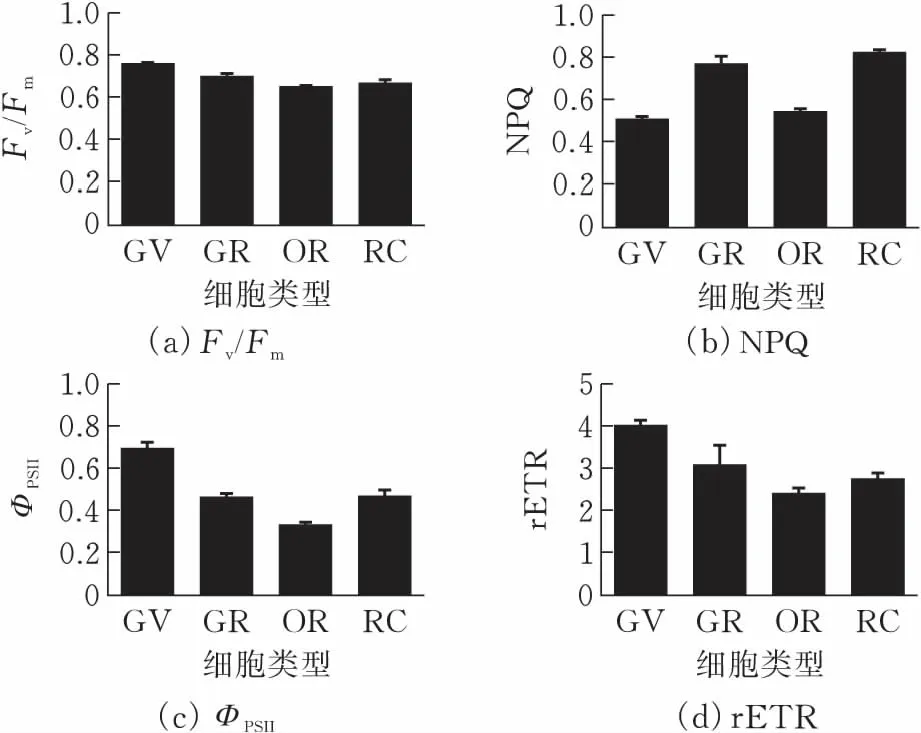
为研究缺氮对血球藻PSII电子传递途径的影响,选取整个培养周期的第0天及第14天测定氮充足及缺氮情况下的快速叶绿素荧光诱导曲线。如图3所示,血球藻细胞呈现出来的快速叶绿素荧光动力学曲线清晰反映出O、J、I、P相,与之前报道过的高等植物、蓝藻及绿藻的快速叶绿素荧光动力学曲线相似。O-J-I-P荧光瞬间升高是由于PSII电子受体池的连续还原以及PSII的反应中心慢慢的关闭而导致的。J期被认为是电子从QA-到QB的积累,I期反映了电子从QA到QB-积累,P期代表电子从QA-到QB2-的积累[13]。图3显示在第0 d和第14 d时,缺氮条件下藻细胞J点的相对可变荧光值都高于氮充足条件下的,而且在第14 d时,两种不同条件处理下的J点的相对可变荧光值都有所升高,但与加入DCMU的缺氮对照组相比要低很多。而加DCMU的缺氮对照组由于阻止了电子从QA-到QB的传递,导致电子在QA-大量堆积,呈现出荧光从O到J点的迅速上升。
(a)第0 d

(b)第14 d图 3 缺氮和氮充足条件下血球藻的快速叶绿素荧光诱导动力学曲线
3讨论
以上相关数据显示,缺氮严重影响血球藻细胞的正常生长与光合作用。N源是血球藻生长所必须的营养物质,在缺氮条件下血球藻的生长速度远小于氮充足条件下,虾青素比干重比值虽增加,但是生物量却增长缓慢,导致单位体积虾青素的增长低于氮充足条件下的值。这一结果与苗凤萍等学者[14]的研究结果基本相同。通过对实验中快速叶绿素荧光动力学曲线的研究,可以发现缺氮对血球藻PSII途径的影响显著。在缺氮条件下,血球藻的光合作用能力明显受到影响,表现在光量子产量和电子传递速率下降等方面。由于缺氮导致藻细胞细胞代谢以及合成捕光色素所需要的酶合成不足,缺氮还会导致藻细胞PSII反应活性中心蛋白合成受阻,从而导致其PSII反应活性中心受到严重损伤[15]。到培养后期,通过分析4种不同的状态,血球藻光合作用能力的下降,表现在Fv/Fm值的下降,而非光化学猝灭NPQ明显上升,说明缺氮条件下血球藻光化学耗散下降,大部分过多的激发能耗散。而在红色孢子细胞中,NPQ值要显著高于绿色游动细胞。正是由于其热耗散能力较高,红色孢子细胞对PSII的光合活性一定程度上起到了保护作用,跟研究报道的类胡萝卜素含量与细胞的生理状态和光化学活性有相关性的报道基本相符[16-17]。
综上所述,缺氮能影响血球藻的PSII光化学反应活性,影响虾青素的产率,本研究为在缺氮条件下血球藻生长规律提供一定的理论依据,为优化生长条件并提高虾青素产率提供相关的参考信息。在后续研究中,将进一步观察在不同胁迫条件下血球藻生长、虾青素积累及叶绿素荧光变化规律的情况。
[参考文献]
[1]庄惠如, 陈文列. 雨生红球藻不同形态细胞的超微结构研究[J]. 应用与环境生物学报, 2001, 7(5): 428-433.
[2]殷明焱, 刘建国. 雨生红球藻和虾青素研究述评[J]. 海洋湖沼通报, 1998(2): 53-62.
[3]张宝玉, 李夜光, 李中奎, 等. 温度, 光照强度和 pH 对雨生红球藻光合作用和生长速率的影响[J]. 海洋与湖沼, 2003, 34(5): 558-565.
[4]王可玢, 赵福洪, 王孝宣, 等. 用体内叶绿素 a 荧光诱导动力学鉴定番茄的抗冷性[J]. 植物学通报, 1996, 13(2): 29-33.
[5]Petkova V, Denev I D, Cholakov D, et al. Field screening for heat tolerant common bean cultivars (Phaseolus vulgaris L.) by measuring of chlorophyll fluorescence induction parameters[J]. Scientia Horticulturae, 2007, 111(2): 101-106.
[6]Rizza F, Pagani D, Stanca A M, et al. Use of chlorophyll fluorescence to evaluate the cold acclimation and freezing tolerance of winter and spring oats[J]. Plant Breeding, 2001, 120(5): 389-396.
[7]金传荫, 宋立荣, 刘永定, 等. 红球藻水生 748 株营养需求的研究[J]. 水生生物学报, 1996, 20(3): 293-296.
[8]Seely G R, Duncan M J, Vidaver W E. Preparative and analytical extraction of pigments from brown algae with dimethyl sulfoxide[J]. Marine Biology, 1972, 12(2): 184-188.
[9]Boussiba S, Fan L, Vonshak A. [36] Enhancement and determination of astaxanthin accumulation in green alga Haematococcus pluvialis[J]. Methods in enzymology, 1992 (213C): 386-391.
[10] Weis E, Berry J A. Quantum efficiency of photosystem II in relation to ‘energy’-dependent quenching of chlorophyll fluorescence[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1987, 894(2): 198-208.
[11] Genty B, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 1989, 990(1): 87-92.
[12] White A J, Critchley C. Rapid light curves: a new fluorescence method to assess the state of the photosynthetic apparatus[J]. Photosynthesis Research, 1999, 59(1): 63-72.
[13] Strasserf R J, Srivastava A. Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J]. Photochemistry and photobiology, 1995, 61(1): 32-42.
[14] 苗凤萍, 李夜光, 耿亚红, 等. 温度对雨生红球藻 (Haematococcus pluvialis) 生物量和虾青素产量的影响[J]. 武汉植物学研究, 2005, 23(1): 73-76.
[15] Petrou K, Kranz S A, Doblin M A, et al. Photophysiological responses of fragilariopsis cylindrus (bacillariophyceae) to nitrogen depletion at two temperatures1[J]. Journal of phycology, 2012, 48(1): 127-136.
[16] 郭卫东, 桑丹, 郑建树, 等. 缺氮对佛手气体交换, 叶绿素荧光及叶绿体超微结构的影响 [J]. 浙江大学学报: 农业与生命科学版, 2009, 35(3): 307-314.
[责任编校: 张众]
Effects of Nitrogen Deficiency on Haematococcus Pluvialis PhotosystemII Photochemical Changes and Changes of Astaxanthin
LI Jinxun1, XU Siyuan2, JIN Wei2
(1InstituteofLightIndustry,HubeiUniv.ofTech.,Wuhan430068,China;2EnvironmentalManagementCollegeofChina,Qinhuangdao066000,China)
Abstract:Haematococcus pluvialis, as a freshwater unicellular green algae, consisting of considerable content of astaxanthin is the mainly natural materials for astaxanthin extraction. In this study, typical Haematococcus pluvialis named 192.80 was chosen to investigate the relationship between the variation of photosystem II (PSII) and the accumulation of astaxanthin under the condition of nitrogen starvation. The results shown that FPSII (Fv/Fm) decreased to the initial of 80%, then increased slowly, while rETR increased up to a maximum value and then decreased. Meanwhile, the results also indicated that either relative content of Chlorophyll, astaxanthin content or cell density under nitrogen starvation condition was significantly lower than that nitrogen sufficiency condition. On the contrary, the radio of astaxanthin and dry weight was obviously improved with the consumption of nitrogen nutrition, which represented the special protection mechanism of Haematococcus pluvialis for the response of nitrogen starvation.
Keywords:Haematococcus pluvialis; astaxanthin; PSII; Fv/Fm; nitrogen starvation
[收稿日期]2015-12-22
[基金项目]科技部863计划(2014AA022000)
[作者简介]李金洵(1989-), 女,湖北石首人,湖北工业大学硕士研究生,研究方向为化学工程与工艺
[文章编号]1003-4684(2016)02-00111-03
[中图分类号]Q945
[文献标识码]:A

