嗜热菌β—葡萄糖苷酶A水解大豆异黄酮的研究
王锐丽
摘 要:该研究将含嗜热乙醇菌β-葡萄糖苷酶A(Te-BglA)基因的重组质粒pET-20b-Te-BglA导入大肠杆菌JM109(DE3)中,经诱导表达和Ni2+亲和层析纯化,将其用于酶解大豆异黄酮,以染料木素的产量为检测指标,通过正交试验优化Te-BglA水解大豆异黄酮的条件。优化结果显示:最佳的水解条件为加酶量70U,温度80℃,水解时间60min,pH值7.4,在此条件下水解100g大豆粉可得到染料木素58.1mg。
关键词:β-葡萄糖苷酶;染料木素;大豆异黄酮糖苷;正交试验
中图分类号 TS201 文献标识码 A 文章编号 1007-7731(2016)18-0026-03
Hydrolysis of Soybean Isoflavone by β- Glucosidases A from Thermoanaerobacter etholicus
Wang Ruili
(Department of Biotechnology and Pharmaceutical Engineering,Xinyang Agriculture and Forestry University,Xinyang 464000,China)
Abstract:To obtain a high stability and efficiency enzyme in the biotransformation of isoflavone glycosides,β-glucosidase A from Thermoanaerobacter ethanolicus(Te-BglA)was over-expressed in Escherichia coli JM109(DE3),and purified by immobilized metal affinity chromatography. The hydrolysis conditions of soybean isoflavone by Te-BglA were by orthogonal test,Results were as follows:enzyme dose 70U,temperature 80℃,time 60min and pH 7.4. Under the optimal condition,the yield of genistein in the hydrolysis of 100g soybean powder was 58.1mg.
Key words:β-glucosidase;Genistein;Soybean isoflavone glucosides;Orthogonal test
大豆异黄酮因具有缓解更年期综合征、抗肿瘤、延缓衰老、抗辐射等功效而成为了国内外的研究热点[1-3],目前研究发现的12种大豆异黄酮主要有游离型苷元和结合型糖苷两种类型,而被人体肠道吸收的是它的苷元形式,糖苷形式必须转化为相应的苷元才能真正发挥药效。大豆异黄酮糖苷水解酶(β-葡萄糖苷酶)水解或相关微生物发酵因条件温和而成为一种理想的转化途径[4-6],目前虽有很多来源细菌或真菌转化大豆异黄酮糖苷β-葡萄糖苷酶的报道,但有关耐热性高效水解糖苷的β-葡萄糖苷酶的报道却很少。耐热性酶在生物转化过程中具有减少污染、加快反应速度、提高底物溶解度及易于大规模生产等优势[7]。本研究利用基因工程方法实现嗜热性β-葡萄糖苷酶A(Te-BglA)在大肠杆菌中的重组表达和纯化,通过正交试验对其酶解大豆粉中大豆异黄酮糖苷作用进行研究,以确定最佳酶解条件,以期为实际生产中提高苷元的产量提供一定的工艺参数。
1 材料与方法
1.1 材料 菌株和质粒:嗜热厌氧乙醇菌JW200(Thermoanaerobacter ethanolicus JW200),由美国佐治亚大学微生物系Wiegel博士分离并赠送。重组质粒pET-20b-Te-BglA由前期研究构建保存。主要试剂:对硝基苯酚-β-葡萄糖苷(pNPG)、染料木素(Genistein,缩写G)、染料木苷(Gensitin,Gin)和大豆黄苷(Daidzin,Din)购自Sigma公司;丙二酰基染料木苷(6-malonyl-gensitin,M-Gin)、大豆黄素(Daidzein,D)、丙二酰基大豆黄苷(6-malonyl-daidzin,M-Din)购自WAKO公司。
1.2 方法
1.2.1 重组酶的表达和纯化 将重组质粒pET-20b-Te-BglA电转化于E.coli JM109(DE3),挑取单菌落接入含Amp抗性的LB培养液中,37℃培养过夜。然后以1.5%接种量接入到含Amp抗性750mL LB培养液中,振荡培养至OD600达0.8左右加入IPTG至浓度0.05mM,继续诱导培养5h后,离心,收集细胞。用Rapid Affinity Purification Kit中的结合缓冲液(Binding Buffer)悬浮细胞,经高压破碎,离心20min,取上清液于70℃下热处理20min,离心得粗酶液。粗酶液再经Ni2+亲和层析纯化,快速提取法按Novagen的产品说明进行,以每1mL收集酶活的峰值部分,以SDS-PAGE凝胶电泳检测纯度。
1.2.2 酶的活性测定 β-葡萄糖苷酶活性由从底物pNPG释放对硝基苯酚(pNP)的量确定,采用分光光度法[7]。一个酶活力单位(U)定义:在一定反应条件下,1min内催化产生1μmol pNP的酶量。大豆异黄酮水解酶活性是从底物Genistin、M-Gin释放出Genstein的量,从底物Daidzin、M-Din释放出Daidzein的量来确定,采用HPLC法[8]分析。条件:Agilent HC-C18,UV detector 260nm;30℃;流动相:A,0.1%的磷酸水溶液,B,乙腈,45min内,A由85%降至65%;流速:0.8mL/min[9]。一个酶活单位(U)定义为在该条件下,1min内催化产生1μmol的苷元类物质(Genstein、Daidzein)所需要的酶量,以峰面积对标准品质量作标准曲线。
1.2.3 大豆粉的酶解实验 称取0.1g脱脂大豆粉,以料液比1∶10溶于pH7.0,250mM的磷酸缓冲液中,加酶量为50U/g(对照为不加酶),然后于80℃分别酶解90min,在冰浴条件下终止反应,离心,收集上清,冷冻干燥。经干燥后的上清干粉与沉淀分别用1mL 80%甲醇重悬,30℃提取2h,离心20min,取上清,经过滤后取20μL进行HPLC分析。异黄酮苷元产量用100g脱脂大豆粉产生的多少毫克(mg)数表示。
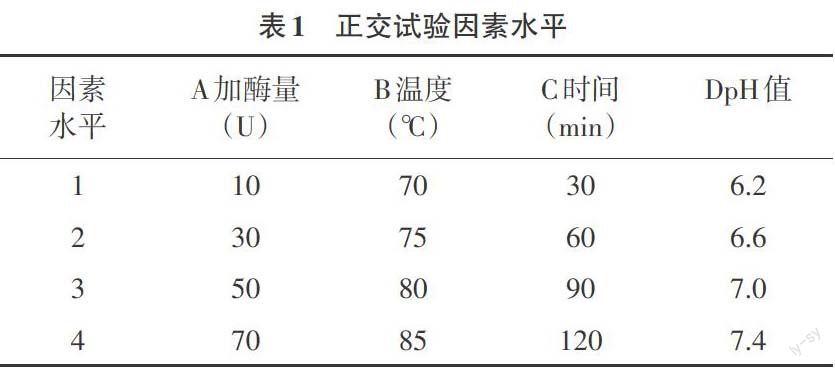
1.2.4 正交试验设计 根据对重组酶Te-BglA酶学性质研究的结果,设计了四因素四水平的正交试验,考察各因素对酶水解的影响。其因素和水平的设计见表1,每组重复3次,以水解后染料木素的产量为检测标准,确定其最佳水解条件。
2 结果与分析
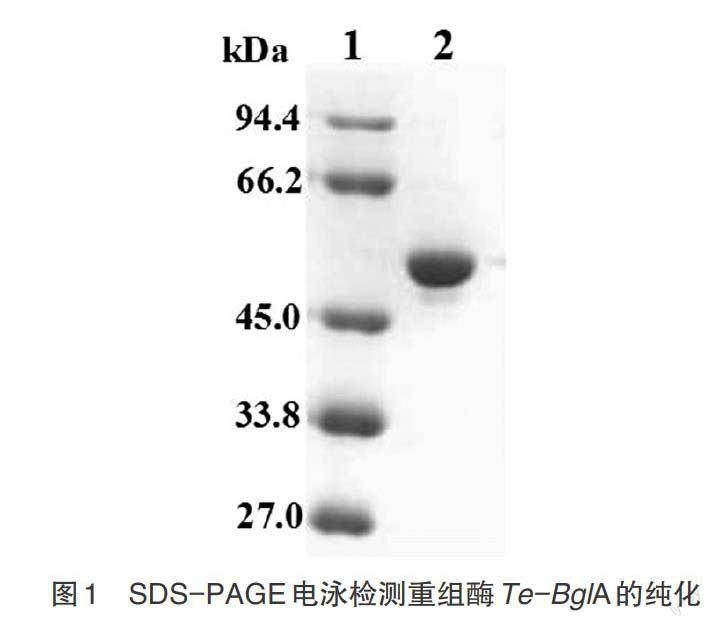
2.1 重组酶的表达和纯化 将重组质粒pET-20b-Te-BglA转化E.coli JM109(DE3),挑取单菌落于液体LB培养基中经IPTG诱导后,收集细菌经高压破碎,上清液经热处理和Ni2+亲和层析两步纯化操作,所得重组酶经SDS-PAGE检测达到电泳均一(图1)。
图1 SDS-PAGE电泳检测重组酶Te-BglA的纯化
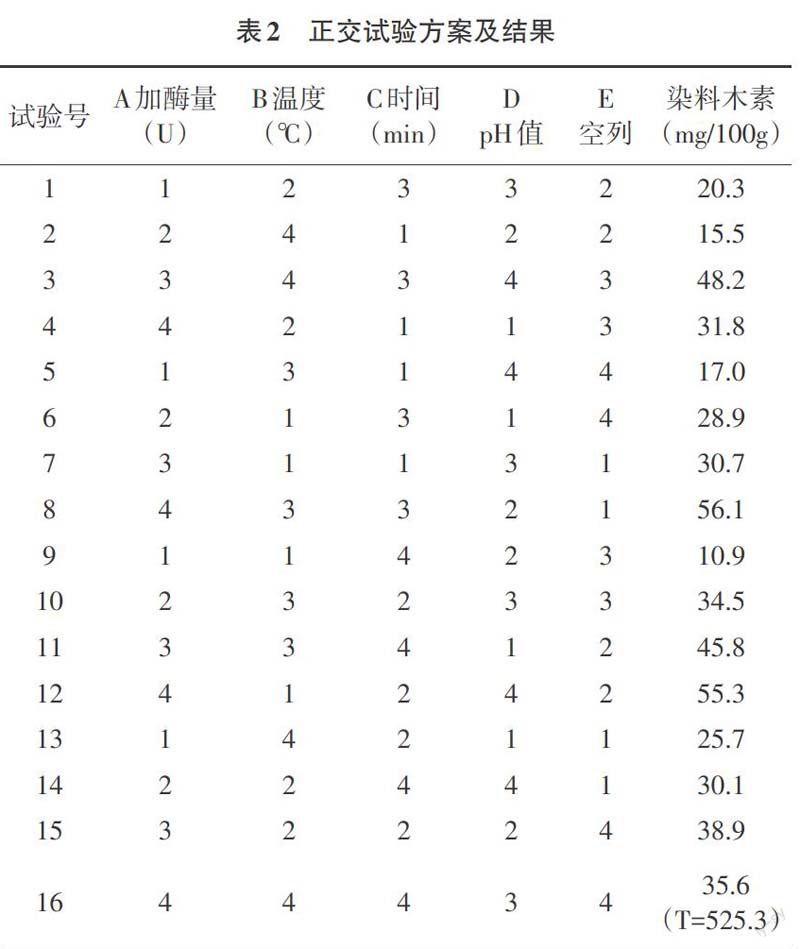
2.2 正交设计结果及分析 根据对加酶量、水解温度、水解时间及pH值进行四因素四水平正交设计,选用L16(45)正交表,并加一空列,作为试验误差以衡量试验的可靠性。其试验方案及结果如表2,结果极差分析如表3,方差分析如表4。由表3和表4可知,影响重组酶Te-BglA水解大豆异黄酮效率的主次因素依次为A(加酶量)>C(时间)>B(温度)>D(pH值)。其中A加酶量对染料木素产量的影响最显著,其次是水解时间。由极差分析表3可知,最佳水解条件的组合为A4B3C2D4,即加酶量70U,温度80℃,水解时间60min,pH值7.4。
2.3 验证试验 以组合A4B3C2D4为水解条件时,3次重复验证试验所得100g大豆粉中染料木素的产量为58.1mg,大于正交试验方案的最大值55.3mg,因此可以证明,A4B3C2D4即加酶量70U,温度80℃,水解时间60min,pH值7.4是嗜热性β-葡萄糖苷酶A水解大豆异黄酮的最佳条件。
3 结论
本研究将含嗜热乙醇菌β-葡萄糖苷酶A(Te-BglA)基因的重组质粒pET-20b-Te-BglA导入大肠杆菌JM109(DE3)中,经诱导表达和Ni2+亲和层析纯化,将其用于酶解大豆异黄酮糖苷。糖苷形式的大豆异黄酮不具有最佳的生理活性状态,须在大豆异黄酮糖苷酶的作用下转化成苷元形式才能被吸收而发挥药效[10,11]。为获得更多的苷元产物,以染料木素为检测目标,本研究通过优化酶解的条件,以提高β-葡萄糖苷酶A水解效率,通过正交试验最终确定最佳的水解条件为加酶量70U,温度80℃,水解时间60min,pH值7.4,在此条件下染料木素的产量达到58.1mg。
参考文献
[1]Wada K,Nakamura K,Tamai Y,et al.Soy isoflavone intake and breast cancer risk in Japan:From the Takayama study[J].Int J Cancer,2013,133(4):952-960.
[2]Lima F S,Idae I.Optimisation of soybean hydrothermal treatment for the conversion of β-glucoside isoflavones to aglycones[J].Food Science and Technology,2014,56(2):232-239.
[3]翟清燕.高产游离型大豆异黄酮乳酸菌的筛选鉴定及其在发酵豆乳中的应用[D].泰安:山东农业大学,2014.
[4]Yeom S J,Kim B N,Kim Y S,et al.Hydrolysis of isoflavone glycosides by a thermostable β-glucosidase from Pyrococcus furiosus[J].J Agric Food Chem,2012,60(6):1535-1541.
[5]孙正博,吴周和,董青,等.大豆异黄酮β-葡萄糖苷酶产生菌的选育及产酶条件研究[J].中国酿造,2006,5:7-11.
[6]Kim B N,Yeom S J,Kim Y S.Characterization of a β-glucosidase from Sulfolobus solfataricus for isoflavone glycosides[J].Biotechnology Letters,2011,34(1):125-129.
[7]Xue Y M,Yu J J,Song X F.Hydrolysis of soy isoflavone glycosides by recombinant β-glucosidase from hyperthermophile Thermotoga maritima[J].Journal of Industrial Microbiology & Biotechnology,2009,36(11):1401-1408.
[8]Xue Y M,Song X F,Yu J J.Overexpression of β-glucosidase from Thermotoga maritima for the production of highly purified aglycone isoflavones from soy flour[J].World Journal of Microbiology and Biotechnology,2009,25(12):2165-2172.
[9]Chuankhayan P,Rimlumduan T,Svasti J,et al.Hydrolysis of soybean isoflavonoid glycosides by Dalbergia β-glucosidase[J].J Agric Food Chem,2007,55(6):2407-2412.
[10]Ismail B,Hayes K. β-Glycosidase activity toward different glycosidic forms of isoflavones[J].J Agric Food Chem,2005,53(12):4918-4924.
[11]Maitan-alfenas G P,Alage L G,Almerida M,et al.Hydrolysis of soybean isoflavones by Debaryomyces hansenii UFV-1 immobilised cells and free β-glucosidase[J].Food Chemistry,2014,146:429-436.

