真菌粗酶制剂脱氢酶活性测定条件的优化
马 鑫,高 卉,张俊会,薛泉宏
(西北农林科技大学 资源环境学院,陕西 杨凌 712100)
真菌粗酶制剂脱氢酶活性测定条件的优化
马鑫,高卉,张俊会,薛泉宏
(西北农林科技大学 资源环境学院,陕西 杨凌 712100)
[摘要]【目的】 探究酶液制备及测定条件对真菌粗酶制剂脱氢酶活性的影响,确定真菌粗酶制剂脱氢酶活性测定方法。【方法】 采用氯化三苯基四氮唑(TTC)还原法测定真菌粗酶制剂的脱氢酶活性,分析粗酶制剂与去离子水质量比、活化时间、活化温度、振荡速率、搅拌时间、固液分离方法、活化剂种类、过滤介质及显色时间对脱氢酶活性的影响。【结果】 ①真菌粗酶制剂活化、分离方式及显色时间对真菌粗酶制剂脱氢酶活性测定有明显影响。②确定真菌粗酶制剂脱氢酶活性测定优化方法为:将粗酶制剂与去离子水按照质量比1∶40装入三角瓶,在28 ℃、120 r/min恒温摇床中振荡15 h,用快速滤纸过滤获得酶液;将酶液与TTC-葡萄糖溶液混匀,在40 ℃恒温水浴锅中反应显色,待反应液出现红色后计时,维持90 min完成显色反应,取出后加乙酸乙酯充分摇匀,4 ℃冰箱中静置5~6 h,取上层澄清有机相在波长485 nm比色,根据标准曲线计算脱氢酶活性。【结论】 获得了测定真菌粗酶制剂脱氢酶活性的测定方法。
[关键词]TTC还原法;脱氢酶;真菌;粗酶制剂
脱氢酶(Dehydrogenase)是活细胞合成的用于有机物氧化的必需酶类。脱氢酶活性(Dehydrogenase activity,DHA)与活细胞数量及其生理代谢活性密切相关[1]。故常用DHA表示植物种子与根系活力[2]、微生物细胞数量与活力[3]及活性污泥等沉积体中的生物数量与活性[4]。氯化三苯基四氮唑(TTC)还原法[5]是测定DHA的常用方法之一,目前主要用于植物种子[6]活性鉴定,细菌[7]、藻类[8]及活性污泥[4]等材料中活细胞数量与生理活性测定,尚无用于真菌粗酶制剂DHA测定的报道。真菌粗酶制剂是产酶真菌的固态发酵产物,其烘干粉碎制品中含有真菌菌体、真菌合成的纤维素酶、蛋白酶及糖化酶等胞外酶,这些真菌粗酶制剂或纯酶制剂均有通用的测定方法[9]或国标方法[10-11],但目前尚无利用真菌固态发酵生产脱氢酶粗酶制剂的研究报道,更无测定真菌粗酶制剂DHA的方法。TTC还原法虽然比色方法成熟,但待测液因供试材料差异大无法用同一方法制备,现有的用于活细胞数及代谢活性测定的待测液制备法,无法直接用于真菌粗酶制剂DHA测定。鉴于真菌脱氢酶对有机污染物降解及环境修复的重要作用[12],探索真菌脱氢酶粗酶制剂的酶液制备方法及条件,建立真菌粗酶制剂DHA测定方法,对真菌粗酶制剂DHA理论研究与应用均有重要意义。本试验研究酶液制备及测定条件对真菌粗酶制剂DHA测定值的影响,旨在建立真菌粗酶制剂DHA测定方法。
1材料与方法
1.1材料
1.1.1供试真菌米曲霉(Aspergillusoryzae)由西北农林科技大学资源环境学院微生物资源研究室提供,是该研究室通过脱氢酶测定从保存的丝状真菌中筛选出的脱氢酶活性较高的菌种,用于真菌粗酶制剂脱氢酶活性测定方法优化研究,可代表霉菌类产酶真菌。
1.1.2真菌固态培养基小麦麸皮与无机盐溶液(KNO35 g/L,KH2PO41 g/L,MgSO40.5 g/L)按质量比10∶8拌匀。称取60 g真菌固态培养基装入600 mL组培瓶,121 ℃高温湿热灭菌30 min。
1.1.3TTC-葡萄糖溶液称取0.1 g TTC与1.0 g葡萄糖溶于100 mL蒸馏水中,避光、4 ℃保存。
1.1.4Tris-HCl缓冲液称取6.037 g Tris,溶于20 mL 1.0 mol/L HCl,定容至1 L,其pH为8.0。
1.1.5乙酸乙酯与硫化钠均为分析纯,其中硫化钠溶液质量浓度为100 g/L。
1.2方法
1.2.1标准曲线制作采用赵连梅等[13]的方法制作标准曲线。还原剂为硫化钠新配溶液[14],参照尹军等[15]的方法,萃取剂为乙酸乙酯,比色波长为485 nm。TTC比色法标准曲线制作方法如下:称取50 mg烘干的TTC溶于去离子水中,50 mL棕色容量瓶中定容,即为1 mg/mL TTC标准溶液;分别从1 mg/mL TTC标准溶液中吸取1,2,3,4,5,6,7 mL加入50 mL棕色容量瓶中,用去离子水定容,即得20,40,60,80,100,120,140 μg/mL不同质量浓度的TTC标准溶液。取8支25 mL具塞刻度试管,其中1支加入去离子水1 mL为空白对照,其余7支分别加入20,40,60,80,100,120,140 μg/mL TTC标准系列溶液1 mL,再依次加入Tris-HCl缓冲液2 mL,100 g/L Na2S新配溶液1 mL,去离子水1 mL摇匀后,40 ℃水浴中放置20 min,使其充分反应。再加入乙酸乙酯5 mL,充分摇匀,稳定20 min,使其充分分层,取上层有机相溶液在722型分光光度计485 nm处比色,以空白对照调零点,测定其吸光度(A485)并绘制标准曲线,获得高质量浓度系列标准曲线;另取8支25 mL具塞刻度试管,其中1支加入去离子水1 mL为空白对照,其余7支依次加入20,40,60,80,100,120,140 μg/mL TTC标准系列溶液0.5 mL及去离子水0.5 mL,以同样方法进行显色、比色,测定其吸光度(A485)并绘制标准曲线,获得低质量浓度系列标准曲线。
1.2.2粗酶制剂的制备将供试真菌菌种接入 1.1.2 节的真菌固态培养基,28 ℃静置培养3~4 d,待菌丝布满基质并开始产生孢子时取出,40 ℃烘干,粉碎装袋,低温保存备用。
1.2.3DHA影响因素研究(1) 粗酶制剂与去离子水质量比。 将粗酶制剂与去离子水按照质量比1∶20,1∶40,1∶60分别装入100 mL三角瓶,在25 ℃下120 r/min振荡10 h后,采用快速滤纸过滤进行固液分离获得酶液。
(2) 提取及活化时间。 粗酶制剂与去离子水按照质量比1∶40配制,在25 ℃下120 r/min分别振荡0,12,15,18,21,24及48 h,采用快速滤纸过滤进行固液分离获得酶液。
(3) 活化温度和振荡速率。 粗酶制剂与去离子水按照质量比1∶40配制,分别置于20,37,45 ℃恒温摇床振荡活化15 h,振荡速率分别为0,120,220 r/min,振荡结束后采用快速滤纸过滤进行固液分离获得酶液。
(4) 搅拌时间。粗酶制剂与去离子水按照质量比1∶40配制,分别置于25 ℃恒温摇床振荡活化15 h后,于4 000 r/min搅拌0,2,4,6 min,采用快速滤纸过滤进行固液分离后获得酶液。
(5) 活化剂种类、固液分离方法及过滤介质。将粗酶制剂分别与去离子水和pH为8.0的Tris-HCl缓冲液按照质量比1∶40配制,置于25 ℃恒温摇床振荡活化15 h后,并分别采用4 000 r/min离心5 min、过滤及2种方式相结合将酶液与固相残渣分离,获得酶液。研究过滤介质分别为快速滤纸、慢速滤纸及脱脂棉时DHA的变化,具体方法为:选用口径约8 cm的锥形漏斗,分别铺上快速滤纸、慢速滤纸及0.8 g脱脂棉,倒入活化后液体并开始计时,直至全部过滤结束停止计时,将滤液摇匀后作为待测酶液。
1.2.4DHA测定采用TTC还原法[16]。取25 mL具塞刻度试管若干支,依次加入2 mL Tris-HCl缓冲液,2 mL TTC-葡萄糖溶液,1 mL粗酶制剂酶液。置40 ℃恒温水浴反应2 h后取出,加5 mL乙酸乙酯,剧烈振荡混匀,在4 ℃冰箱中静置5~6 h,取上层有机相萃取液于485 nm处比色。
显色时间的确定:从试管放入40 ℃恒温水浴后25 min开始,每10 min取样1次,直至显色时间达115 min结束,每次重复3管,每管加5 mL乙酸乙酯萃取后比色,计算DHA,求出最佳显色时间。
DHA单位及计算:依1.2.4节的测定方法,将1 g粗酶制剂1 min产生1 μg三苯基甲臜(TF)的脱氢酶活性定义为1个酶活单位,用1 U表示,即1 U=1 μg/(g·min)。DHA按下式计算:
式中:DHA为真菌脱氢酶活性(U),C为利用标准曲线回归方程计算得到的TF质量浓度值(μg/mL),V为萃取剂乙酸乙酯用量(mL),k为粗酶制剂活化时的稀释倍数,t为显色时间(min),m为粗酶制剂质量(g)。
处理增率(Δ)=(某处理DHA测定值-参照处理DHA测定值)÷ 参照处理DHA测定值×100%。
式中:参照处理表示某低水平处理或对照。
2结果与分析
2.1测定真菌粗酶制剂DHA时的标准曲线
从图1可以看出,根据1.2.1节方法获得的高质量浓度系列标准曲线和低质量浓度系列标准曲线的吸光度分别为0.1~1.2和0.05~0.6;2条标准曲线均具有良好的线性关系,其决定系数(R2)分别为0.997 8和0.995 2,TF吸光度(A485)与TTC质量浓度的相关性均达到极显著水平(P<0.01)。根据比尔-朗伯定律,吸光度在0.2~0.8时,读数误差较小,最佳比色度为0.4左右。故在测定DHA时应尽量将吸光度(A485)控制在0.4左右。

图 1 TTC质量浓度与其反应产物TF吸光度(A485)标准曲线
2.2真菌粗酶制剂DHA的影响因素
2.2.1粗酶制剂与去离子水的质量比从表1可见,粗酶制剂提取及活化时,粗酶制剂与去离子水的质量比对DHA有极显著影响(P<0.01)。其中粗酶制剂与去离子水按质量比1∶40提取及活化时DHA最高,达123.6 U,其次为质量比1∶60的处理,以上二者的DHA分别较质量比1∶20处理多2.4和1.8倍。可知粗酶制剂与去离子水质量比以1∶40为宜。
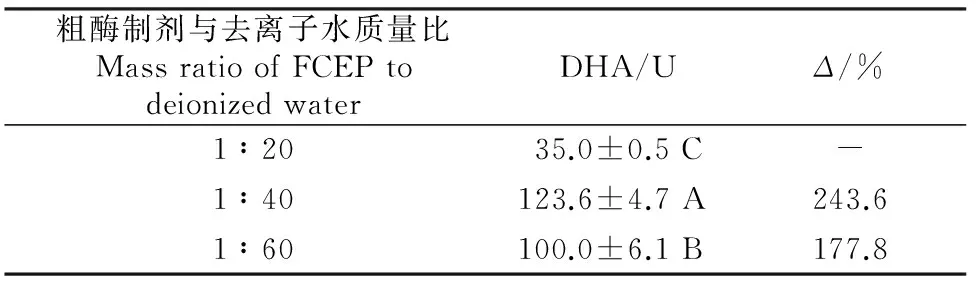
表 1 粗酶制剂与去离子水质量比对
注:同列数据后标不同大写字母者表示差异极显著(P<0.01)。下表同。
Note:Different uppercase letters stand for significant difference atP<0.01.The same below.
2.2.2提取及活化时间从图2可见,随着提取及活化时间延长,粗酶制剂的DHA呈先增高后降低的趋势。当提取及活化时间为0~15 h时DHA逐渐增高,15 h时达到峰值,为87.1 U;15~24 h时DHA迅速降低,至24 h时达到最低,为1.1 U;24~48 h,DHA很低且基本保持不变。由此可知15 h是粗酶制剂活化的最佳时间。

图 2 粗酶制剂活化时间对真菌粗酶制剂DHA的影响
2.2.3活化温度和振荡速率由表2可知,活化温度对DHA有极显著影响(P<0.01)。活化温度为45 ℃时的DHA较20 ℃时降低了68.4 %(P<0.01);37 ℃时与20 ℃无显著差异。说明活化温度较高对脱氢酶的破坏作用明显,20~37 ℃是活化适宜温度,为方便实际操作,可选择更接近室温的28 ℃作为最佳活化温度。
从表2还可以看出,提取及活化时的振荡速率对DHA影响也极显著(P<0.01)。当振荡速率为120 r/min时DHA最高,为24.3 U,较静置对照(0 r/min)的DHA提高了125.8%,两者差异达到极显著水平(P<0.01);而在220 r/min条件下DHA较静置对照(0 r/min)降低20.4%。可知120 r/min是真菌粗酶制剂中脱氢酶酶蛋白活化的最佳振荡速率。

表 2 活化温度和振荡速率对真菌粗酶制剂DHA的影响
2.2.4搅拌时间搅拌的目的是通过物理作用使附着在固态发酵基质上的酶蛋白脱离基质表面进入液相,提高酶液中游离酶蛋白数量,进而提高酶液的DHA。由表3可知,将活化至一定时间的真菌粗酶制剂与去离子水形成的糊状液体置于转速为 4 000 r/min 的搅拌机内处理0,2,4,6 min,随着搅拌时间的增加,DHA降低;搅拌2 min处理的DHA较未搅拌处理(0 min)降低了14.7%,但是二者差异不显著;但搅拌4,6 min处理的DHA分别较未搅拌处理(0 min)降低40.1%,66.6%,差异均达到极显著水平(P<0.01)。表明快速搅拌可大幅度降低DHA,这可能是高速物理搅拌破坏了脱氢酶结构,导致DHA降低,故活化一定时间的真菌粗酶制剂不需要搅拌。

表 3 搅拌时间对真菌粗酶制剂DHA的影响
2.2.5活化剂种类及分离方式由表4可知,活化剂种类对真菌粗酶制剂DHA有较大影响。其中用过滤法分离时,用去离子水、pH 8.0 Tris-HCl缓冲液为提取及活化剂时,供试粗酶制剂的DHA分别为161.8和59.2 U,去离子水为提取及活化剂时的DHA是pH 8.0 Tris-HCl缓冲液为活化剂时的 2.7 倍,二者的差异达到极显著水平(P<0.01);用离心法及离心+过滤法分离时,2种提取及活化剂处理的DHA均极显著降低。
由表4还可知,固液分离方式对供试粗酶制剂DHA影响很大。以去离子水为提取及活化剂时,过滤法与离心分离法和离心+过滤分离法获得酶液的DHA差异达到极显著水平(P<0.01),过滤分离法获得的酶液DHA分别为离心法和离心+过滤分离法的5.1和5.0倍。当以pH 8.0 Tris-HCl缓冲液为提取及活化剂时,DHA变化也呈类似趋势。由以上分析可知,以去离子水为活化剂且采用过滤方式进行固液分离时测定的DHA效果较佳。

表 4 提取及活化剂种类和分离方式对真菌粗酶制剂DHA的影响
2.2.6过滤介质由表5可知,过滤介质对DHA的影响极显著(P<0.01)。以脱脂棉为过滤介质时,供试粗酶制剂的DHA为459.2 U,分别为快速滤纸、慢速滤纸处理的2.8和32.1倍。但脱脂棉过滤后,滤液混浊易沉淀,且TTC的反应产物TF较多,乙酸乙酯萃取困难,且对TF的萃取不完全,导致DHA测定结果变异较大。而快速滤纸过滤后滤液较清亮,乙酸乙酯对TF萃取完全,DHA的测定结果较稳定。此外,快速滤纸过滤速度也较快,所用时间仅为20 min,因此选用快速滤纸作为真菌粗酶制剂DHA测定的最佳过滤介质。

表 5 过滤介质对真菌粗酶制剂DHA的影响
2.2.7显色反应时间显色反应时间对真菌粗酶制剂DHA的影响结果见图3。

图 3 显色反应时间对真菌粗酶制剂DHA的影响
由图3可知,当显色时间为25~45 min时,随着显色反应时间增加DHA呈先升后降趋势;45 min后DHA呈缓慢上升趋势,至85~95 min,DHA达到峰值;之后DHA呈快速下降趋势。为测得最大DHA,应从反应体系出现可见红色后计时,维持至90 min后终止显色反应。
2.3真菌粗酶制剂DHA的测定方法
根据以上测定结果,可建立真菌粗酶制剂DHA的测定方法:将粗酶制剂与去离子水按照质量比 1∶40 装入三角瓶,在28 ℃、120 r/min恒温摇床中振荡提取并活化15 h,用快速滤纸过滤获得待测酶液;将酶液与TTC-葡萄糖液混匀后在40 ℃恒温水浴锅中显色,待反应液出现红色后计时,维持90 min,取出后加乙酸乙酯充分摇匀,4 ℃冰箱中静置5~6 h,取上层澄清有机相在波长485 nm比色,根据标准曲线计算反应产物TF的质量浓度及其对应DHA。
3讨论
本研究发现,提取时的活化过程对真菌粗酶制剂DHA影响很大,不能采用纤维素酶等真菌酶制剂的直接提取法[17]制备待测液。其原因是直接用干酶粉加水提取获得的酶液测定的DHA值很低;将酶液在4 ℃冰箱放置一定时间后活性提高,且提高幅度随放置时间延长而增大。在4 ℃微生物生长代谢及由此产生的酶活性提高可忽略不计。由此发现,酶液在低温下放置可提高DHA,并由此推测DHA提高是酶蛋白胶体充分吸水后水化程度提高的结果,其原因在于真菌固态发酵制备的脱氢酶粗酶制剂干燥后,酶蛋白脱水失去或降低了催化活性,进而提出了对真菌粗酶制剂中酶蛋白进行活化的思路:将粗酶粉与去离子水按照质量比1∶40装入100 mL三角瓶,在28 ℃下恒温振荡15 h后固液分离获得酶液。在此条件下,去离子水不能提供真菌生长所需营养,仅靠粗酶粉中的残留营养,即使真菌孢子萌发也难以良好生长并合成大量胞外酶蛋白,故活化后测得的DHA应以粗酶粉中的脱氢酶为主。粗酶制剂活化预处理后DHA提高的主要原因有:粗酶制剂中的酶蛋白从干燥脱水无活性状态通过吸水转化为水化状态,恢复催化活性;通过摇床振荡使酶蛋白从固态发酵原料麸皮等固相基质表面脱离进入液相,成为游离态有催化活性的酶蛋白。通过上述活化处理获得的酶液DHA可代表真菌粗酶制剂进行催化反应时的真实活性。
本研究还发现,酶液提取时的活化条件对DHA测定结果影响很大。首先,粗酶制剂与去离子水的质量比影响DHA,且以1∶40时较合适,该比例可以使干燥的酶蛋白获得充足的水分恢复催化活性。其次,活化时间应控制在15 h左右。在15 h内,DHA随着活化时间的增加逐渐提高;时间过短(<15 h),酶蛋白不能充分吸水活化;时间过长(>15 h),DHA迅速降低,这可能与粗酶制剂中杂质蛋白酶对脱氢酶的水解作用等有关。第三,在20~37 ℃均可获得较好的活化效果。第四,活化时振荡速率为120 r/min较合适。因为振荡速率过快会破坏脱氢酶的三维结构,而静置活化时酶蛋白活化不充分,在这2种情况下DHA测定结果均较低。第五,强烈搅拌会降低真菌酶制剂的DHA值。酶蛋白吸水活化之后,仍有大量酶蛋白附着在粗酶制剂的杂质颗粒上,采用物理搅拌的目的是将酶蛋白从固体颗粒上剥离下来。但本试验发现,快速物理搅拌可使DHA降低,由此可知,脱氢酶三维结构复杂,易在物理作用下破坏失活,故应避免用强烈机械搅拌处理活化后的酶液,以减少对酶蛋白结构的物理破坏。第六,用去离子水作活化剂时DHA较高。周春生等[18]在活性污泥的前处理中发现,纯水的处理效果优于生理盐水,并推测可能与生理盐水中大量Cl-不利于有机物脱氢反应有关,使形成的红色物质TF较少。本研究还发现,不同分离方式对DHA影响很大。用脱脂棉过滤时DHA很高,而快速滤纸过滤时DHA相对较低,表明大量的脱氢酶蛋白能通过滤孔较大的脱脂棉进入酶液,而有部分脱氢酶不能通过快速滤纸。但快速滤纸过滤后的滤液清亮,适合显色反应,且DHA测定结果稳定。故快速滤纸过滤是测定真菌粗酶制剂DHA的较好分离方法。但由于脱脂棉的过滤速度快、时间短、滤液DHA高,在实际应用中可选用脱脂棉作过滤介质,以减少脱氢酶的过滤损失,防止过滤引起的酶液DHA大幅度下降,提高酶促反应时脱氢酶的催化效率。此外,粗酶制剂中存在的杂质会影响反应体系中TF萃取及比色结果,用4 000 r/min离心分离酶液时,可使大量酶蛋白吸附在杂质上沉降到离心管底部,导致离心液的DHA大幅度下降。
关于显色时间,齐鲁青等[19]认为,考虑到生物活性测定的快速和简便性,比色时应控制吸光度在0.4左右,故选择4 h作为显色反应时间。周恢等[20]则认为,显色2 h时的反应产物TF已便于检出。黄春花等[21]认为,TTC不易扩散进入真菌细胞,反应时间应控制在3 h。这些研究仅根据吸光度需要控制显色时间,未充分考虑不同样品DHA的巨大差异及酶促反应的完全程度。在酶促反应不完全的情况下,所得结果不能反映真正的脱氢酶活性。本研究发现,真菌粗酶制剂DHA差异很大,显色速度相差甚远,仅以限定显色反应时间无法满足不同酶制剂DHA测定需要。对DHA很高的酶制剂而言,在确定时间内,脱氢反应产生的TF过多,萃取剂萃取不完全;对DHA很低的酶制剂而言,在确定时间内产生的TF过少,吸光度值很低,影响比色准确度。故不能仅通过确定显色反应时间控制比色液的吸光度。
本研究认为,要获得适宜的吸光度和准确的测定结果,首先要将酶液稀释到适宜的质量浓度。其次,要让酶促反应达到较完全的程度,即在显色反应中,红色基本稳定、颜色不再增加为止。达到上述目标的具体方法如下:如显色反应很快、显色液颜色很深,表明待测酶液DHA强,在后续处理中会出现萃取不完全,吸光度过大,测定结果不准确的问题。此时,应先将酶液稀释至适当质量浓度后再测定DHA;若显色反应很慢、显色液颜色很浅,表示待测酶液DHA弱,可降低酶液的稀释倍数或将反应体系中酶液量加大后再显色测定。通过上述途径可将待测液的吸光度值控制在0.4左右,既能确保脱氢反应产生的TF萃取完全,又能使比色时的吸光度值处于合理范围。在酶液质量浓度调整到适当稀释倍数时,显色时间用下述方法确定:在反应体系出现红色时计时,再维持90 min结束显色反应,冷却静置后比色。
本研究还发现,不同条件下制备的真菌粗酶制剂待测液的DHA差异很大,表明酶液制备条件对真菌粗酶制剂DHA有强烈影响;制备条件不同,所测DHA的值无可比性。因此,必须规范真菌粗酶制剂待测液制备方法,其测定值才具有可比性。
[参考文献]
[1]Stentelaire C,Antoine N,Cabrol C,et al.Development of a rapid and highly sensitive biochemical method for the measurement of fungal spore viability an alternative to the CFU method [J].Enzyme and Microbial Technology,2001,29:560-566.
[2]Duncan D R,Widholm J M.Osmotic induced stimulation of the reduction of the viability dye 2,3,5-triphenyltetrazolium chloride by maize roots and callus cultures [J].Journal of Plant Physiology,2004,161:397-403.
[3]刘伯宁,乔长晟,贾士儒.一种丝状真菌活细胞生物量测定方法的研究 [J].药物生物技术,2006,13(1):40-44.
Liu B N,Qiao C S,Jia S R.Studies on the method for the measurement of fungal biomass [J].Pharmaceutical Biotechnology,2006,13(1):40-44.(in Chinese)
[4]陈翔.脱氢酶在环境监测中的应用概况 [J].解放军预防医学杂志,1997,15(6):71-74.
Chen X.Application of dehydrogenase in environmental monitoring [J].Medical Journal of Chinese People’s Liberation Army,1997,15(6):71-74.(in Chinese)
[5]解军,祁峰,裴海燕,等.脱氢酶活性检测方法及其在环境监测中的应用 [J].中国环境监测,2006,22(5):13-18.
Xie J,Qi F,Pei H Y,et al.Determining method of dehydrogenase activity and its application in environmental monitoring [J].Environmental Monitoring in China,2006,22(5):13-18.(in Chinese)
[6]宋学之,陈青度,王东馥,等.林木种子脱氢酶活性的测定方法 [J].植物生理学通讯,1981(5):38-40.
Song X Z,Chen Q D,Wang D F,et al.Method for determination of dehydrogenase activity of seeds of trees [J].Plant Physiology Communications,1981(5):38-40.(in Chinese)
[7]张良,杨云龙.TTC-脱氢酶活性测定法筛选焦化废水优势菌 [J].山西建筑,2008,34(8):202-203.
Zhang L,Yang Y L.The application of method for measurement of TTC-dehydrogenase activity in dominant bacteria screening of coal coking waste water [J].Shanxi Architecture,2008,34(8):202-203.(in Chinese)
[8]梁文艳,王珂,阮清鸳,等.TTC-脱氢酶还原法测定铜绿微囊藻活性 [J].环境科学学报,2008,28(9):1745-1750.
Liang W Y,Wang K,Ruan Q Y,et al.Viability determination ofMicrocystisaeruginosaby TTC-dehydrogenase assay [J].Acta Scientiae Circumstantiae,2008,28(9):1745-1750.(in Chinese)
[9]缪素娜,邓少雅,谭丽贤,等.一种测定酱油曲中蛋白酶活力方法研究 [J].中国酿造,2014(2):37-41.
Miao S N,Deng S Y,Tan L X,et al.Determination method of protease activity in soy sauce koji [J].China Brewing,2014(2):37-41.(in Chinese)
[10]赵玉萍,杨娟.四种纤维素酶酶活测定方法的比较 [J].食品研究与开发,2006(3):116-118.
Zhao Y P,Yang J.Comparison of four cellulase activity measurement methods [J].Food Research and Development,2006(3):116-118.(in Chinese)
[11]白利涛,张丽萍.糖化酶活力测定方法研究 [J].酿酒科技,2012(2):100-102.
Bai L T,Zhang L P.Study on the determination of glucoamylase activity of enzyme [J].Liquor-Making Science & Technology,2012(2):100-102.(in Chinese)
[12]Beatriz Moreno,Astrid Vivas,Rogelio Nogales,et al.Restoring biochemical activity and bacterial diversity in a trichloroethylene-contaminated soil:The reclamation effect of vermicomposted olive wastes [J].Environmental Science and Pollution Research,2009,16(3):253-264.
[13]赵连梅,池勇志,张春青.TTC-脱氢酶活性测定中标准曲线的影响因素研究 [J].实验室科学,2009(4):72-74.
Zhao L M,Chi Y Z,Zhang C Q.Study on influencing factors for standard curve of TTC-dehydrogenase activity measurement [J].Laboratory Science,2009(4):72-74.(in Chinese)
[14]朱南文,闵航,陈美慈,等.TTC-脱氢酶测定方法的探讨 [J].中国沼气,1996,14(2):3-5.
Zhu N W,Min H,Chen M C,et al.The study of determination on TTC-dehydrogenase activity [J].China Biogas,1996,14(2):3-5.(in Chinese)
[15]尹军,谭学军,张立国,等.测定脱氢酶活性的萃取剂选择 [J].中国给水排水,2004,20(7):96-98.
Yin J,Tan X J,Zhang L G,et al.Extractant selection in measuring activity of dehydrogenase [J].China Water & Waste-water,2004,20(7):96-98.(in Chinese)
[16]顿咪娜,胡文容,裴海燕,等.脱氢酶活性检测方法及应用 [J].工业水处理,2008,28(10):1-4.
Dun M N,Hu W R,Pei H Y,et al.Determination of dehydrogenase activity and its application [J].Industrial Water Treatment,2008,28(10):1-4.(in Chinese)
[17]程抒劼,郑兰娟,林俊芳,等.纤维素酶活力测定研究进展 [J].食品工业科技,2009(7):334-336,342.
Cheng S J,Zheng L J,Lin J F,et al.Research progress of determination of cellulose activity [J].Science and Technology of Food Industry,2009(7):334-336,342.(in Chinese)
[18]周春生,尹军.TTC-脱氢酶活性检测方法的研究 [J].环境科学学报,1996,16(4):400-405.
Zhou C S,Yin J.A method for measurement of TTC-dehydrogenase activity [J].Acta Scientiae Circumstantiae,1996,16(4):400-405.(in Chinese)
[19]齐鲁青,汪晓军,詹德明.优化TTC-脱氢酶还原法测定陶粒负载微生物活性 [J].现代化工,2012,32(3):93-96.
Qi L Q,Wang X J,Zhan D M.Study on determination of biofilm activity in BAF by TTC-dehydrogenase assay [J].Modern Chemical Industry,2012,32(3):93-96.(in Chinese)
[20]周恢,左永生,赵怀颖,等.MBR中污泥脱氢酶活性测定方法的改进 [J].中国环保产业,2006(12):31-33.
Zhou H,Zuo Y S,Zhao H Y,et al.Improvement of determination on sludge dehydrogenase activity in MBR [J].China Environmental Protection Industry,2006(12):31-33.(in Chinese)
[21]黄春花,郑壮丽,梅彩英,等.蛹虫草TTC-脱氢酶测定方法的优化 [J].环境昆虫学报,2011,33(3):321-328.
Huang C H,Zheng Z L,Mei C Y,et al.The optimization of TTC-dehydrogenase assay inCordycepsmilitaris[J].Journal of Environmental Entomology,2011,33(3):321-328.(in Chinese)
Optimization of determination method for dehydrogenase activity of crude enzyme preparation from fungi
MA Xin,GAO Hui,ZHANG Jun-hui,XUE Quan-hong
(CollageofNaturalResourceandEnvironment,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 The study explored the influencing factors on dehydrogenase activity of enzyme preparation from fungi to determine the test method.【Method】 Triphenyltetrazolium chloride (TTC)-reduction method was used to assay the dehydrogenase activity of fungal crude enzyme and analyze the effect of mass ratio of crude enzyme preparation to deionized water,activation time,activation temperature, oscillation rate,stirring time,solid-liquid separation method,activation agent,filter medium,and chromogenic time on dehydrogenase activity.【Result】 ①Activation,separation method and color reaction time had significant influence on dehydrogenase activity.②The measurement method of dehydrogenase activity was determined.Crude enzyme and deionized water were mixed at the mass ratio of 1∶40 in the triangle bottle before being shaken with oscillation rate of 120 r/min at 28 ℃ for 15 h.Then rapid filter paper was used to separate mixture and enzyme solution and TTC-glucose reacted in thermostatic water bath at 40 ℃.As the reaction mixture became reddish,it was maintained for 90 min before 5 mL CH3COOC2H5 was added.Finally,it was put into 4 ℃ refrigerator for 5-6 h before the clear organic layer was assayed by colorimetry at wavelength of 485 nm and dehydrogenase activity was calculated by comparing to standard curve.【Conclusion】 Determination method of dehydrogenase activity of crude enzyme preparation from fungi was optimized.
Key words:TTC-reduction method;dehydrogenase;fungi;crude enzyme preparation
[文章编号]1671-9387(2016)01-0155-07
[中图分类号]Q814.4
[文献标志码]A
[作者简介]马鑫(1988-),男,山东高密人,在读硕士,主要从事微生物资源利用研究。E-mail:maxin4561@163.com[通信作者]薛泉宏(1957-),男,陕西白水人,教授,博士生导师,主要从事微生物生态与资源利用研究。
[基金项目]陕西博秦生物工程有限公司微生物增油项目
[收稿日期]2014-05-09
DOI:网络出版时间:2015-12-0214:2510.13207/j.cnki.jnwafu.2016.01.023
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151202.1425.046.html
E-mail:xuequanhong@163.com

