小鼠触须毛囊外根鞘再生的体外培养液优化及α-SMA的表达鉴定
唐 瑶 邓梅成 王海涛 付灵慧 李树伟
(塔里木盆地生物资源保护利用兵团重点实验室/塔里木大学生命科学学院,新疆 阿拉尔 843300)
小鼠触须毛囊外根鞘再生的体外培养液优化及α-SMA的表达鉴定
唐 瑶邓梅成王海涛付灵慧李树伟*
(塔里木盆地生物资源保护利用兵团重点实验室/塔里木大学生命科学学院,新疆 阿拉尔 843300)
摘要【目的】 为建立小鼠毛囊体外培养模型,筛选适合小鼠触须毛囊外根鞘离体培养的培养液,并进行α-SMA (α-平滑肌肌动蛋白)表达的免疫荧光鉴定。 【方法】 选择出生5 d内的乳鼠断颈法处死,利用显微解剖技术,分离触须毛囊外根鞘。并分别培养于无血清、含5% FCS、10% FCS的DMEM、MEM共计6种不同培养液中,在37 ℃,5% CO2培养箱中培养4 d后,制作冰冻切片并进行H.E.染色,在显微镜下观察乳鼠触须毛囊外根鞘的再生情况,筛选培养液。在最适培养液中培养乳鼠触须毛囊外根鞘,利用α-SMA 抗体进行乳鼠触须毛囊外根鞘再生部位α-SMA表达的荧光鉴定。 【结果】观察到小鼠触须毛囊外根鞘中段再生的初期结构特征,并且 5% FCS MEM培养液是最适合小鼠触须毛囊外根鞘的体外培养液,免疫荧光检测发现α-SMA在毛囊外根鞘再生部位有表达。【结论】 5% FCS MEM培养液是比较适合小鼠触须毛囊外根鞘的体外培养液,α-SMA的表达可以作为毛囊再生的检测指标之一。
关键词小鼠毛囊; 触须; 外根鞘; 免疫荧光; α-SMA抗体
毛囊不仅是脊椎动物皮肤上皮及真皮的附属物,毛囊还是体表关键的环境感测器,对动物外貌和身体的热量维护具有重要作用。目前,治疗各种脱发疾病一般采用自体毛发移植,自体毛发移植虽可减少排异反应,但自体毛发数量有限,远远不能满足患者的需求,毛囊再生及其机制的研究成为迫切需要解决的问题。国内外对于毛囊的再生也进行了大量的探索,研究表明毛囊外根鞘在毛发的再生与创伤愈合中具有重要作用,Driskell等[1]报道毛囊外根鞘是由一群未分化的角质细胞组成,且某些细胞拥有干细胞的多能性。Ohyama等[2]报道,毛囊外根鞘是毛囊干细胞的富集区,在形态上,毛囊外根鞘细胞与表皮层的角质细胞具有一定的相似性,两者在组织结构的形成上也有较好的延续性,并且在条件合适的情况下两者可以互相转化,能够参与组织损伤修复及毛发的再生。 Rachel[3]等报道毛囊外根鞘细胞还可以释放一些细胞生长因子及少量激素,在一定条件下诱导时具有广泛的分化潜能[4]。外根鞘细胞这一特性提高了细胞的生物完整性,也表明外根鞘细胞具有成体干细胞的潜在特性。目前,大多数毛囊体外培养研究主要是先获得外根鞘细胞,再进行体外培养研究细胞特性,但外根鞘组织由多种类型的细胞构成,这样就有可能破坏外根鞘原有的再生功能。与人发毛囊相比,小鼠触须的毛囊比较大,进行显微解剖触须毛囊比较容易分离出所需的外根鞘。Higgins 等[5]对人发毛囊真皮乳头进行培养,细胞培养成功并传代。毛囊外根鞘再生模型是研究毛囊的生长周期和毛囊生长的影响因素的良好模型,同时也能为毛发移植和毛发再生的研究奠定基础。
1材料与方法
1.1材料
1.1.1试验材料:从新疆医科大学动物实验中心购买成年健康并处于发情期的昆明小鼠雌雄各5只,共10只,然后以在塔里木大学实验室繁殖得到的新生乳鼠作为实验材料。
1.1.2主要试剂:一抗α-SMA 兔抗小鼠多克隆抗体购自武汉三鹰生物工程有限公司,二抗山羊抗兔keyFluor488荧光检测试剂盒、山羊血清购自凯基生物科技有限公司,基础培养液DMEM和MEM购自 Gibco 公司,青/链霉素浓缩液购自重庆西南药业,HistoChoice、胎牛血清(FCS)购自Sigma公司,其它生化常规试剂均为国产分析纯:DAPI染液、抗荧光猝灭剂、DPBS、苏木精、伊红、OCT包埋剂、Triton X-100 原液。
1.1.3主要仪器:CO2培养箱、Leica冰冻切片机、Olympus显微镜、Zeiss倒置荧光显微镜。
1.2方法
1.2.1新生小鼠触须毛囊外根鞘分离培养
断颈法处死新生3 d的乳鼠,整个乳鼠放入75% 酒精中消毒, 然后转移到超净工作台,在解剖显微镜下用眼科剪沿乳鼠嘴角剪下双侧触须部皮肤组织,分离出触须毛囊,切除毛囊真皮乳头部分,拔出内根鞘,获得毛囊外根鞘。将其分别培养于无血清、含5% FCS、10% FCS的DMEM和MEM共计6种不同培养液中(见表1),在37 ℃,5% CO2培养箱中培养4 d,在OCT包埋前,显微镜下统计外根鞘再生个数,每组实验重复3次,筛选优化培养液。
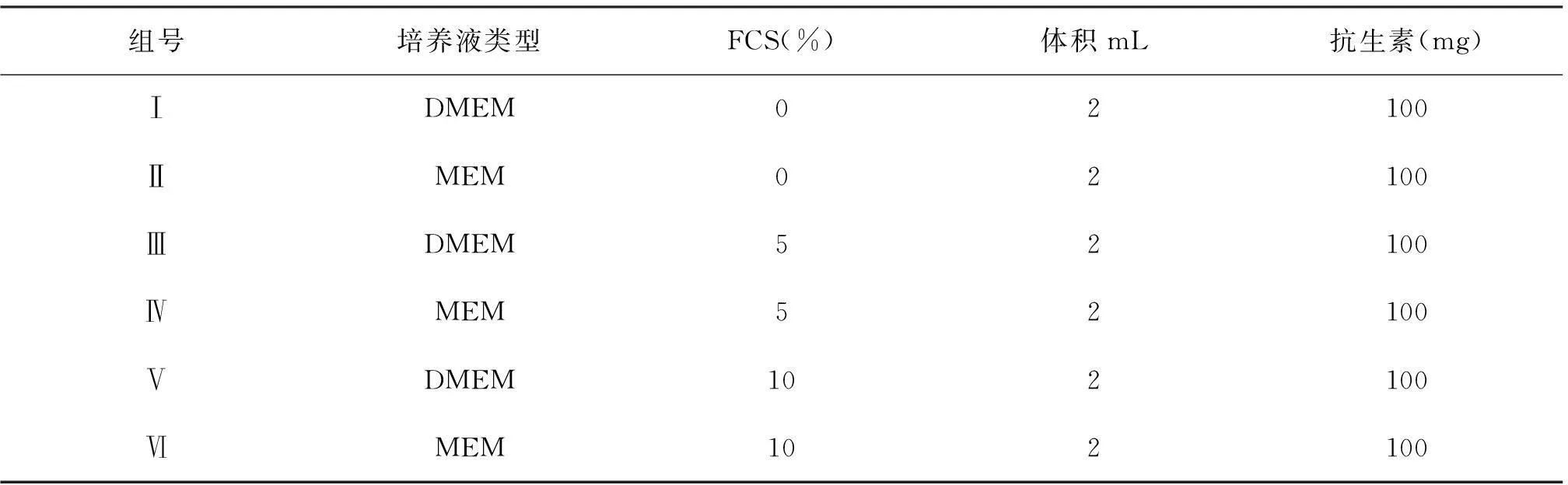
表1 乳鼠触须毛囊外根鞘体外培养液优化设计表
1.2.2新生小鼠触须毛囊外根鞘冰冻切片的制备
利用OCT冰冻包埋剂对6组培养4 d的触须毛囊外根鞘分别进行包埋,液氮速冻,然后放入-80°超低温冰箱保存备用。利用冰冻切片机制作厚度约8 μm的冰冻切片,标记编号并放入-20°冰箱中备用。
1.2.3新生小鼠触须毛囊外根鞘H.E.染色
从-20°冰箱中取出冰冻切片,电吹风吹干30 min,蒸馏水清洗5 min,然后用苏木素染液染色3~5 min左右,蒸馏水洗去染色液,用1%盐酸酒精处理5 s,继而放入蒸馏水中1 min,再放入伊红染液染色30 s,梯度酒精脱水,HistoChoice透明,晾干中性树胶封片,Olympus显微镜下拍照观察。
1.2.4新生小鼠触须毛囊外根鞘免疫荧光检测
取5% FCS MEM组2张冰冻切片,电吹风吹干30 min,4% PFA(多聚甲醛)固定30 min,PBS (pH7.2 ~ 7.4) 冲洗2次,1% Triton X-100透膜20 min,3% BSA+10% 山羊血清各250 μL混合滴加切片,放入湿盒避光孵育1 h,轻轻倒去孵育液,然后滴加100 μL的α-SMA多克隆抗体稀释液 (α-SMA∶山羊血清∶3% BSA =1∶1∶98), 以PBS代替一抗做阴性对照,4 ℃湿盒孵育过夜,PBS冲洗2次 ,添加二抗keyFluor488及DAPI,室温下湿盒避光孵育1 h,PBS冲洗2次,封片,暗房荧光拍照。
2结果与分析
2.1小鼠触须毛囊外根鞘再生情况
将6组不同培养液中的小鼠触须毛囊外根鞘在37 ℃,5% CO2培养箱中连续培养4 d整后,在Olympus 显微镜下观察并统计具有再生状态外根鞘的个数,计算出外根鞘在6组培养液中的再生百分比(见表2)
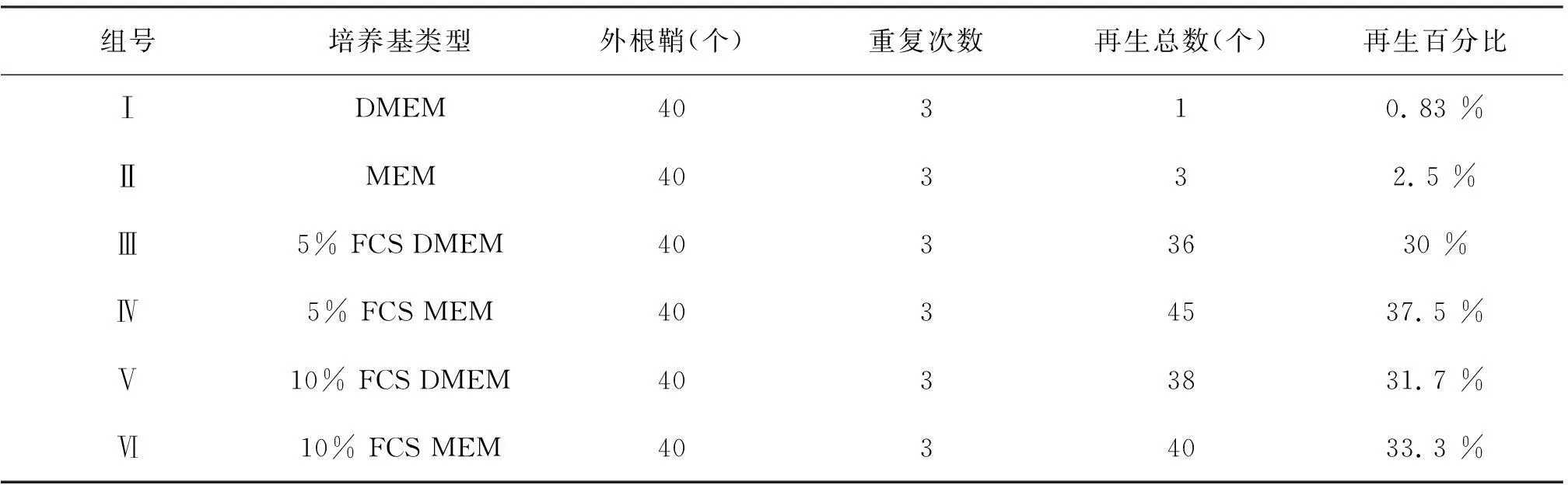
表2 乳鼠触须毛囊外根鞘再生情况统计表
2.2小鼠触须毛囊结构和外根鞘再生形态学观察
将乳鼠触须毛囊进行外科显微解剖得到完整触须毛囊,制作切片H.E.染色观察触须毛囊结构,包括外根鞘、内根鞘、毛干、毛母质、毛乳头等部分组成。Schlake等[6]研究表明毛囊的最深处是位于角质层3~6 mm的毛乳头,它具有神经和血管,并向毛干提供毛囊生长所需的营养,毛囊的最外侧是外根鞘。对解剖出的完整昆明乳鼠触须毛囊再进行显微解剖得到离断下1/3毛球部的毛囊,然后拔出内根鞘后获得外根鞘,内根鞘和外根鞘之间有一层玻璃膜(glass membrane、GM),可以用来区分毛囊中部细胞的再生(Regeneration cells、RCS)。
图1a为完整的0 d新生小鼠毛囊结构,具有毛囊球部、内根鞘及毛干。图1b为显微解剖的0 d新生小鼠毛囊外根鞘结构,已经去除了毛囊球部、内根鞘及毛干部分,仅剩外根鞘部分。

图2 无血清培养液培养4 d的小鼠毛囊外根鞘
图2a和2b分别是无血清的DMEM和MEM培养液培养乳鼠毛囊外根鞘4 d后H.E.染色结果,从图中可以发现毛囊外根鞘的中部在OCT包埋时,由于内根鞘的剔除,把外根鞘中的空间挤压成一条线,而且在玻璃膜的内部没有新生细胞出现。

图3 在5% FCS培养液培养4 d的小鼠毛囊外根鞘
图3a和3b分别是含5% FCS的DMEM和MEM培养液培养4 d后H.E.染色结果,显微镜下可以看到新生细胞填充了玻璃膜内部,图3a再生部位其外面部分呈淡紫色,结构上由外根鞘延续而来。图3b中再生部位其外面部分呈深紫色,结构上同样由外根鞘延续而来,新生外层细胞致密,体积小,核为卵圆形,其内层细胞也同样致密,再生细胞连续性好。

图4 10% FCS培养液培养4 d的小鼠毛囊外根鞘
图4a和4b 分别是含10% FCS的DMEM和MEM培养液培养4 d后H.E.染色结果,显微镜下可以看到图4a中,玻璃膜混乱不完整,毛囊中部细胞虽再生但无规则,再生后失去毛囊结构。在图4b 中,毛囊再生情况明显要比图4a中好,玻璃膜清晰,但再生细胞体积大,细胞核为圆形,部分核已空泡化,再生结构松散,可以看出没有图3b中的再生细胞结构致密。
2.3α-SMA在小鼠触须毛囊外根鞘再生中的表达
将新生小鼠毛囊外根鞘冰冻切片分别用H.E.染色和α-SMA抗体免疫荧光染色。免疫荧光组织化学染色切片以不加抗体作为阴性对照,以加α-SMA抗体作为阳性实验组。

图5 小鼠毛囊外根鞘的α-SMA抗体免疫荧光对照组
从图5可见,由于对照组是用PBS代替一抗做阴性对照,从免疫荧光结果上可以看出只有细胞核被DAPI染成蓝色荧光(图5b),没有发现488的绿色荧光。
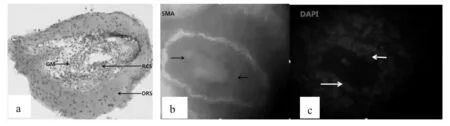
图6 小鼠毛囊外根鞘的α-SMA抗体免疫荧光实验组
从图6中可以看到在阳性实验组中有α-SMA的阳性表达(488绿色荧光),如图中箭头所示(图6b),图6c显示了细胞核DAPI蓝色荧光,黄色箭头所指是紧贴玻璃膜再生细胞的细胞核。
3讨论
前期的研究表明,与人发毛囊相比,小鼠触须毛囊较大,显微解剖法易于分离外根鞘,且鼠龄容易控制,结果稳定,因而本研究采取游离小鼠触须毛囊外根鞘进行气液界面三维培养。另外,毛囊外根鞘细胞可以释放一些细胞生长因子,并且毛囊外根鞘形态再生涉及外根鞘细胞之间一系列复杂的相互作用。为了获取完整的触须毛囊,使用显微外科解剖技术,没有经过胰酶和胶原酶的消化,故较好的保留了毛囊的生长活性及再生功能。
Ito M等人[7]研究发现毛囊球部是毛囊干细胞另一富集区。本研究将真皮乳头切除干净,即切除毛囊下1/3部分,拔出内根鞘,获得所需外根鞘。在37 ℃,5% CO2培养箱中培养4 d后显微观察发现,4种含有FCS的培养液中外根鞘再生百分率不同,在无血清的培养液中,外根鞘几乎不再生,而5% FCS MEM的培养液条件下毛囊外根鞘的再生率最高。因此,5% FCS MEM培养液为本研究中最适合小鼠触须毛囊外根鞘再生的体外培养液,毛囊外根鞘细胞的再生状况较好;并且同一FCS浓度时,DMEM培养外根鞘细胞再生的效果不如MEM好。
针对在此优化的培养液条件下外根鞘培养时间范围,发现再生良好的外根鞘从第6天开始呈塌陷状态,而且,培养到第9天,外根鞘细胞萎缩或者开始死亡。因此延长外根鞘体外培养时间将是下一步需要探究的问题。培养液中加入不同浓度的FCS,由于血清中含有各种血浆蛋白、多肽、脂肪、碳水化合物、生长因子、激素、无机物等,为外根鞘再生提供了营养物质和生长因子。H.E.染色结果对比表明,血清是促进毛囊外根鞘再生的一个很重要的因素,血清中各种营养成分充足并且其中的生长因子有利于毛囊外根鞘的再生。
α-SMA作为细胞骨架蛋白的一种,在细胞再生及维持细胞形态中具有重要作用,因此,α-SMA的表达是细胞再生的标志之一。在本实验中的免疫荧光检测结果显示,α-SMA 在5% FCS MEM的培养条件下再生的毛囊外根鞘中可以见到阳性表达,由此也更进一步说明毛囊外根鞘具有成体干细胞的潜能。
4结论
4.1对日龄3 d的昆明乳鼠触须毛囊外根鞘体外培养结果表明,毛囊外根鞘再生的最适培养液条件为5% FCS MEM的培养液。
4.2对再生的毛囊外根鞘进行α-SMA免疫荧光检测,在毛囊外根鞘中心部位显示有α-SMA的表达。
参考文献
[1]Driskell I, Oeztuerk-Winder F, Humphreys P,et al. Genetically Induced Cell Death in Bulge Stem Cells Reveals Their Redundancy for Hair and Epidermal Regeneration[J].Semin Cel,2015,33(3):988-998.
[2]Ohyama M, Terunuma A ,Tock C L, et al. Characterization and isolation of stem cell-enriched human hair follicle bulge cells[J].J Clin Invest, 2006,116(1):249-260.
[3]Rachel S, Michael R. Mesenchymal-epithelial interactions during hair follicle morphogenesis and cycling[J].Semin Cell Dev Biol, 2012,23(8):917-927.
[4]Vidal V P, Chaboissier M C, Lützkendorf S,et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment[J].Curr Biol, 2005,15(5):1340-1351.
[5]Higgins C A, Chen J C, Cerise J E,et al. Microenvironmental reprogramming by three-dimensional culture enables dermal papilla cells to induce de novo human hair-follicle growth[J].PNAS, 2013,110(49):19679-19688.
[6]Schlake T. Determination of hair structure and shape[J].Semin Cell Dev Biol, 2007,18(2):267-273.
[7]Ito M, Kizawa K, Hamada K,et al. Hair follicle stem cells in the lower bulge form the secondary germ,a biochemically distinct but functionally equivalent progenitor cell population at the termination of catagen[J].Differentiation,2004,72(9):548-557.
Optimization Medium of Culturing the Mice Whisker Outer Root Sheath in Vitro and Identification of Expression of α-SMA
Tang YaoDeng MeichengWang HaitaoFu Linghui Li Shuwei*
(Key Laboratory of Protection and Utilization of Biological Resource in Tarim Basin of Xinjiang Production &Construction Corps/College of Life Science, Tarim University, Alar, Xinjiang 843300)
Abstract【Objective】 To establish the mouse follicle in vitro culture model, optimized the culture medium of the mice outer root sheath, and detected α-SMA (α-smooth muscle actin) expression by immunofluorescence. 【Methods】 Newborn mice were sacrificed from cervical, isolated mice outer root sheath with microsurgical dissection, and cultured in 6 kinds of medium such as serum-free, 5% FCS (fetal calf serum) and 10% FCS DMEM or MEM respectively. Put them in 5% CO2 incubator at 37℃ for 4 days, embedding and frozen section, and then H.E. staining. The mice outer root sheath regeneration were observed under the microscope observation to select the best culture medium. Rat vibrissa follicle outer root sheath were cultured in the optimum culture liquid, and Immunoflourescence analysis the newborn mice outer root sheath regeneration with α-SMA antibody.【Results】The early stage of the mice follicle outer root sheath regeneration were observed. 5% FCS MEM medium were suitable culture medium for the mice outer root sheath regeneration. Immunofluorescence analysis found that α-SMA expressed at the region of regeneration.【Conclusion】5% FCS MEM medium were more suitable for culturing mice outer root sheath in vitro, and α-SMA expression could be used as indicator to detect the whisker follicle regeneration.
Key wordsmice follicle; whisker; outer root sheath; immunofluorescence; α-SMA antibody
中图分类号:Q954.539
文献标识码:A
DOI:10.3969/j.issn.1009-0568.2016.02.001
文章编号:①1009-0568(2016)02-0001-07
作者简介:唐瑶(1993-),女,生物科学16级本科,研究方向为生物技术。E-mail:308930016@qq.com*为通讯作者E-mail:xj_lsw@126.com
基金项目:国家自然科学基金(31560685),国家级大学生创新项目(201410757009),塔里木大学校级大学生创新项目(2014010),塔里木大学研究生科研创新校级指导项目(TDGRI201521)。
收稿日期:①2015-11-09

