臭氧自血疗法治疗急性痛风性关节炎的疗效及安全性研究
窦 智,左欣鹭,倪家骧
臭氧自血疗法治疗急性痛风性关节炎的疗效及安全性研究
窦 智,左欣鹭,倪家骧
100053 北京市,首都医科大学宣武医院疼痛科(窦智,倪家骧);承德护理职业学院(左欣鹭)
【摘要】目的探索臭氧自血疗法(O3-AHT)联合依托考昔治疗急性痛风性关节炎的疗效及安全性。方法选取2013年10月—2015年10月在首都医科大学宣武医院疼痛科就诊且符合纳入与排除标准的急性痛风性关节炎患者41例为研究对象。采用随机数字表法将患者分为试验组(21例)和对照组(20例)。试验组给予O3-AHT联合依托考昔治疗,对照组给予单纯依托考昔治疗。记录并比较两组治疗前及治疗1~7 d时疼痛强度评分〔疼痛数字评价量表(NRS)评分〕,治疗前及治疗7 d时关节肿胀程度、关节压痛评分,治疗7 d时患者对治疗的总体反应(PGART)评分,治疗前及治疗7 d时白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)水平。记录治疗期间发生的不良反应。结果治疗方法与治疗时间存在交互作用(P<0.05);NRS评分组间比较,差异有统计学意义(P<0.05);NRS评分时间间比较,差异有统计学意义(P<0.05)。试验组治疗1~4 d时NRS评分均低于对照组(P<0.05);两组治疗1~7 d时NRS评分均低于治疗前(P<0.05)。两组治疗前关节肿胀程度、关节压痛评分,治疗7 d时关节压痛评分,PGART评分比较,差异无统计学意义(P>0.05);试验组治疗7 d时关节肿胀程度评分低于对照组(P<0.05)。两组治疗7 d时关节肿胀程度、关节压痛评分均低于治疗前(P<0.05)。两组治疗前IL-1β、TNF-α水平,治疗7 d时TNF-α水平比较,差异无统计学意义(P>0.05);试验组治疗7 d时IL-1β水平低于对照组(P<0.05)。两组治疗7 d时IL-1β、TNF-α水平均低于治疗前(P<0.05)。两组患者均未出现消化道出血、心脑血管意外、溶血等严重不良反应。两组患者胃肠道反应发生率比较,差异无统计学意义(P=0.306)。结论O3-AHT联合依托考昔治疗急性痛风性关节炎能够加速对炎症的控制,加快对疼痛的缓解,且不会增加不良反应发生率,是安全有效的治疗手段。
【关键词】关节炎,痛风性;臭氧自血疗法;治疗结果;疼痛
窦智,左欣鹭,倪家骧.臭氧自血疗法治疗急性痛风性关节炎的疗效及安全性研究[J].中国全科医学,2016,19(15):1740-1743,1754.[www.chinagp.net]
Dou Z,Zuo XL,Ni JX.Efficacy and safety of ozoned autohemotherapy in the treatment of acute gouty arthritis[J].Chinese General Practice,2016,19(15):1740-1743,1754.
急性痛风性关节炎是一种由于尿酸盐(monosodium urate,MSU)结晶在关节沉积,刺激大量促炎因子释放引起的自限性滑膜炎[1],其特点是急性发作的单个或多个关节的中重度疼痛,伴关节红肿及功能受限,通常持续7~10 d[2]。目前临床常用的药物,如非甾体类抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)、秋水仙碱或糖皮质激素,在急性痛风发作的前3 d仅能将疼痛缓解50%[3],而且不良反应的高发风险也限制了其在临床的应用[4]。既往研究发现,臭氧自血疗法(ozoned autohemotherapy,O3-AHT)能够显著缓解慢性痛风患者的疼痛,改善患者体内炎性因子水平[5]。本研究将O3-AHT作为NSAIDs之外的补充治疗手段,观察其控制急性痛风性关节炎的临床效果,以期为该疾病提供更为有效的临床治疗方法。
1资料与方法
1.1纳入与排除标准纳入标准:(1)年龄≥18岁;(2)符合美国风湿病学会急性痛风性关节炎的诊断标准[6];(3)发病至就诊时间≤48 h;(4)患者受累关节≤4个,且关节的疼痛数字评价量表(numerical rating scale,NRS)评分≥4分。排除标准:(1)受累关节同时患有类风湿关节炎、感染性关节炎或其他关节炎;(2)严重的肝、肾疾病,有消化道溃疡或出血病史,心、脑血管疾病病史;(3)正在服用长效NSAIDs或有明显的NSAIDs禁忌证;(4)在过去4周接受过关节腔内激素注射治疗。
1.2研究对象及分组选取2013年10月—2015年10月在首都医科大学宣武医院疼痛科就诊且符合纳入与排除标准的急性痛风性关节炎患者41例为研究对象。其中男38例,女3例;平均年龄(52.3±11.5)岁。采用随机数字表法将患者分为试验组(21例)和对照组(20例)。本研究经首都医科大学医学伦理委员会批准,所有患者在纳入研究前签署知情同意书。
1.3治疗方法本研究为为期1周的单中心、随机、单盲、平行分组的临床试验。试验组给予依托考昔120 mg,1次/d,持续7 d;分别于第1、3、5天给予O3-AHT治疗。O3-AHT操作流程:抗臭氧负压瓶内预先注入3.8%枸橼酸钠20 ml,自患者肘前静脉抽取静脉血200 ml,与等体积臭氧充分混合5 min后再回输体内[7]。其中所需臭氧通过赫尔曼臭氧机(Herrmann Apparatebau GmbH,Kleinwallstadt,Germany)制取,浓度为50 μg/ml。对照组仅给予依托考昔120 mg,1次/d,持续7 d。
1.4观察指标
1.4.1疼痛强度、关节肿胀程度、关节压痛、患者对治疗的总体反应(patient global assessment of response to treatment,PGART)评分根据OMERACT(Outcome Measures in Rheumatology Clinical Trials)推荐的急性痛风临床评价标准[8],将疼痛强度、关节肿胀程度、关节压痛、PGART评分作为主要临床观察指标。指导患者采用疼痛日记的形式记录治疗前及每天药物和/或O3-AHT治疗结束后4 h目标关节的疼痛强度评分,即NRS评分(总分0~10分,其中0分代表无疼痛,10分代表最严重的疼痛)。目标关节定义为入组时患者自述疼痛最严重的关节。治疗前和治疗7 d时,由医生对患者目标关节肿胀程度和关节压痛进行评分。关节肿胀程度评分采用4分制:0分=无肿胀,1分=可触及肿胀,2分=肉眼可见肿胀,3分=肿胀超出关节范围;关节压痛评分采用4分制:0分=无压痛,1分=患者诉有压痛,2分=患者诉有压痛且畏缩,3分=患者诉有压痛且逃避[9]。治疗7 d时记录患者的PGART评分(总分0~5分,其中0分=非常好,4分=非常糟糕)。
1.4.2白介素1β(leukocytosis-1 beta,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)水平采用ELISA法检测患者治疗前和治疗7 d时血清IL-1β、TNF-α水平(试剂购自R&D systems公司,人IL-1β试剂盒型号:DLB50,人TNF-α试剂盒型号:DTA00C)。
1.4.3不良反应记录治疗期间发生的不良反应,包括胃肠道反应、消化道出血、心脑血管意外、溶血等。
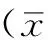
2结果
2.1一般情况研究过程中试验组有2例患者因依托考昔引起的胃肠道反应而改用糖皮质激素治疗,对照组有1例患者因疼痛无法缓解而加用曲马多镇痛,因而退出研究,其余38例患者完成全部试验。为了避免因患者退出造成的选择性偏倚,本研究组采用意向治疗分析(intension-to-treatanalysis,ITT),根据推移法将中途退出研究患者退出当天的各项临床症状评分作为最终评分纳入分析。试验组男20例、女1例,平均年龄(51.6±11.1)岁;对照组男18例、女2例,平均年龄(53.0±12.1)岁。两组患者性别、年龄比较,差异无统计学意义(P=0.606;t=0.398,P=0.693)。
2.2NRS评分比较治疗方法与治疗时间存在交互作用(P<0.05);NRS评分组间比较,差异有统计学意义(P<0.05);NRS评分治疗时间间比较,差异有统计学意义(P<0.05)。试验组治疗1~4d时NRS评分均低于对照组,差异有统计学意义(P<0.05);两组治疗1~7d时NRS评分均低于治疗前,差异有统计学意义(P<0.05,见表1)。
2.3关节肿胀程度、关节压痛、PGART评分比较两组治疗前关节肿胀程度、关节压痛评分,治疗7d时关节压痛评分,PGART评分比较,差异无统计学意义(P>0.05);试验组治疗7d时关节肿胀程度评分低于对照组,差异有统计学意义(P<0.05)。两组治疗7d时关节肿胀程度、关节压痛评分均低于治疗前,差异有统计学意义(P<0.05,见表2)。
2.4IL-1β、TNF-α水平比较两组治疗前IL-1β、TNF-α水平,治疗7d时TNF-α水平比较,差异无统计学意义(P>0.05);试验组治疗7d时IL-1β水平低于对照组,差异有统计学意义(P<0.05)。两组治疗7d时IL-1β、TNF-α水平均低于治疗前,差异有统计学意义(P<0.05,见表3)。
2.5不良反应两组患者均未出现消化道出血、心脑血管意外、溶血等严重不良反应。试验组有7例(33.3%)患者发生胃肠道反应,对照组有4例(20.0%)患者发生胃肠道反应,其中试验组2例患者停止服用依托考昔,其余患者给予奥美拉唑对症处理后症状好转。两组患者胃肠道反应发生率比较,差异无统计学意义(P=0.306)。
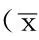
Table 2Comparison of joint swelling and joint tenderness scores before and after treatment and PGART score after treatment between the two groups

组别例数关节肿胀程度评分治疗前 治疗7d关节压痛评分治疗前 治疗7dPGART评分对照组202.7±0.51.6±0.2a2.3±0.71.7±0.6a1.3±1.1试验组212.7±0.50.9±0.2a2.4±0.61.6±0.5a0.8±0.9t值-0.4232.928-0.5980.6561.658P值0.6740.0060.5530.5160.105
注:PGART=患者对治疗的总体反应;与治疗前比较,aP<0.05
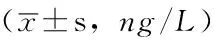
Table3ComparisonofthelevelsofIL-1βandTNF-αbeforeandaftertreatmentbetweenthetwogroups

组别例数IL-1β治疗前 治疗7dTNF-α治疗前 治疗7d对照组20103.3±26.561.9±14.0a115.7±30.268.0±25.7a试验组21102.5±34.751.0±16.8a117.4±26.656.9±20.8at值0.0882.306-0.1931.568P值0.9300.0260.8480.125
注:IL-1β=白介素1β,TNF-α=肿瘤坏死因子α;与治疗前比较,aP<0.05

表1 两组患者治疗前后NRS评分比较±s,分)
注:与对照组比较,aP<0.05;与治疗前比较,bP<0.05
3讨论
O3-AHT以其抗病原体、抗感染、调节机体抗氧化能力等多种治疗作用以及较高的安全性,在临床应用已有几十年历史[10]。本研究结果显示,NRS评分组间有差异,说明不同治疗方法对患者的NRS评分影响不同。试验组治疗1~4 d时NRS评分均低于对照组,两组治疗1~7 d时NRS评分均低于治疗前,提示将O3-AHT作为急性痛风性关节炎的补充治疗手段,与单独应用依托考昔相比,疼痛的缓解速度更快。试验组治疗7 d时关节肿胀程度评分低于对照组,两组治疗7 d时关节肿胀程度、关节压痛评分均低于治疗前,提示O3-AHT在消除关节炎症方面的作用更为显著。本研究组认为,上述结果可能得益于臭氧入血后产生的强大抗感染作用。急性痛风的发病机制为MSU结晶在关节或关节周围组织内沉积诱发的急性炎性反应。MSU结晶被中性粒细胞和单核细胞吞噬后会诱发IL-1β的大量合成和释放,IL-1β作为促炎因子,会引起血管舒张,聚集更多的中性粒细胞,并上调包括TNF-α、白介素6(IL-6)和白介素8(IL-8)在内的多种细胞因子和趋化因子的表达水平,引起瀑布式的炎症级联反应[11-12]。而O3-AHT能够通过Toll样受体-核转录因子kappa B(toll-like receptor-nuclear factor-kappa B,TLR4-NF-κB)途径降低TNF-α、IL-1β、IL-6、细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)mRNA表达水平,降低体内炎性因子水平,达到抗感染、抑制白细胞聚集的作用[13-14]。本研究结果显示,试验组治疗7 d时IL-1β水平低于对照组,两组治疗7 d时IL-1β水平均低于治疗前,说明O3-AHT能够抑制血液中IL-1β的合成。本研究结果显示,两组PGART评分无差异,而且评分较低(<2.0分),说明两种治疗方式均获得患者认可,患者对O3-AHT的接受度较高。两组治疗7 d时TNF-α水平均低于治疗前,但两组治疗7 d时TNF-α水平无差异,说明TNF-α会随病情的缓解而降低,但O3-AHT可能无抑制TNF-α合成及释放的作用。两组患者均未出现消化道出血、心脑血管意外、溶血等严重不良反应,两组患者胃肠道反应发生率无差异,提示O3-AHT安全性较好。
急性痛风的临床症状通常会在7~10 d内逐渐消失,Schett等[15]研究发现,这种自限性与中性粒细胞胞外陷阱(neutrophil extracellular traps,NETs)的形成有关。NETs是指中性粒细胞在坏死或凋亡后,将染色质释放到细胞外,固定并杀死病原体的过程。在急性痛风的发病过程中,中性粒细胞因为吞噬MSU而坏死,形成NETs,可在数分钟内吸附住包括TNF-α、IL-1和IL-6在内的大量炎性因子并将其降解或灭活,这一过程促进了炎症的消散。Schauer等[16]发现,NETs的形成依赖于体内的活性氧(reactive oxygen species,ROS),而臭氧与血液混合后,会立刻跟血液中的抗氧化剂、多不饱和脂肪酸等发生反应,产生大量以H2O2为主要成分的ROS[10],这可能会加速NETs的形成、疼痛的缓解,缩短急性痛风的病程。此外,O3-AHT能够通过NO和CO的协同作用,增加红细胞内2,3-二磷酸甘油酸的水平,改善炎症部位的氧供,增加局部血液循环,将浓聚的细胞因子稀释[17],这一作用也有助于痛风炎症的消散。
本研究的不足之处在于,对照组无法对O3-AHT的安慰剂效应做出正确评估,有可能在某些主观评价指标上夸大O3-AHT的治疗作用。对此,本研究引入血清IL-1β、TNF-α水平检测等客观指标,并对参与临床评价的人员采取严格遮盲措施,尽可能保证研究的客观性。
综上所述,O3-AHT联合依托考昔治疗急性痛风性关节炎能够加速对炎症的控制,加快对疼痛的缓解,且不会增加不良反应发生率,是安全有效的治疗手段。但就如何选择O3-AHT的最佳治疗频率,如何在联合治疗的基础上减少NSAIDs的用量或缩短其用药时间,以减少不良反应发生率,还需进一步研究。
作者贡献:窦智进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;左欣鹭进行试验实施、临床评估;倪家骧进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Neogi T.Clinical practice.Gout[J].N Engl J Med,2011,364(5):443-452.
[2]Schumacher HR,Taylor W,Edwards L,et al.Outcome domains for studies of acute and chronic gout[J].J Rheumatol,2009,36(10):2342-2345.
[3]van Durme CM,Wechalekar MD,Landewé RB.Nonsteroidal anti-inflammatory drugs for treatment of acute gout[J].JAMA,2015,313(22):2276-2277.
[4]Khanna PP,Gladue HS,Singh MK,et al.Treatment of acute gout:a systematic review[J].Semin Arthritis Rheum,2014,44(1):31-38.
[5]Neogi T.Interleukin-1 antagonism in acute gout:is targeting a single cytokine the answer?[J].Arthritis Rheum,2010,62(10):2845-2849.
[6]Li LY,Ni JX.Efficacy and safety of ozonated autohemotherapy in patients with hyperuricemia and gout:a phase I pilot study[J].Exp Ther Med,2014,8(5):1423-1427.
[7]Cao GQ,Li XH,Wu BS,et al.Cellular mechanism of pain relief by ozonated autohemotherapy in treatment of gouty patients[J].Chinese General Practice,2015,18(18):2162-2165.(in Chinese)
曹国庆,李秀华,武百山,等.臭氧自体血治疗痛风缓解疼痛的细胞机制研究[J].中国全科医学,2015,18(18):2162-2165.
[8]Wallace SL,Robinson H,Masi AT,et al.Preliminary criteria for the classification of the acute arthritis of primary gout[J].Arthritis Rheum,1977,20(3):895-900.
[9]Borrelli E,Diadori A,Zalaffi A,et al.Effects of major ozonated autohemotherapy in the treatment of dry age related macular degeneration:a randomized controlled clinical study[J].Int J Ophthalmol,2012,5(6):708-713.
[10]Elvis AM,Ekta JS.Ozone therapy:a clinical review[J].J Nat Sci Biol Med,2011,2(1):66-70.
[11]Ramonda R,Oliviero F,Galozzi P,et al.Molecular mechanisms of pain in crystal-induced arthritis[J].Best Pract Res Clin Rheumatol,2015,29(1):98-110.
[12]Yuan YM,Li CG.The dynamic changes of the serum levels of interleukin-1β,tumor necrosis factor-α,cyclooxygenase-2 in acute gouty arthritis patients[J].Chinese Journal of Rheumatology,2013,17(12):818-822.(in Chinese)
袁艳平,李长贵.痛风性关节炎患者血清白细胞介素-1β肿瘤坏死因子-α环氧化酶-2水平的动态变化研究[J].中华风湿病学杂志,2013,17(12):818-822.
[13]Chen H,Xing B,Liu X,et al.Ozone oxidative preconditioning protects the rat kidney from reperfusion injury:the role of nitric oxide[J].J Surg Res,2008,149(2):287-295.
[14]Xing B,Chen H,Wang L,et al.Ozone oxidative preconditioning protects the rat kidney from reperfusion injury via modulation of the TLR4-NF-kappaB pathway[J].Acta Cir Bras,2015,30(1):60-66.
[15]Schett G,Schauer C,Hoffmann M,et al.Why does the gout attack stop? A roadmap for the immune pathogenesis of gout[J].RMD Open,2015,1(Suppl 1):e000046.
[16]Schauer C,Janko C,Munoz LE,et al.Aggregated neutrophil extracellular traps limit inflammation by degrading cytokines and chemokines[J].Nat Med,2014,20(5):511-517.
[17]Bocci V,Travagli V,Zanardi I.May oxygen-ozone therapy improves cardiovascular disorders?[J].Cardiovasc Hematol Disord Drug Targets,2009,9(2):78-85.
(本文编辑:崔丽红)
Efficacy and Safety of Ozoned Autohemotherapy in the Treatment of Acute Gouty Arthritis
DOUZhi,ZUOXin-lu,NIJia-xiang.
DepartmentofPainManagement,XuanwuHospitalCapitalMedicalUniversity,Beijing100053,China
【Abstract】ObjectiveTo evaluate the efficiency and safety of ozoned autohemotherapy(O3-AHT) combined with etoricoxib in the treatment of acute gouty arthritis.MethodsFrom October 2013 to October 2015,we enrolled 41 patients with acute gouty arthritis who received treatment in the Department of Pain Management of Xuanwu Hospital Capital Medical University and accorded with inclusion and exclusion criteria.Using random number table method,we divided the patients into trial group(n=21) and control group(n=20).Trial group was given O3-AHT combined with etoricoxib,and control group was given etoricoxib solely.Pain intensity score(NRS score) before treatment and on day 1-7,the scores of joint swelling degree and joint tenderness before treatment and on day 7,the score of comprehensive reaction of the patients(PGART) on day 7,and the levels of IL-1β and TNF-α before treatment and on day 7 were recorded and compared.All adverse reactions during treatment were recorded.ResultsInteraction existed between treatment methods and time(P<0.05);differences in NRS score between the two groups were significant(P<0.05);differences in NRS score among different time points were significant(P<0.05).Trial group was lower than control group in NRS score on day 1-4(P<0.05);the two groups had lower NRS score on day 1-7 during treatment than that before treatment(P<0.05).The two groups were not significantly different in the scores of joint swelling degree and joint tenderness before treatment,joint tenderness score on day 7 and PGART score(P>0.05);trial group was lower than control group in the score of joint swelling degree on day 7(P<0.05).The two groups had lower scores of joint swelling degree and joint tenderness on day 7 than those before treatment(P<0.05).The two groups were not significantly different in the levels of IL-1β and TNF-α before treatment and the level of TNF-α on day 7(P>0.05);trial group was lower than control group in the level of IL-1β on day 7(P<0.05).The two groups had lower levels of IL-1β and TNF-α on day 7 than those before treatment(P<0.05).Severe adverse reactions like hemorrhage of digestive tract,cardio-cerebral vascular events and hemolysis did not occurred in patients of the two groups.The two groups were not significantly different in the incidence of gastrointestinal reactions(P=0.306).ConclusionO3-AHT combined with etocoxib can accelerate the inflammation control and pain remission in the treatment of acute gouty arthritis,and cause no increase in the incidence of adverse reactions.Therefore,it is a safe and effective treatment measure.
【Key words】Arthritis,gouty;Ozoned autohemotherapy;Treatment outcome;Pain
基金项目:北京市医院管理局临床医学发展专项经费资助项目(ZYLX201507)
通信作者:倪家骧,100053 北京市,首都医科大学宣武医院疼痛科;E-mail:nijiaxiang@263.net
【中图分类号】R 684.3
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.15.001
(收稿日期:2016-01-01;修回日期:2016-03-21)

