异噁唑拼接吡咯螺环氧化吲哚化合物的合成及其抗肿瘤活性
刘雄伟, 周 根, 姚 震, 王丹丹,刘欢欢, 巩 艺, 刘雄利, 彭礼军, 周 英
(贵州大学 药学院 贵州省中药民族药创制工程中心,贵州 贵阳 550025)
·研究论文·
异噁唑拼接吡咯螺环氧化吲哚化合物的合成及其抗肿瘤活性
刘雄伟, 周根, 姚震, 王丹丹,刘欢欢, 巩艺, 刘雄利*, 彭礼军, 周英*
(贵州大学 药学院 贵州省中药民族药创制工程中心,贵州 贵阳550025)
摘要:以取代靛红,(E)-硝基异噁唑芳烯烃和苯基甘氨酸为原料,乙腈为溶剂,经1,3-偶极子3+2环加成反应合成了8个新型的异噁唑拼接吡咯螺环氧化吲哚化合物(3a~3h),产率41%~62%, d/r值为2 ∶1~10 ∶1,其结构经1H NMR,13C NMR和HR-ESI-MS表征。采用MTT法研究了3a~3h对人肺癌细胞(A549),人前列腺(PC-3)和人白血病细胞(K562)的体外抗肿瘤活性。结果表明:3a, 3b和3c分别对K562, PC-3和A549具有较好的抑制活性,其对应的IC50为16.0 μmol·L-1, 21.2 μmol·L-1和24.4 μmol·L-1,优于顺铂(26.1 μmol·L-1, 27.2 μmol·L-1和25.6 μmol·L-1)。
关键词:异噁唑拼接吡咯螺环氧化吲哚; 1,3-偶极环加成反应; 亚胺叶立德; 合成; 抗肿瘤活性
3-吡咯螺环氧化吲哚具有良好的生物活性,吸引了化学工作者的广泛关注。如从烟曲霉发酵液中分离所得的Spirotryprostatins B,可阻断细胞分裂的G2/M期,具有完全抑制tsFT210细胞的作用[1]。天然产物台钩藤碱被证明具有调节大脑皮层M受体亚型和5-羟色胺受体的功能[2]。从灯台Muelleriana和多种Alstonisine仿生类似物中分离得到的天然生物碱Alstonisine,也具有较好的生理活性[3]。
异噁唑基团普遍存在于天然产物和药物分子中。如Cloxacillin, Muscimol, Isoxicam和Leflunomide等[4-7],在生物制药领域有重要应用价值。
因此,将异噁唑基团拼接到3-吡咯螺环氧化吲哚骨架,合成一系列具备潜在活性的氧化吲哚衍生物,可为生物活性筛选提供来源。目前,尚无苯基甘氨酸与靛红反应生成1,3-偶极子,再与硝基异噁唑烯烃发生1,3-偶极环加成反应,高效合成异噁唑拼接吡咯螺环氧化吲哚化合物的报道。本文以取代靛红(1a, 1d~1h),(E)-硝基异噁唑芳烯烃(2a~2c, 2h)和苯基甘氨酸为原料,乙腈为溶剂,经1,3-偶极子3+2环加成反应合成了8个新型的异噁唑拼接吡咯螺环氧化吲哚化合物(3a~3h, Scheme 1),产率41%~62%,d/r值为2 ∶1~10 ∶1,其结构经1H NMR,13C NMR和HR-ESI-MS表征。并采用MTT法研究了3a~3h对人肺癌细胞(A549),人前列腺(PC-3)和人白血病细胞(K562)的体外抗肿瘤活性。

Scheme 1
1实验部分
1.1试剂与仪器
WRS-1B型熔点仪;Bruker 400 MHz型核磁共振仪(CD3Cl为溶剂,TMS为内标);MicroTMQ-TOF型高分辨质谱仪。
所用试剂均为分析纯。
1.23a~3h的合成(以3a为例)
在反应管中依次加入5-甲基靛红(1a)64.4 mg(0.4 mmol), (E)-硝基异噁唑对溴苯基烯烃(2a)184.8 mg(0.6 mmol),苯基甘氨酸120.8 mg(0.8 mmol)和乙腈15 mL,搅拌下回流反应72 h。反应液经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=4∶1]纯化得3a 262.3 mg。
用类似的方法合成3b~3h。
3a: 苍黄色固体;1H NMRδ: 2.22(s, 3H), 2.31(s, 3H), 4.94(d,J=8.1 Hz, 1H), 5.20(d,J=8.0 Hz, 1H), 5.80~5.85(m, 1H), 6.69(d,J=7.8 Hz, 1H), 6.83(s, 1H), 6.93~6.96(m, 2H), 7.20~7.27(m, 5H), 7.33~7.45(m, 3H), 7.91(s, 1H);13C NMRδ: 11.2, 20.9, 54.1, 55.3, 67.6, 69.5, 109.9, 125.5, 127.0, 127.1, 128.1, 128.2, 128.4, 129.6, 130.1, 131.5, 131.9, 132.3, 136.7, 139.3, 155.7, 171.7, 181.8; HR-ESI-MSm/z: Calcd for C28H23N4O4BrNa{[M+Na]+}581.080 0, found 581.080 7。
3b: 淡黄色固体;1H NMRδ: 2.22(s, 3H), 2.29(s, 3H), 5.02(d,J=8.2 Hz, 1H), 5.24(d,J=7.9 Hz, 1H), 5.88~5.90(m, 1H), 6.69(d,J=4.2 Hz, 1H), 6.86(s, 1H), 6.94(d,J=4.2 Hz, 1H), 7.04~7.09(m, 1H), 7.19~7.26(m, 6H), 7.34~7.39(m, 3H), 8.10(s, 1H);13C NMRδ: 11.2, 20.9, 54.2, 55.8, 67.7, 69.6, 109.8, 125.4, 127.0, 127.8, 127.9, 128.1, 128.3, 128.4, 128.7, 155.6, 172.1, 182.0; HR-ESI-MSm/z: Calcd for C28H24N4O4Na{[M+Na]+}503.169 5, found 503.169 9。
3c: 苍黄色固体;1H NMRδ: 2.23(s, 3H), 2.46(s, 3H), 4.45(d,J=8.1 Hz, 1H), 4.93(d,J=7.9 Hz, 1H), 5.78~5.87(m, 2H), 6.62(d,J=7.6 Hz, 1H), 6.92~6.98(m, 1H), 7.02(d,J=7.4 Hz, 1H), 7.01~7.36(m, 5H), 7.41(d,J=5.1 Hz, 2H), 7.56(s, 1H), 7.63(s, 1H), 8.09(s, 1H);13C NMRδ: 11.3, 21.3, 45.6, 54.1, 61.7, 72.6, 109.8, 122.4, 124.5, 126.6, 127.0, 128.0, 128.1, 128.5, 128.7, 129.9, 130.2, 130.8, 131.0, 131.2, 131.4, 132.9, 136.0, 138.4, 140.7, 155.3, 172.4, 180.3; HR-ESI-MSm/z: Calcd for C28H23N4O4BrNa{[M+Na]+}581.080 0, found 581.080 1。
3d: 黄色固体;1H NMRδ: 2.27(s, 3H), 2.49(s, 3H), 3.52(s, 3H), 4.92(d,J=7.8 Hz, 1H), 5.27~5.29(m, 1H), 5.89~5.90(m, 1H), 6.77~6.80(m, 1H), 6.91(d,J=4.5 Hz, 1H), 7.07~7.10(m, 2H), 7.19~7.25(m, 5H), 7.33(d,J=8.0 Hz, 1H), 7.39~7.44(m, 2H), 7.64(s, 1H);13C NMRδ: 11.2, 18.7, 29.9, 54.8, 55.7, 61.7, 67.7, 119.9, 121.4, 122.3, 126.9, 127.1, 127.8, 128.1, 128.3, 128.5, 128.7, 133.4, 137.7, 139.7, 141.4, 155.6, 172.1, 180.8; HR-ESI-MSm/z: Calcd for C29H26N4O4Na{[M+Na]+}517.185 1, found 517.185 1。
3e: 黄色固体;1H NMRδ: 2.15(s, 3H), 2.19(s, 3H), 3.10(s, 3H), 4.21(d,J=4.2 Hz, 1H), 4.75(d,J=8.2 Hz, 1H), 5.12~5.15(m, 1H), 6.78(d,J=7.8 Hz, 1H), 6.95~6.97(m, 1H), 7.07~7.08(m, 1H), 7.19~7.29(m, 5H), 7.33~7.36(m, 3H), 7.40(d,J=4.5 Hz, 1H), 7.71(s, 1H);13C NMRδ: 10.7, 20.4, 26.1, 54.3, 55.1, 67.1, 69.1, 108.0, 124.9, 127.2, 128.0, 128.1, 128.7, 138.2, 140.3, 141.2, 155.7, 171.7, 179.4; HR-ESI-MSm/z: Calcd for C29H26N4O4Na{[M+Na]+}517.185 1, found 517.185 0。
3f: 苍黄色固体;1H NMRδ: 2.27(s, 3H), 4.39(d,J=4.3 Hz, 1H), 4.74(d,J=8.3 Hz, 1H), 5.04~5.07(m, 1H), 6.68(d,J=4.3 Hz, 1H), 6.99(s, 1H), 7.05~7.14(m, 1H), 7.23~7.30(m, 4H), 7.32~7.39(m, 4H), 7.50(s, 1H), 8.03(s, 1H);13C NMRδ: 10.8, 54.6, 67.0, 69.4, 72.2, 111.4, 112.8, 121.9, 127.2, 128.2, 131.0, 132.0, 139.6, 140.9, 141.6, 155.7, 171.3, 180.9; HR-ESI-MSm/z: Calcd for C27H20N4O4Br2Na{[M+Na]+}644.974 9, found 644.974 5。
3g: 黄色固体;1H NMRδ: 2.22(s, 3H), 3.13(s, 3H), 4.34(d,J=4.1 Hz, 1H), 4.77(d,J=7.9 Hz, 1H), 5.07~5.10(m, 1H), 6.95(d,J=8.1 Hz, 1H), 7.05(s, 1H), 7.10~7.11(m, 1H), 7.19~7.22(m, 2H), 7.24~7.29(m, 3H), 7.31~7.34(m, 2H), 7.37(d,J=8.1 Hz, 2H), 7.42(d,J=8.0 Hz, 1H), 7.98(s, 1H);13C NMRδ: 11.3, 26.8, 54.7, 55.5, 67.7, 69.4, 110.4, 124.9, 126.6, 127.8, 128.5, 128.6, 129.2, 130.8, 138.3, 140.4, 143.0, 156.3, 171.6, 179.6; HR-ESI-MSm/z: Calcd for C28H23N4O4ClNa{[M+Na]+}537.130 5, found 537.130 7。
3h: 黄色固体;1H NMRδ: 2.20(s, 3H), 3.15(s, 3H), 4.40(d,J=4.3 Hz, 1H), 4.66~4.73(m, 2H), 5.10~5.13(m, 1H), 6.88~6.94(m, 3H), 7.22~7.29(m, 4H), 7.31~7.33(m, 2H), 7.41(s, 1H), 7.58(d,J=7.9 Hz, 1H), 8.00(s, 1H);13C NMRδ: 10.9, 26.2, 50.1, 53.6, 67.6, 69.3, 108.5, 122.0, 124.1, 126.8, 127.8, 128.2, 128.3, 128.7, 129.6, 132.5, 134.7, 135.2, 139.5, 143.7, 155.7, 171.5, 179.5; HR-ESI-MSm/z: Calcd for C28H22N4O4Cl2Na{[M+Na]+}571.091 5, found 571.091 4。
1.3体外抗肿瘤活性测定
采用MTT法[8-9]测试3a~3h对A549, PC-3及K562的体外抗肿瘤活性。以顺铂为阳性对照药。
(1) 待测样制作
用DMEM培养基[含10%胎牛血清,100 U·mL-1青霉素和100 U·mL-1链霉素]培养A549。以每孔4 000个细胞的浓度加入96孔中,在含5%CO2潮湿空气的培养箱中于37 ℃培养24 h。
换用RPMI-1640培养基,细胞浓度为5 000个/孔,用类似的方法制作K562和PC-3待测样。
(2) 细胞存活率测定
待测细胞孵育24 h后,在各孔中以梯度浓度加入新配3的二甲基亚砜溶液,使孔中3的最终浓度分别为5 μmol·L-1, 10 μmol·L-1, 20 μmol·L-1, 40 μmol·L-1和80 μmol·L-1。静置48 h,每孔加入5 mg·mL-1MTT的磷酸盐缓冲液10 μL,于37 ℃培养4 h。离心5 min,除去未转化MTT,每孔中加入二甲基亚砜150 μL。用酶标仪测定波长490 nm处的OD值。IC50由spss软件分析得到。
2结果与讨论
2.1合成
通过底物扩展发现,该反应活性较低,反应72 h(TLC检测)仍有部分1残留。此外,当2苯环上为吸电子取代时[如氯原子取代(2h),溴原子取代(2a, 2c)], 3产率有一定提高。其中3h产率最高(62%)。
2.2抗肿瘤活性
表1为3a~3h的体外抗肿瘤活性。由表1可见,3a~3h对A549, PC-3和K562均有较好的抑制活性。其中3a, 3b和3c分别对K562, PC-3和A549具有较好的抑制活性,其对应的IC50为16.0 μmol·L-1, 21.2 μmol·L-1和24.4 μmol·L-1,优于顺铂(26.1 μmol·L-1, 27.2 μmol·L-1和25.6 μmol·L-1),说明3作为先导化合物,值得进一步研究。3的其他相关药理活性的研究正在进行中。
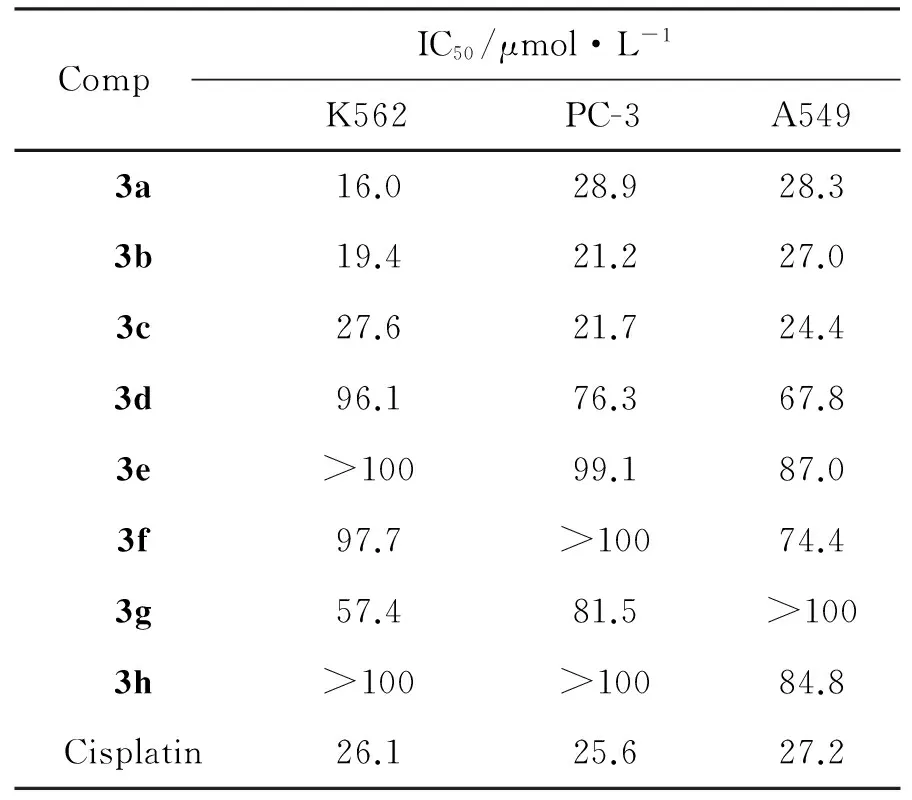
表1 3a~3h的体外抗肿瘤活性
合成了8个新型的异噁唑拼接吡咯螺环氧化吲哚类化合物(3a~3h)。采用MTT法研究了3a~3h对人肺癌细胞(A549),人前列腺(PC-3)和人白血病细胞(K562)的体外抗肿瘤活性。结果表明:3a, 3b和3c分别对K562, PC-3和A549抑制活性较好,其对应的IC50为16.0 μmol·L-1, 21.2 μmol·L-1和24.4 μmol·L-1,优于顺铂(26.1 μmol·L-1, 27.2 μmol·L-1和25.6 μmol·L-1)。其他相关药理活性研究正在进行中。
参考文献
[1]Cui C B, Kakeya H, Osada H,etal. Novel mammalian cell cycle inhibitors,spirotryprostatins A and B,produced byAspergillusfumigatus,which inhibit mammalian cell cycle at G2/M phase[J].Tetrahedron,1996,52(39):12651-12666.
[2]Ding K, Lu Y, Coleska N Z,etal. Structure-based design of potent non-peptide MDM2 inhibitors[J].J Am Chem Soc,2005,127(29):10130-10131.
[3]Wong W H, Lim P B, Chuah C H,etal. Oxindole alkaloids fromAlstoniamacrophylla[J].Phytochemistry 1996,41(1):313-315.
[4]Liu J, Yu L F, Brek Eaton J,etal. Discovery of isoxazole analogues of sazetidine-A as selectiveα4β2-nicotinic acetylcholine receptor partial agonists for the treatment of depression[J].J Med Chem,2011,54(20):7280-7288.
[5]Mao J, Yuan H, Wang Y,etal. From serendipity to rational antituberculosis drug discovery of mefloquine-isoxazole carboxylic acid esters[J].J Med Chem,2009,52:6966-6978.
[6]Sun R, Li Y, Xiong L,etal. Design,synthesis,and insecticidal evaluation of new benzoylureas containing isoxazoline and isoxazole group[J].J Agric Food Chem,2011,59(9):4851-4859.
[7]Liu Y, Cui Z, Liu B,etal. Design,synthesis,and herbicidal activities of novel 2-cyanoacrylates containing isoxazole moieties[J].J Agric Food Chem,2010,58(5):2685-2689;
[8]Mosman T J. Rapid colorimetric assay for eellulair growth and survival:Application and cytotxicity assays[J].Immunol Methods,1983,65:55-63.
[9]Alley M C, Scudiero D A, Monks A,etal.Feasibility of drug screening with panals of human tumor cell lines using a mycroculture tetrazolium assay[J].Cancer Res,1988,48:589-601.
Synthesis and Antitumor Activities of Isoxazole-fused Spiropyrrolidine Oxindoles
LIU Xiong-wei,ZHOU Gen,YAO Zhen,WANG Dan-dan,LIU Huan-huan,GONG Yi,LIU Xiong-li*,PENG Li-jun,ZHOU Ying*
(Guizhou Engineering Center for Innovative Traditional Chinese Medicine and Ethnic Medicine,College of Pharmacy,Guizhou University, Guiyang 550025, China)
Abstract:Eight isoxazole-fused spiropyrrolidine oxindoles(3a~3h), in yields of 41%~62% with d/r of 2 ∶1~10 ∶1, were synthesized by 1,3-dipolar cycloaddition reaction, using N-substituted isatins, 3-methyl-4-nitro-5-alkenyl-isoxazoles and 2-phenylglycine as materials and MeCN as solvent. The structures were characterized by1H NMR,13C NMR and HR-ESI-MS. The in vitro antitumor activities of 3a~3h against human prostate cancer cells(PC-3), human lung cancer cells(A549) and human leukemia cells(K562) were investgated by MTT method. The results demonstrated that 3a, 3b and 3c exhibited good inhibition activities against K562, PC-3 and A549 with IC50of 16.0 μmol·L-1, 21.2 μmol·L-1and 24.4 μmol·L-1, which were better than Cisplatin(26.1 μmol·L-1, 27.2 μmol·L-1and 25.6 μmol·L-1)。
Keywords:isoxazole-fused spiropyrrolidine oxindole; 1,3-dipolar cycloaddition reaction; azomethine ylide; synthesis; antitumor activity
收稿日期:2016-02-03
基金项目:国家自然科学基金青年基金资助项目(21302024); 国家自然科学地区基金资助项目(81560563); 贵州省教学改革创新项目(SJJG201423); 贵州省制药工程专业学位研究生工作站[黔教研合JYSZ字(2014)002]
作者简介:刘雄伟(1991-),女,汉族,湖南娄底人,博士研究生,主要从事天然活性物质全合成及活性研究。 E-mail: 453184149@qq.com通信联系人: 刘雄利,博士,副教授, E-mail: liuxiongli8302@163.com; 周英,博士,教授, E-mail: yingzhou71@yeah.net
中图分类号:O626.13; O625.24
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.16041

