重组毕赤酵母发酵表达人乳头瘤病毒病毒样颗粒培养工艺条件的优化
赵 晶, 王泽建, 郭美锦, 储 炬, 张嗣良, 楼觉人
(1.华东理工大学生物反应器工程国家重点实验室,上海 200237;2.上海生物制品研究所有限责任公司,上海 200052)
重组毕赤酵母发酵表达人乳头瘤病毒病毒样颗粒培养工艺条件的优化
赵晶1,王泽建1,郭美锦1,储炬1,张嗣良1,楼觉人2
(1.华东理工大学生物反应器工程国家重点实验室,上海 200237;2.上海生物制品研究所有限责任公司,上海 200052)
摘要:对重组毕赤酵母表达人乳头瘤病毒病毒样颗粒发酵条件进行了优化。在全合成摇瓶培养基的基础上,考察了诱导过程中培养液pH、温度、铵离子、油酸对人乳头瘤病毒病毒样颗粒发酵的影响。研究表明发酵过程中单体蛋白16 L1的表达条件与组装条件不同:pH=4.5最适于单体L1表达,而pH=3.5则最适于VLPs组装;28 ℃利于单体L1表达,而30 ℃则促进VLPs组装;发酵指数生长期诱导时铵离子浓度为0.26~0.30 mol/L,利于菌体生长、单体L1表达与组装;生长稳定期时铵离子浓度为0.34~0.42 mol/L,最有利于单体的合成与组装。进一步研究发现,诱导初期添加油酸,会抑制单体L1表达,而在诱导中期添加φ=5%油酸则能够极大地促进L1自组装。毕赤酵母发酵过程中胞内单体L1表达与自组装的最优化工艺条件的考察,为工业发酵优化表达人乳头瘤病毒病毒样颗粒提供了应用基础。
关键词:重组毕赤酵母; 人乳头瘤病毒病毒样颗粒; 发酵条件优化; 自组装
宫颈癌对女性的危害极大,人乳头瘤病毒(human papillomavirus,HPV)是宫颈癌的主要致病因子。全球宫颈癌感染者之中,发展中国家占80%[1]。近年来,一些大的临床试验表明,基于基因工程重组技术表达的人乳头瘤病毒病毒样颗粒(Human Papillomavirus Virus-Like Particles,HPV VLPs)制备而成的预防性疫苗能够持续免疫感染的HPV 病毒。有效地开发这种安全、高效的疫苗,通过免疫青春期女孩,可以减少全球70%的宫颈癌疾病。
研究发现,HPV衣壳由主要衣壳蛋白 L1(约占衣壳蛋白总量的80%以上)和次要衣壳蛋白L2组成[2-3],L1单体蛋白能够在真核表达系统中表达并能够自组装形成病毒样颗粒[4-9]。由于L1单体蛋白具有很强的疏水性,单体蛋白之间依靠α螺旋、β折叠、β环形成的疏水区域相互作用而结合,形成五聚体,五聚体之间依靠相互间的二硫键结合,72个五聚体相互作用形成一个完整的高度对称的二十面体,即人乳头瘤病毒病毒样颗粒[10-11]。这种自组装成的病毒样颗粒(VLPs)在一定程度上能够替代天然病毒,这也是疫苗开发过程中关键的一步。
目前,关于发酵优化表达人乳头瘤病毒病毒样颗粒鲜有报道。李巍巍等[12]发现用汉逊酵母发酵表达HPV 16 VLPs时,甲醇的诱导浓度、发酵液pH、初始接种量等因素影响HPV16 L1蛋白的表达和细胞生长。其他大部分为体外试验,改变pH、离子强度、氧化还原电位可导致HPV L1生产所获得的VLPs解聚以及重新组装[13-15]。
本文根据毕赤酵母发酵的一般性质以及影响单体L1表达的因素和VLP自组装特性,从发酵液初始pH、诱导温度、添加物等因素对诱导条件进行优化,取得了较好的研究结果。
1材料与方法
1.1材料
1.1.1菌株构建毕赤酵母GS115/HPV16L1muts型[16]。
1.1.2培养基平板培养基为YPD 培养基;种子培养基为酵母浸出粉胨葡萄糖培养基YPD 培养基;发酵罐培养基是用 FM21 基础盐配成,含甘油0.04 kg/L,PTM1 微量元素4 mL/L;补料生长培养基为0.5 kg/L甘油(含12 mL/L PTM1) 补料液;发酵诱导培养基为甲醇(含12 mL/L PTM1)诱导液。
1.2方法
1.2.1毕赤酵母表达HPV 16 VLPs发酵培养方法
(1)摇瓶发酵条件。从新鲜YPD平板上挑单一菌落到种子培养基中,在28 ℃,220 r/min下培养20~ 25 h 后,按10%接种量接入到装15 L分批发酵培养基的30 L发酵罐中进行分批培养(用氨水调pH至5.0 左右),为了保持菌体生理特性的一致性,当30 L发酵罐细胞光密度达到200左右,取出部分发酵液,放入500 mL三角瓶中,装液量为50 mL。设置温度28 ℃、转速220 r/min进行培养。饥饿处理2 h,待甘油完全消耗完,补加甲醇进行诱导培养,根据摇瓶中残存的甲醇浓度补加甲醇。
(2)发酵罐培养条件。从新鲜YPD平板上挑单一菌落到种子培养基中,28 ℃、220 r/min下培养20~ 25 h 后,按10%接种量接入到装有15 L分批发酵培养基的30 L发酵罐中进行分批培养(用氨水调pH至5.0 左右),当30 L发酵罐细胞光密度达到380左右,饥饿处理2 h,待甘油完全消耗完,补加甲醇进行诱导培养,根据发酵罐中残存的甲醇浓度补加甲醇。
1.2.2pH测定使用pH电极(METTLER TOLEDO 公司产品 405-DPAS-SC-K8S/120)在线检测。
1.2.3溶氧(Dissolved Oxygen)溶氧电极(瑞士Ingold公司产品CD951-06) 在线检测。
1.2.4细胞光密度(OD600)分析发酵液稀释后于波长600 nm 处以去离子水为对照进行比色测定,OD600为OD读数乘以稀释倍数。
1.2.5甘油浓度分析采用高碘酸钠氧化滴定法[17]分析甘油浓度。
1.2.6甲醇浓度分析气相色谱(GC)分析[18]甲醇浓度。
1.2.7半定量法测定HPV 16 L1蛋白含量冻存的细胞团反复冻融后,采用玻璃珠机械破碎法,取裂解液上清进行 SDS-PAGE 电泳[19],同时用已知浓度的HPV 16 VLPs作为标准蛋白、未经甲醇诱导的细胞裂解液上清作为阴性对照,蛋白marker作为参照,western blotting蛋白泳道中分别用字母S、N、M表示。电泳结束后进行转膜,一抗采用HPV16 L1 单克隆抗体(Purified Mouse Anti-L1 protein of human papillome virus,BD),二抗采用碱性磷酸酶标记羊抗小鼠抗体(Goat anti-Mouse IgG(H+L) Human serum Adsorbed,MILLIPORE,USA)。利用ECL显色试剂显色后,使用chemi Doc XRC (Bio-Rad,USA) 设备凝胶成像分析系统进行拍照并通过检测蛋白条带的荧光强度,计算单体蛋白L1的相对浓度。另外,使用该软件计算每一蛋白泳道中,单体蛋白L1占该蛋白泳道所有蛋白的百分比(wL1)作为衡量单体蛋白L1的降解指标。
1.2.8HPV 16 VLPs含量测定(ELISA)将待检测样品用1% BSA稀释,加入到抗原单抗(SHS004,SIBP),包被酶联板微孔中,每孔加样品100 μL,同时设阴性对照,用封板膜封板后置37 ℃温育60 min,去除各孔内液体,用洗涤液洗涤,重复3次,最后一次洗板完成后拍干。每孔加酶结合物工作液100 μL,用封板膜封板后置37 ℃温育45 min。去除孔内液体,用洗涤液洗涤,重复5次,最后一次洗板完成后拍干。每孔加底物显色液A 50 μL,底物显色液B 50 μL,轻微震荡混匀后置室温暗处显色5~10 min。每孔加终止液 50 μL,轻微混匀。选择酶标仪波长450 nm,参考波长630 nm,测定各孔吸光值(OD)。所得结果采用lgX-lgY的拟合方式进行线性拟合及计算。
2结果
2.1pH对重组毕赤酵母表达HPV 16 VLPs的影响
当15 L发酵罐菌液OD60达到280左右时,从发酵罐中无菌取出适量发酵液,分装于不同的摇瓶,分别用φ=10%稀硫酸和1 mol/L KOH溶液调节pH为3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0,每12 h 添加甲醇至终浓度体积分数为0.5%,诱导培养48 h后,对细胞光密度和蛋白含量等进行分析。
当pH=4.5时,单体蛋白L1(55 kDu)表达量最高,几乎是pH=7.0条件下表达量的1.5倍;pH=4.0~4.5 时,单体蛋白L1表达量稳定并明显高于其他pH条件。颗粒蛋白VLPs含量随着pH由3.5升至7.0而逐渐降低(图1和图2),说明pH低至3.5时,最适合胞内单体蛋白L1组装生成VLPs。整体上看,8种pH条件下,细胞光密度差异较大,pH=4.0时,细胞浓度达到最高。实验结果表明,在生长和单体表达阶段,通过控制pH为4.0来促进目的蛋白L1表达量,通过改变pH到3.5来促进颗粒蛋白VLPs的组装,这是最优化的pH控制条件。

N—Sample without methanol induction;M—Protein

图2 pH 对毕赤酵母生长和蛋白表达的影响
2.2不同诱导温度对重组毕赤酵母表达HPV 16 VLPs的影响
为了更好地考察温度对HPV 16 VLPs表达的影响,对发酵罐中培养到一定阶段的菌液(生长培养基为BMGY)进行离心,重悬于诱导培养基中,制备浓缩5倍的诱导菌液(诱导培养基为BMMY),然后,分别考察25、28、30 ℃下毕赤酵母HPV 16 VLPs合成表达的影响,结果如图3和图4所示。控制甲醇体积分数为0.5%。3个诱导温度培养下,摇瓶内菌体浓度差异不显著,但单体L1的表达量受温度的影响显著,28 ℃培养下,单体L1的产量比25 ℃和30 ℃下分别高出了65%和61%,可见28 ℃对于细胞内合成L1单体非常有利。但颗粒蛋白VLPs组装的最适温度与单体合成的温度差异明显,在30 ℃诱导下VLPs的含量最高,分别比25 ℃和28 ℃下高出了45.8%和88.4%。可见,28 ℃有利于单体L1的高水平表达,而30 ℃更利于颗粒蛋白VLPs的组装。此外,25 ℃和28 ℃温度下wL1明显高于30 ℃对应的wL1,可见,30 ℃条件下,L1降解较多。

N—Sample without methanol induction;M—Protein marker;S—HPV 16 VLPs

图4 温度对毕赤酵母生长和蛋白表达的影响
在发酵过程中应采取阶段性的变温措施来获得最大量的单体和颗粒蛋白VLPs表达量。发酵培养时,菌体生长期温度应控制在30 ℃以利于细胞生长,提高细胞浓度;诱导初期,则可以选择28 ℃加快单体蛋白L1的表达与积累,诱导后期提高温度至30 ℃来高效促进VLPs的组装。
2.3铵离子对菌体生长和HPV 16 VLPs表达的影响
2.3.1概述毕赤酵母菌体生长和目的蛋白的表达过程中,氮源起着非常关键的作用,将30 L发酵罐中培养到诱导期的一定量菌液无菌取出,分装到摇瓶中考察不同诱导时期和铵离子诱导浓度对细胞生长和蛋白表达的影响,诱导培养分别选择指数期细胞和稳定期细胞。初始铵离子添加浓度见表1。取发酵罐中相同诱导时间的发酵液进行对比分析(G1、G2)。不同初始铵离子浓度下指数生长期与稳定生长期启动诱导对HPV 16 L1表达的影响如图5所示。

表1 初始铵离子的添加浓度
2.3.2指数生长期控制不同浓度铵离子对发酵表达的影响当细胞光密度OD600达到280左右时启动诱导表达,考察不同浓度的铵离子对表达的影响。结果表明,菌体密度差异受铵离子浓度影响不显著(见图6),但对单体蛋白L1的表达影响较大。当铵离子浓度为0.26 mol/L时最有利于蛋白L1的表达,高于发酵罐中L1的同期表达含量(G1)。过高或过低的铵离子添加浓度,均不利于单体蛋白L1的表达(图5)。原因在于过低的铵离子浓度下,氮源首先满足于细胞生长的需要,而限制了蛋白L1的表达,在过低的铵离子浓度下蛋白L1降解比较严重;而过高的铵离子浓度,同样也会抑制蛋白的表达,可能原因是导致竞争性抑制,或是过高的铵离子浓度使得菌体生长转向初级代谢,不利于蛋白单体的表达。由L1浓度变化可以看出,当铵离子浓度高于0.30 mol/L时,单体L1降解现象缓解。铵离子浓度同样也影响单体L1的自组装。如图6所示,随着铵离子浓度增加,蛋白VLPs含量逐步降低。而低浓度的铵离子(小于0.30 mol/L)对VLPs的组装影响不大。综上所述,当细胞处于指数生长期时,维持发酵液中氮元素浓度为0.26~0.30 mol/L,既能促进菌体生长,促进单体L1表达,还有利于单体L1自组装形成VLPs。
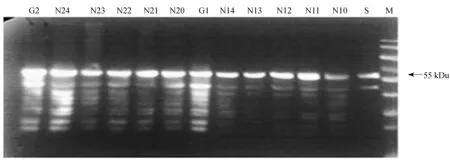
N10~N14—Exponential phase samples concentration;G1—Synchronous induction samples in fermentation tank as N10~N14;N20~N24—Stable growth period samples;G2—Synchronous induction samples in fermentation tank as N20~N24;M—Protein marker;S—HPV 16 VLPs
图5不同初始铵离子浓度下指数生长期与稳定生长期启动诱导对HPV 16 L1表达的影响
Fig.5Effect of ammonium ion concentration on HPV 16 L1 expression at exponential growth phase and stationary phase

图6指数生长期控制铵离子对HPV 16 L1发酵的影响
Fig.6Effect of ammonium ion at exponential growth phase on HPV 16 L1 fermentation
2.3.3生长稳定期不同浓度铵离子对发酵的影响同样,在细胞光密度OD600达到370左右时对生长期的细胞进行诱导,并考察不同铵离子浓度对发酵的影响,结果如图7所示。不同浓度的铵离子对酵母细胞生长影响不大,0.42 mol/L的铵离子浓度下,菌体生长最佳。0.38 mol/L的铵离子浓度下,单体蛋白L1含量最高,并且,提高铵离子浓度,单体L1降解呈增强趋势。铵离子浓度低于0.42 mol/L更有利于单体L1组装成VLPs,当铵离子浓度为0.34 mol/L时,单体L1组装成VLPs效果最佳。可以看出,低浓度的铵离子既有利于单体L1积累,减少L1降解,还能促进单体L1组装成VLPs。因此,利用稳定期细胞进行毕赤酵母诱导发酵表达VLPs时,维持铵离子浓度为0.34~0.42 mol/L,有利于单体L1表达及组装。

图7稳定生长期铵离子对HPV 16 L1发酵的影响
Fig.7Effect of ammonium ion at stationary phase on HPV 16 L1 fermentation
2.4油酸对毕赤酵母发酵表达人乳头瘤病毒病毒样颗粒的影响
2.4.1概述以AOX1为启动子的毕赤酵母发酵过程添加油酸(oleic acid)可以诱导细胞产生过氧化物酶体(Peroxisome),影响甲醇代谢途径,提高外源蛋白的产量。本实验考察了诱导初期和诱导中期添加不同浓度的油酸对单体L1表达和VLPs组装的影响如图8所示。初始油酸添加的体积分数分别为1%、5%、20%、33.3%。取发酵罐中相同诱导时间的发酵液进行对比分析(G1、G2)。

Y10~Y14—Initial induction phase samples,volume fractions of oleic acid added are 0,1%,5%,20%,33.3%,respectively;G1—Synchronous induction samples in fermentation tank as Y10~Y14;Y20~Y24—Mid-induction phase samples volume fraction of oleic acid added are 0,1%,5%,20%,33.3%,respectively;G2—Synchronous induction samples in fermentation tank as Y20~Y24;M—Protein marker;S—HPV 16 VLPs;N—Sample without methanol induction
图8油酸添加量对HPV 16 L1发酵的影响
Fig.8Effect of addition of oleic acid on HPV 16 L1 production
2.4.2诱导初期添加油酸对发酵影响当细胞光密度达到220左右时,对发酵液进行诱导,并添加油酸。结果表明(图9),添加油酸能促进毕赤酵母菌体生长,其中体积分数为20%的油酸效果最佳,提高约10.8%。但与空白对照组相比,添加油酸的实验组单体L1含量明显偏低。如图9所示油酸体积分数越高,单体L1含量越低,添加体积分数为33.3%油酸的实验组几乎无单体L1产生。可见,诱导初期,添加油酸对单体L1的表达具有严重的抑制作用。
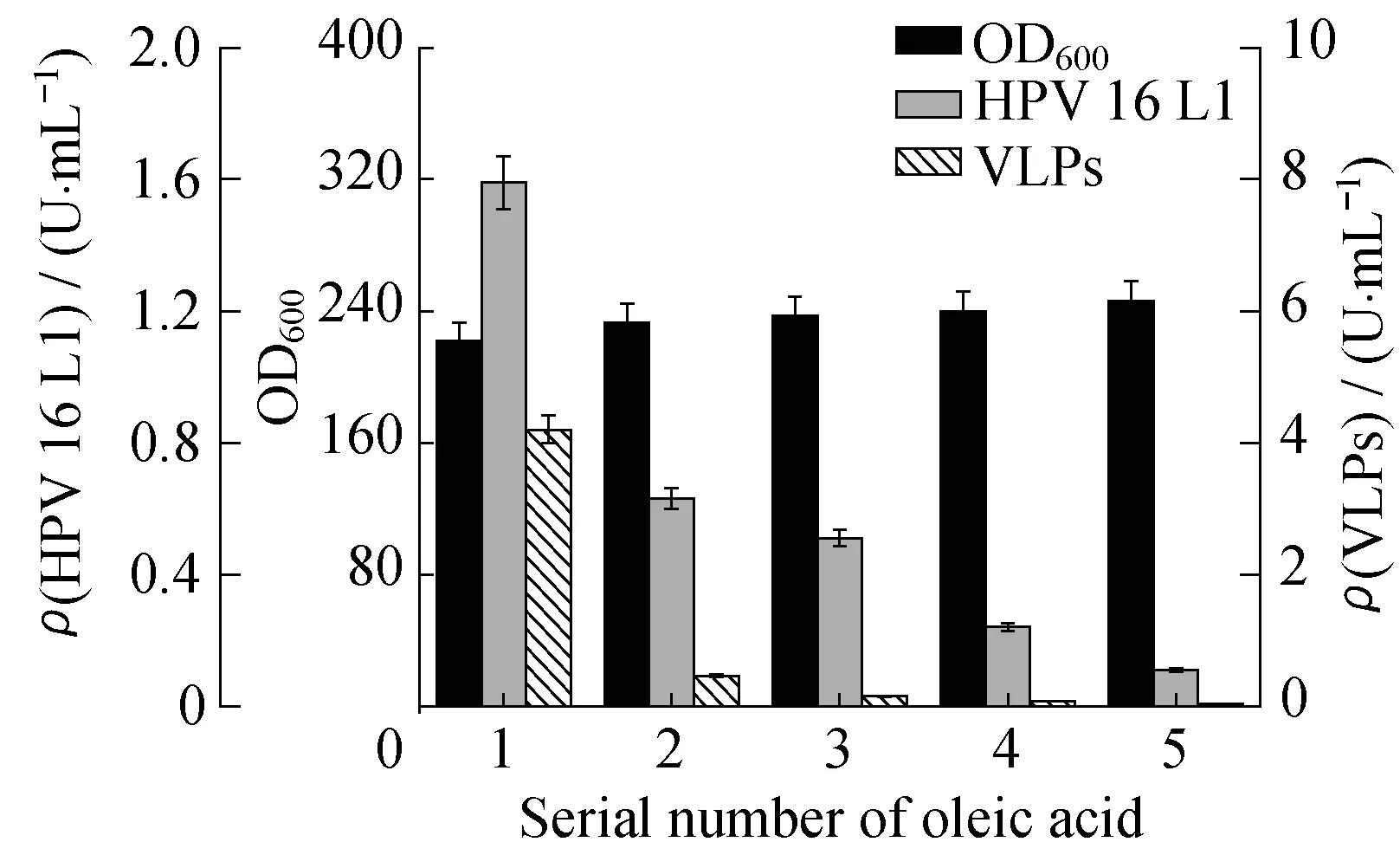
φ(Oleic acid):1—0;2—1%;3—5%;4—20%;5—33.3%
2.4.3诱导中期添加油酸对发酵影响当发酵罐诱导培养22 h时,取出发酵液适量分装于不同的摇瓶,添加油酸,结果如图10所示。油酸对菌体生长具有明显的促进作用,其中油酸体积分数为20%时效果最佳。单体蛋白L1的含量在油酸的作用下,呈递增趋势,在体积分数为33.3%的油酸作用下单体蛋白L1的含量最高,明显高于发酵罐中L1含量。而VLPs的含量随着油酸浓度的增加,呈上升趋势,体积分数为5%的油酸对应的VLPs含量最高,油酸体积分数高于5%,则VLPs含量明显降低。加入油酸后,wL1有所增加,体积分数为5%的油酸对应的实验组中,单体降解现象最弱。可见,体积分数为5%的油酸有利于单体自组装形成VLPs,高浓度的油酸主要作用于单体VLPs解聚,可能原因是添加的油酸改变了发酵液内环境,促进VLPs解聚。

φ(Oleic acid):1—0;2—1%;3—5%;4—20%;5—33.3%
3结论
本文以工业上适合毕赤酵母高密度培养的全合成培养基为基础,考察了诱导过程中诱导温度、pH,以及添加不同浓度的铵离子、油酸等因素对重组毕赤酵母发酵表达HPV 16 L1以及组装形成HPV 16 VLPs的影响。
结果表明酸性环境比较有利于蛋白表达以及组装,诱导过程维持pH=4.0左右最佳。28 ℃下单体表达量较高,而30 ℃培养条件下,颗粒蛋白VLPs较高。诱导过程中添加一些营养元素能有效提高蛋白表达量。对指数生长期细胞进行诱导培养,维持发酵液中铵离子浓度0.26~0.30 mol/L,既能促进菌体生长和单体L1表达,还有利于单体L1自组装形成VLPs。对稳定生长期细胞进行诱导培养,维持铵离子浓度在0.34~0.42 mol/L,有利于单体L1表达及组装。分别在诱导初期和诱导中期添加油酸,初期添加油酸严重抑制单体蛋白L1的表达,而诱导中期添加体积分数为5%的油酸可有效促进单体自组装,并防止单体降解,高浓度的油酸则促进VLPs解聚。
总而言之,HPV 16 L1的表达条件和组装条件不同。在发酵生产中,可根据实际情况科学处理好单体HPV L1与VLPs的关系,最大限度地提高HPV 16 VLPs的产量。本实验优化的条件可以作为发酵罐上发酵培养HPV 16 VLPs的基础。
参考文献:
[1]BELLONE S.Advances in dendritic-cell based therapeutic vaccines for cervical cancer[J].Expert Review of Anti-infective Therapy,2007,7(10):1473-1486.
[2]HERNANDEZ J,ELAHI A,SIEGEL E,etal.HPV L1 capsid protein detection and progression of anal squamous neoplasia[J].American Journal of Clinical Pathology,2011,135(3):436-441.
[3]MA B,RODEN R B,HUNG C F,etal.HPV pseudovirions as DNA delivery vehicles[J].Therapeutic Delivery,2011,2(4):427-430.
[4]ZHAO Q J,MODIS Y,HIGH K,etal.Disassembly and reassembly of human papillomavirus virus-like particles produces more virion-like antibody reactivity[J].Virology Journal,2012,9(1):52.
[5]PANDHI D,SONTHALIA S.Human papilloma virus vaccines:Current scenario[J].Indian Journal of Sexually Transmitted Diseases,2011,32(2):75-85.
[6]KIRNBAUER R.Papillomavirus L1 major capsid protein self-assembles into virus-like particles that are highly immunogenic[J].Proceedings of the National Academy of Sciences,1992,89(24):12180-12184.
[7]HAGENSEE M E,YAEGASHI N,GALLOWAY D A.Self-assembly of human papillomavirus type 1 capsids by expression of the L1 protein alone or by coexpression of the L1 and L2 capsid proteins[J].Journal of Virology,1993,67(1):315-322.
[8]HOFMANN K J.Sequence determination of human papillomavirus type 6a and assembly of virus-like particles in Saccharomyces cerevisiae[J].Virology,1995,209(2):506-518.
[9]ROSE R C,BONNEZ W,REICHMAN R C,etal.Expression of human papillomavirus type 11 L1 protein in insect cells:invivoandinvitroAssembly of virus like particles[J].Journal of Virology,1993,67(4):1936-1944.
[10]MODIS Y,TRUS B L,HARRISON S C.Atomic model of the papillomavirus capsid[J].The EMBO Journal,2002,21(18):4754-4762.
[11]CHEN X S,GARCEA R L,GOLDBERG I,etal.Structure of small virus-like particles assembled from the L1 protein of human papillomavirus 16[J].Molecular Cell,2000,5(3):557-567.
[12]李巍巍,何秀萍,郭雪娜,等.人乳头瘤病毒16亚型Ll蛋白在多形汉逊酵母中的优化表达[J].生物工程学报,2009,25 (10):1516-1523.
[13]RUDOLF M P,FAUSCH S C,DA SILVA D M,etal.Human dendritic cells are activated by chimeric human papillomavirus type-16 virus-like particles and induce epitope-specific human T cell responses in vitro[J].The Journal of Immunology,2001,166(10):5917-5924.
[14]XIE L,SMITH G,FENG X,etal.Surveying capsid assembly pathways through simulation-based data fitting[J].Biophysical Journal,2012,103(7):1542-1554.
[15]MCCARTHY M P,WHITE W I,HILL F P,etal.Quantitative disassembly and reassembly of human papillomavirus type 11 viruslike particles in vitro[J].Journal of Virology,1998,72(1):32-41.
[16]NISHI K,FUKUNAGA N,OTAGIRI M.Construction of expression system for human α1-acid glycoprotein in Pichia pastoris and evaluation of its drug-binding properties[J].Drug Metabolism and Disposition,2004,32(1):1069-1074.
[17]康辉,刘桂军,孙凤卿,等.滴定法测定棒酸发酵液中甘油含量[J].河北工业科技,2010,27(3):189-191.
[18]邓兵兵,方宏清,薛冲,等.甲醇营养型酵母高密度培养过程中甲醇和乙醇的GC快速检测[J].工业微生物,2001,31(2):26-29.
[19]LIU D,CAI J,XIE C C,etal.Purification and partial characterization of a 36-kDa chitinase from Bacillus thuringiensis subsp.colmeri,and its biocontrol potential[J].Enzyme and Microbial Technology,2010,46(3):252-256.
Optimization of Culture Conditions for Expression of Human Papillomavirus Virus-Like Particles by Recombinant Pichia pastoris
ZHAO Jing1,WANG Ze-jian1,GUO Mei-jin1,CHU Ju1,ZHANG Si-liang1,LOU Jue-ren2
(1.State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China; 2.Shanghai Institute of Biological Products Co. Ltd,Shanghai 200052,China)
Abstract:The recombinant Pichia pastoris GS115/HPV16L1 (muts) fermentation conditions for human papillomavirus the virus-like particles (HPV VLPs) were optimized.Based on the defined shaking flask medium,effects of pH of the culture medium,temperature,ammonium sulfate,and oleic acid were investigated during the induction period in human papillomavirus virus-like particles fermentation.The results showed that the monomeric protein L1 expression conditions were remarkably different from the conditions for assembly.During HPV L1 fermentation process,the optimized conditions for L1 expression are those:pH=4.5,temperature 28 ℃,and ammonium ion concentration 0.26-0.30 mol/L at the exponential growth phase.However,for VLPs production,the culture conditions are as follows:pH=3.5,temperature 30 ℃,and the ammonium ion concentration 0.34-0.42 mol/L controlled at the exponential phase.In addition,the monomer L1 expression was inhibited with the addition of oleic acid at the initial induction period.Oleic acid (φ=5%) could promote the monomer L1 self assembly at the middle induction phase.The relationship between the intracellular monomer L1 expression and its self assembly can be applied for the expression of the human papillomavirus virus-like particles by recombinant Pichia pastoris in industrial production.
Key words:recombinant Pichia pastoris; human papillomavirus virus-like particles; culture condition optimization; self assembly
收稿日期:2015-08-25
基金项目:国家“863”计划(2012AA02A401);卫生部“重大新药创制”(2013ZS09402302-220)
作者简介:赵晶(1988-),女,安徽蚌埠人,硕士生,研究方向为微生物发酵。E-mail:zjww1510@163.com 通信联系人:张嗣良,E-mail:siliangz@ecust.edu.cn
文章编号:1006-3080(2016)02-0180-07
DOI:10.14135/j.cnki.1006-3080.2016.02.005
中图分类号:Q815
文献标志码:A

