五倍子蜂蜜TaqMan探针实时荧光定量PCR检测方法的建立
孙 涛,夏明星,孔德英,张学健,滕少娜,邓朝晖,夏晓华,李应国*
(1.重庆出入境检验检疫局,重庆400020;2.国家中药材物种鉴定及质量安全检测重点实验室,重庆400020;3.万州出入境检验检疫局,重庆404100;4.重庆峰谷美地生态养蜂有限公司,重庆404100)
五倍子蜂蜜TaqMan探针实时荧光定量PCR检测方法的建立
孙 涛1,2,夏明星3,孔德英1,2,张学健4,滕少娜1,2,邓朝晖1,2,夏晓华4,李应国3*
(1.重庆出入境检验检疫局,重庆400020;2.国家中药材物种鉴定及质量安全检测重点实验室,重庆400020;3.万州出入境检验检疫局,重庆404100;4.重庆峰谷美地生态养蜂有限公司,重庆404100)
为五倍子蜂蜜的鉴定检测提供技术支撑,利用TaqMan探针实时荧光定量PCR技术,以五倍子树基因组中ITS基因为靶序列,设计并筛选出特异性引物探针,通过特异性、灵敏度和重复性等试验,建立五倍子蜂蜜TaqMan探针实时荧光PCR检测方法。结果表明:建立的方法特异性良好,生成的标准曲线有良好的线性关系,相关系数(R2)为0.998,最低检测限为0.2pg DNA/反应。该方法特异性强、灵敏度高、结果可靠。
五倍子树;蜂蜜;检测;TaqMan实时荧光定量PCR
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物结合经充分酿造而成的天然甜物质[1]。蜂蜜含有丰富的必需氨基酸、维生素、多酚类、类黄酮类、多糖、活性酶和类胡萝卜素等活性物质,具有多种生理功能,如抗氧化、抗菌、加速创伤修复和增强免疫等[2-3]。根据国际食品法典委员会蜂蜜标准、欧盟蜂蜜指令及其他相关规定,蜂蜜种类可按照来源、生产方式或外观划分[4-5]。一般是按照蜜蜂所采集的蜜源植物划分,主要蜜源是单一植物的称作单花种蜂蜜,采自多种植物的为杂花蜜或百花蜜。不同蜜源植物来源的蜂蜜成分主要取决于植物类型、花期、气候、蜂群强弱以及取蜜时间等,不仅在感官和内在品质上有一定差异,其营养效果也不同。传统方法难以辨别蜂蜜种类,容易造成蜂蜜市场价格混乱,且品种标识混淆[6]。因此,有必要开展蜂蜜种类鉴定研究。
五倍子蜂蜜是蜜蜂采自五倍子树的花粉酿制而成,为中药材蜜种,也是难得的森林蜜种,具有解毒、杀菌和止腹泻等作用,对肺肾双虚、脾肾虚寒、气促喘乏、痰火郁肺有良好辅疗效果,特别适合虚汗、肺虚、肾虚、久泻久痢、痔血和便血等人的日常食疗保健之用,市场需求量较大。五倍子蜂蜜市场售价是普通蜂蜜价格的3~5倍,市场上常出现廉价蜂蜜假冒五倍子蜂蜜的现象,极大地损害了消费者的利益,因此亟待建立切实可靠的五倍子蜂蜜鉴别技术。
近年来,实时荧光定量PCR技术以其灵敏度高、速度快、特异性强的优点在基因表达水平分析、多态性研究、物种特异性检测等方面得到广泛应用[710]。TaqMan探针法[11-14]作为高度特异的实时荧光定量PCR技术,其核心是利用Taq酶的3′~5′外切核酸酶活性,切断位于2条引物之间仅与模板特异性结合的探针,产生荧光信号,仪器通过收集分析信号进行结果判定,其结果准确、分辨率更高。鉴于此,笔者利用TaqMan荧光探针技术,建立一种特异性检测五倍子蜂蜜蜜源成分的实时荧光PCR方法,旨在为五倍子蜂蜜的检测提供技术支撑。
1 材料与方法
1.1 蜂蜜与蜜源
成熟五倍子蜂蜜,由重庆蜂谷美地生态养蜂有限公司提供。蜜源植物为五倍子树、红麸杨、青麸杨和白背麸杨,由重庆市药用植物研究所提供。油菜蜜、枣花蜜、荆条蜜、益母草蜜、柑橘蜜和荔枝蜜,由重庆蜂谷美地生态养蜂有限公司提供。
1.2 引物与探针
从美国国立生物技术信息中心(NCBI)网站基因库(GenBank)下载盐肤木属所有物种的ITS基因序列,并进行同源性分析,用Primer Premier 5.0软件分析设计引物和探针,筛选得到针对五倍子树的特异性引物探针。正向引物RCF:5′-AAACCTG CCTAGCAGAACGA-3′,反向引物RCR:5′-TAA GATTTCCTTGGCGCAAT-3′,探针RCPRO:5′-ACACGTGYTGCGCTGGGCGTCGGTCGTA-3′,探针两端分别用FAM和TAMRA标记,引物和探针由上海生工生物合成及标记。
1.3 蜂蜜及蜜源植物样本DNA的提取
蜂蜜DNA提取:称取蜂蜜样品10g放入有磁力搅拌子的50mL小烧杯中,加灭菌双蒸水20mL,40℃恒温振荡20min,使蜂蜜样品和水充分混合均匀,转移至50mL离心管;12 000r/min离心10min,迅速倒掉上清液,保留沉淀;用去离子水2mL冲洗离心管管壁上的沉淀,转入2mL离心管中,12 000r/min离心10min,弃上清液,保留沉淀[15]。然后用磁珠法植物基因组DNA提取试剂盒提取DNA。
蜜源植物样本DNA提取:五倍子树、青麸杨、红麸杨的叶片DNA用磁珠法植物基因组DNA提取试剂盒提取。
1.4 五倍子蜂蜜TaqMan探针实时荧光定量PCR检测体系的建立
1.4.1 PCR反应 采用经过优化后的最佳反应体系和条件。总反应体系20μL:2×定量荧光PCR反应预混液(TaqMan Mix)10μL、上下游引物(10μmol/L)各0.4μL、TaqMan探针(10μmol/L)0.8μL、DNA 4μL、灭菌去离子水4.4μL。荧光定量PCR反应条件:95℃30s;95℃5s,60℃30s,40个循环。试验过程中观察PCR荧光扩增曲线,根据循环数(Ct)值进行结果判定。
1.4.2 特异性检测 以五倍子树近缘种及常见蜂蜜蜜源植物的DNA作为模板,包括五倍子树、白背麸杨、红麸杨、青麸杨、油菜、枣、荆条和益母草,以五倍子树的DNA为阳性对照,灭菌去离子水为空白对照,按照PCR反应的体系及条件进行实时荧光PCR反应,分析该方法的特异性。
1.4.3 灵敏度检测 用灭菌去离子水将提取的五倍子树基因组DNA(浓度为5×103pg/μL)10倍梯度稀释成7个浓度,分别为5×103~5×10-3pg/μL,取4μL作为模板按照PCR反应的方法进行灵敏度检测。
1.4.4 重复性试验 分别取上述稀释后的五倍子树基因组DNA作为模板,进行荧光定量PCR反应。在同一个试验中,每个浓度DNA做3次重复,以分析组内差异。再以相同DNA为模板,在不同时间段进行3次独立重复试验,以分析组间差异。通过计算变异系数验证该方法的稳定性。
1.4.5 标准曲线的建立 分别取上述稀释后的五倍子树基因组DNA作为模板,每个浓度重复3次试验,同时以灭菌去离子水为阴性对照。按照PCR反应的方法进行实时荧光PCR反应。经Stepone plus荧光定量PCR仪软件自动分析得到荧光定量PCR方法的标准曲线。
1.4.6 蜂蜜样本实测 为评价建立方法对蜂蜜样本检测的实用性,分别以五倍子蜂蜜、油菜蜜、枣花蜜、荆条蜜、益母草蜜、荔枝蜜和柑橘蜜的DNA为模板,按照PCR反应的方法进行实时荧光定量PCR反应。
2 结果与分析
2.1 特异性及灵敏度
从图1可知,TaqMan探针实时荧光定量PCR方法检测五倍子树、五倍子蜂蜜呈典型的阳性反应,Ct值分别为22.49、22.40和31.87、31.02,呈特异性S形荧光扩增曲线;检测白背麸杨、红麸杨、青麸杨、油菜、枣、荆条和益母草均为典型的阴性反应,未见特异性荧光扩增曲线,均无荧光值增长。表明,所建立的五倍子TaqMan探针实时荧光定量PCR检测方法具有较强的特异性。
TaqMan探针实时荧光定量PCR方法具有较佳的线性检测范围,当DNA浓度为0.05pg/μL时,仍能够获得强的荧光信号,产生良好的特异性荧光扩增曲线,故最低检测限是0.2pg DNA/反应。说明,该检测方法具有较高的灵敏度。
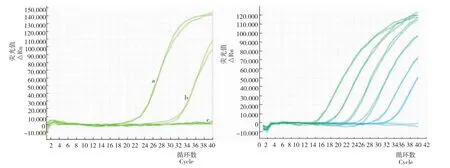
图1 TaqMan探针实时荧光定量PCR方法的特异性(左)及灵敏度(右)图谱Fig.1 Specificity(left)and Sensitivity(right)graph of the TaqMan real-time PCR assay
2.2 重复性
从表中看出,组内重复Ct值变异系数为0.33%~1.46%,组间变异系数为0.48%~ 3.53%,均在合理范围。表明,建立的五倍子蜂蜜TaqMan探针实时荧光定量PCR检测方法的稳定性良好。
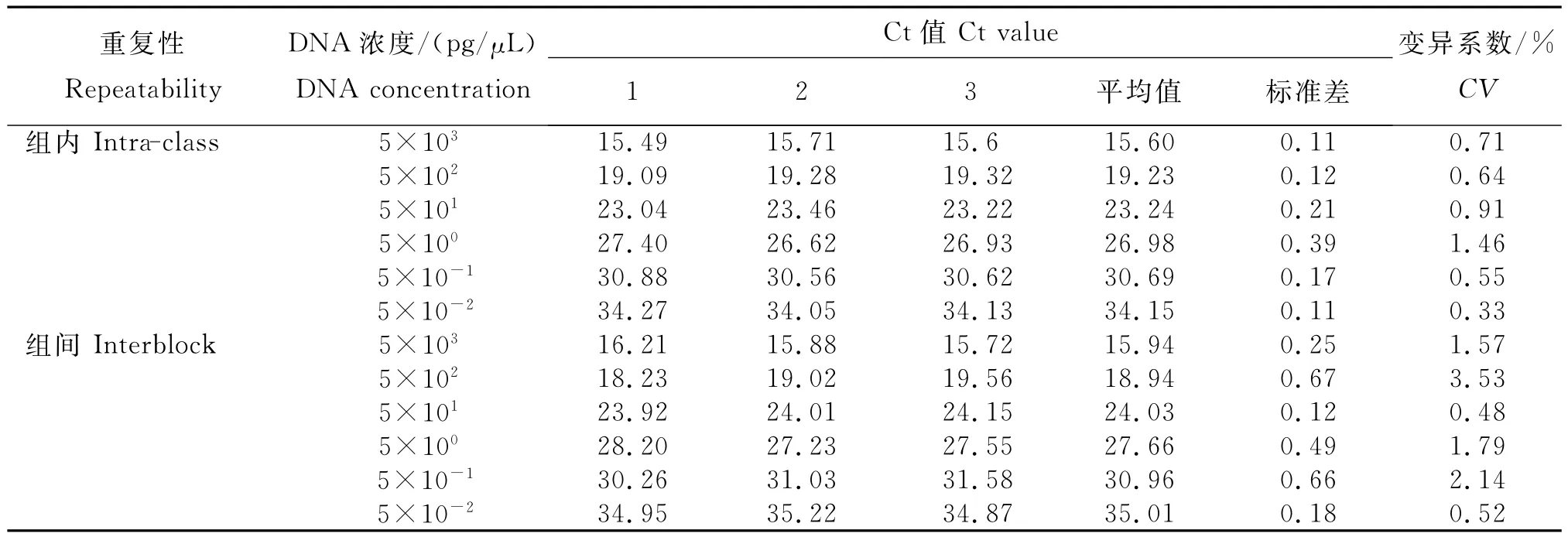
表TaqMan探针实时荧光定量PCR方法检测五倍子树的重复性结果Table Repetitive experimental results of the TaqMan real-time PCR assay for detecting nutgall tree

图2 TaqMan探针实时荧光定量PCR方法检测五倍子树的标准曲线Fig.2 Standard curve map of the TaqMan real-time PCR assay for detecting nutgall tree
2.3 标准曲线
从图2看出,标准曲线中Ct值和DNA浓度间呈良好的线性关系,实时荧光定量PCR检测五倍子DNA的线性范围是103~10-2,标准曲线的相关系数(R2)为0.998(y=-3.747x+29.482),扩增效率为84.876%。表明,建立的实时荧光定量PCR检测方法有6个数量级的线性检测范围,进一步说明该检测方法具有很高的灵敏度。
2.4 样品实测结果
对重庆峰谷美地生态养蜂有限公司五倍子蜂蜜生产基地的30份五倍子蜂蜜样品及市购的五倍子蜜、油菜蜜等进行实时荧光定量PCR检测。结果表明,所有五倍子蜂蜜检测结果均为阳性,油菜蜜、枣花蜜、荆条蜜、益母草蜜、荔枝蜜和柑橘蜜检测结果均为阴性(图3)。说明检测方法的准确度高。

图3 TaqMan探针实时荧光定量PCR方法对样品的实测结果Fig.3 Samples measured drawing of the TaqMan realtime PCR assay for sample detection
3 结论与讨论
目前,国内外对蜂蜜真伪的鉴别主要集中在淀粉类、糖类、代糖类等添加物上,即通过离子色谱法、稳定碳同位素比率法、液相色谱示差折光法等检测蜂蜜中碳-4-植物糖、淀粉糖等的含量,并已形成多种国家标准方法[16-17]。但是,对于蜜源成分的检测及研究较少。对蜂蜜蜜源成分的检测常用方法为蜂蜜中植物花粉含量的测定[18],即通过显微镜观察蜂蜜中蜜源植物的花粉并计数,计算蜜源植物花粉数占总花粉数的比率来确定花粉含量及浓度。这种方法对生物分类学要求较高,必须先认识蜜源植物花粉,且费时费力,而且五倍子蜂蜜中植物花粉的含量及浓度并未收入GB/T 23194-2008蜂蜜中植物花粉的测定方法[18]标准中,不适用于五倍子蜂蜜的检测。
本研究通过分子生物学方法,利用TaqMan探针实时荧光定量PCR技术,选取五倍子树基因组中ITS序列较为保守的区域,设计针对五倍子树的特异性TaqMan引物探针,建立了五倍子树TaqMa探针实时荧光定量PCR检测方法,并成功应用于五倍子蜂蜜的快速检测。该方法对植物分类学要求不高,有分子生物学基础的人员均可进行检测操作,方法简便,特异性良好,生成的标准曲线有良好的线性关系,相关系数(R2)为0.998;灵敏度高,最低检测限为0.2pg DNA/反应。本方法解决了样品是否含有五倍子蜂蜜的问题,而对于是否是其纯蜂蜜需进一步研究。
[1]中华人民共和国卫生部.GB14963-2011食品安全国家标准蜂蜜[S].北京:中国标准出版社,2011.
[2]史伯伦.蜂产品与人类健康[J].蜜蜂杂志,2005(8):11-13.
[3]王桥林,蜂王浆蜂蜜治烧伤疗效好[J].蜜蜂杂志,2000(6):20.
[4]Codex standard12-2001.Codex Standard for Honey [S/OL].[2015-10-20].http://www.docin.com/p-468227644.html.
[5]Council Directive(EC)2001/110ff[S].J Europ Communities,2002,10:47-52.
[6]陈兰珍,叶志华,赵 静.蜂蜜品种鉴别技术研究进展[J].食品科学,2008,29(3):494-498.
[7]马月萍,戴思兰,马艳蓉.荧光定量PCR技术在植物研究中的应用[J].生物技术通报,2011(7):37-44.
[8]陈 旭,齐凤坤,康立功,等.实时荧光定量PCR技术研究进展及其应用[J].东北农业大学学报,2010,41(8):148-155.
[9]欧阳松应,杨 冬,欧阳红生,等.实时荧光定量PCR技术及其应用[J].生命的化学,2004,24(1):74-75.
[10]张 蓓.实时荧光定量PCR的研究进展及其应用[J].国外医学:临床生物化学与检验学分册,2003,24(6):327-329.
[11]邓文星,张 映.实时荧光定量PCR技术综述[J].生物技术通报,2007(5):93-95.
[12]王忠发,邵俊斌,沃健儿,等.Taqman实时荧光定量PCR快速检测白斑综合症病毒的方法研究[J].中国卫生检验杂志,2005,15(6):663-665.
[13]高正琴,邢 进,冯育芳,等.TaqManMGB探针实时荧光定量PCR快速检测布鲁氏菌[J].中国人兽共患病学报,2011,27(11):995-1000.
[14]周 勇,曾令兵,孟 彦,等.大鲵虹彩病毒TaqMan实时荧光定量PCR检测方法的建立[J].水产学报,2012,36(5):772-778.
[15]中华人民共和国国家质量监督检验检疫总局.SN/T2135-2008蜂蜜中转基因成分检测方法普通PCR方法和实时荧光PCR方法[S].北京:中国标准出版社,2008.
[16]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T21533-2008蜂蜜中淀粉糖浆的测定离子色谱法[S].北京:中国标准出版社,2008.
[17]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T18932.1-2002蜂蜜中碳-4植物糖含量测定方法稳定碳同位素比率法[S].北京:中国标准出版社,2002.
[18]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T23194-2008蜂蜜中植物花粉的测定方法[S].北京:中国标准出版社,2008.
(责任编辑:冯 卫)
Establishment of a TaqMan real-time PCR Assay for Detecting the Chinese Gall Honey
SUN Tao1,2,XIA Mingxing3,KONG Deying1,2,ZHANG Xuejian4,TENG Shaona1,2,DENG Zhaohui1,2,XIA Xiaohua4,LI Yingguo3*
(1.Chongqing Entry-Exit Inspection and Quarantine Bureau of China,Chongqing400020;2.State Key Laboratory of Chinese Herbal Medicine Species Identification and Quality Safety Testing,Chongqing 400020;3.Wanzhou Entry-Exit Inspection and Quarantine Bureau of China,Chongqing 404100;4.Chongqing FOGO Ecological Apiarian Co.,LTD,Chongqing404100,China)
In order to provide technical support for identification test of the Chinese gall honey,the TaqMan real-time PCR technique was used to develop a assay for detecting the Chinese gall honey.Primers and probe were designed from the ITS gene of Nutgall Tree and its specificity,sensitivity and repeatability were test in the paper.Results:The TaqMan real-time PCR assay for detecting the Chinese gall honey has good specificity,high detection sensitivity and reliable results.The detection limit was 0.2pg DNA/reaction.A good linear correlation was demonstrated in the standard curve for the real-time PCR assay,the correlation coefficient was 0.998.
nutgall tree;honey;detection;TaqMan real-time PCR
Q754
A
1001-3601(2016)08-0329-0015-04
2015-12-15;2016-06-13修回
重庆市科技计划项目“秦巴山区特色蜂蜜(五倍子)基因真伪鉴别技术研究”(cstc2014yykfA80022);国家质检总局科技计划项目“基于DNA条形码的三种重要炭疽菌快速检测技术研究”(2015IK336)
孙 涛(1985-),男,农艺师,从事植物检疫研究。E-mail:hisun1985@126.com
*通讯作者:李应国(1965-),男,研究员,从事动植物检疫研究。E-mail:ciqlyg@163.com

