条叶百合的离体多倍体诱导
吴雪娟,杨利平,陈 敏
(长江师范学院生命科学与技术学院,重庆408100)
条叶百合的离体多倍体诱导
吴雪娟,杨利平*,陈 敏
(长江师范学院生命科学与技术学院,重庆408100)
为增强条叶百合的抗性,对其进行多倍体改良,利用不同浓度的秋水仙素附加2.00%二甲亚砜诱变离体培养条叶百合小鳞茎。结果表明:0.10%的秋水仙素溶液诱导效果好,直径1.4cm鳞茎变异率达100%,直径0.7cm鳞茎变异率达92%。经对4株疑似多倍体诱变株系的染色体检测,仅有1个变异株系中含有48条染色体,4倍体细胞占63%,对其切割分离和纯化培养,最终获得1个四倍体株系(2n=4x=48)。除观察到正常的染色体外,株系1、株系3和株系4约30%左右的细胞中含有数目不等的B染色体。
条叶百合;多倍体;秋水仙素;染色体;B染色体
条叶百合(Lilium callosum)为百合科多年生球根植物,其分布较广,从我国的东北到台湾都有标本采集记载,但因自然选择、生态环境破坏及掠夺性采挖等因素,在其原产地已很难查询[1]。至今,条叶百合在某些原产地仍处于天然野生状态。条叶百合具有耐寒、耐旱、稍耐盐碱、适应性强和病虫害少等优点,可作为亲本用于百合的抗性育种。此外,条叶百合花小,是理想的花境材料和“迷你型”花卉素材,主要可以应用于花境栽培或庭院栽培[2]。但条叶百合的茎秆纤细,易倒伏,故迫切需要对其进行育种改良。关于条叶百合的种子萌发,高效快速组织培养繁殖体系建立和以条叶百合为亲本的杂交育种等已有研究报道[3-6],但未见条叶百合的多倍体诱变育种的研究报道。
通常认为,多倍体植株具有粗大性外,适应性增强,观赏性提高,对新品种选育有重要意义。野生百合资源的化学诱变已有报道,其中多用秋水仙素为诱变剂并取得较好结果。如用秋水仙素采用浸泡法和混培法对我国特有的青岛百合(L.tsingtauense)进行多倍体诱导,诱导频率高达53.3%[7];用秋水仙素浸泡细叶百合(L.pumilum)种子,变异率达30%[8];用0.15%秋水仙素附加2.00%二甲亚砜诱变离体培养的卷丹(L.lancifolium)小鳞茎,变异率达54.29%[9]。笔者以条叶百合鳞茎为试验材料,利用秋水仙素为诱变剂进行多倍体诱导,以获得条叶百合多倍体的幼苗,为其开发利用提供新的种质材料。
1 材料与方法
1.1 材料
以条叶百合的鳞茎为试验材料,采自黑龙江省齐齐哈尔市。
1.2 无菌苗的获得
无菌苗参照文献[9]方法获得。
1.3 秋水仙素诱导
以2%的二甲基亚砜(DMSO)作溶剂配制成浓度为0.05%、0.08%和0.10%的秋水仙素溶液,24℃条件下,摇床转速100r/min和室内避光分别处理无菌条叶百合鳞茎48h和72h。其中,浓度为0.05%和0.08%的秋水仙素处理直径较小的鳞茎(平均值0.7cm),浓度为0.10%的秋水仙素分别处理直径较小(平均值0.7cm)和直径较大(平均值1.4cm)的2种鳞茎(表)。每隔3d观察并记录条叶百合的变异情况,并拍下具有变异特征的组织或幼苗的照片。
1.4 多倍体材料的稳定性与鉴定
参照文献[9]等方法进行。将疑似变异器官从外植体上切割后接种到MS+6-BA 2.0mg/L+NAA 0.2mg/L培养基上,待疑似变异器官重新脱分化、再分化出芽,将其继代增殖成1个株系,并标记该疑似变异株系。将正常对照植株和四倍体变异植株无菌苗接种到生根培养基(1/2MS+6-BA 0.5mg/L+NAA 0.2mg/L),25℃恒温,培养4周。炼苗后移栽到草炭与蛭石混配(V草炭∶V蛭石=1∶1)的培养基质中培养,观察两者区别。
2 结果与分析
2.1 秋水仙素处理对条叶百合的诱导效果
由表中可见,0.05%秋水仙素有诱导效果,但诱导率较低;0.10%的秋水仙素溶液处理变异率最高。可见,在一定时间内,秋水仙素浓度越高,变异率越高,相同浓度下,不同处理时间诱导效果差异较小。0.10%的秋水仙素溶液处理大小鳞茎时,较大鳞茎的诱导效果稍好。

表 秋水仙素处理条叶百合的诱导情况Table Induction of L.callosumtreated by colchicine
2.2 多倍体的稳定性
将秋水仙素诱导处理的材料经过40d左右的培养,有些器官发生明显的形态变异现象,如叶片变宽、变厚、变短,叶片肉质化,叶片表面粗糙;叶色加深;叶缘两叉开裂等。这些表型变异,疑似多倍体变异株(图1)。幼苗这些疑似变异株并不是每株具有所有的形态变异特征,可能具有其中的1个或几个特征。
2.3 四倍体植株的鉴定及纯化培养
经对4株疑似多倍体诱变株系的染色体检测结果显示(图2),变异株系1、株系2、株系3中染色体24条的细胞占56%~63%,未见48条染色体,属假诱变株系。变异株系4体细胞由31条到48条5个数目的染色体构成,其中48条染色体细胞占63%。从4个疑似多倍体诱变株系的染色体数目组成看,其体细胞均由不同比例染色体数目混合构成,但变异株系4已比较接近四倍体。将变异株系4切割分离和纯化培养,最终得1个四倍体株系(2n=4x=48)。经细胞检测诱变材料,除正常的染色体外,约30%细胞中能观察到1至几条的数目不定的B染色体。

图1 条叶百合多倍体诱变过程的植株形态Fig.1 The morphology of L.callosumpolyploid during the induction
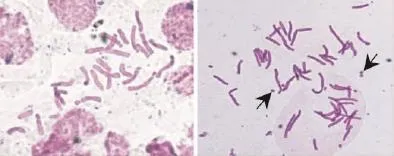
图2 条叶百合根尖的染色体数目Fig.2 Chromosome quantity of root tip cells in L.callosum
2.4 四倍体植株的形态特征和移栽成活率
经培养,对照植株和四倍体变异植株生根率达100%。观察诱变为四倍体植株的形态特征,刚纯化出的四倍体植株生长相当缓慢,但叶色深绿,叶片变得粗大且表面不光滑,小鳞茎增大,根系变粗短。6周后,四倍体植株生长速度渐渐加快,植株整体表现粗大,颜色加深。其中,四倍体植株叶片宽度是二倍体植株的1.12倍,变异植株小鳞茎直径是对照的1.41倍。出瓶炼苗后成活率达91%。
3 结论与讨论
用0.10%浓度秋水仙素处理的试验材料虽诱导效果显著,诱变率超过90%,明显高于前人在百合属其他种类中的诱变效果[7-9],可能是种间对秋水仙素反应存在差异的表现。试验中出现诱导的鳞茎中心部分腐烂甚至完全死亡等烂心现象,中心部位腐烂一般出现在秋水仙素处理的第3天,及时将其腐烂部位切割掉,其余未腐烂的部位几乎不会受到影响,会继续分化,部分植株的叶片颜色加深或高度肉质化。这是由于试验中秋水仙素浓度较高,诱变剂毒性严重干扰了组织的代谢和分化[10]。由于百合小鳞茎内外层鳞片发育程度不同及小鳞茎个体间的不完全均一,导致诱变剂毒性使试验材料部分受害现象发生。鳞茎的直径大小与诱变剂的处理效果有密切关系,直径1.4cm与直径0.7cm的鳞茎相比,大鳞茎比小鳞茎鳞片多,不同发育阶段的内外层鳞片对秋水仙素的反应敏感性多样化。当秋水仙素处理时,大鳞茎更易发生一系列反应以适应环境,众多鳞片中有发育后期对诱变剂反应迟钝的,有发育中前期对诱变剂较为敏感的可达到预期诱变效果,或有刚刚发育的鳞片对诱变剂过于敏感严重受害而死亡。可见,在诱变剂处理较大鳞茎时,其中总有一些鳞片能够达到育种期望的诱变程度。
B染色体是区别于正常染色体,随机独立存在于整倍体中的特殊染色体,不同物种B染色体数目不同,同一物种不同个体间B染色体数目不同,同一个体不同细胞B染色体数目不同,甚至不同分裂期细胞B染色体数目不同。此外,也存在同一物种,有的植株有B染色体,而有的植株不存在B染色体[11]。如李懋学[12]等对岷江百合的染色体进行观察发现,岷江百合细胞中有B染色体,而刘华敏[13]等对岷江百合的研究过程中并未观察到B染色体。有研究者在观察产自我国黑龙江的条叶百合时,现频率极低的1条B染色体[14]。本研究亦观察到,部分条叶百合细胞中存在有B染色体。且不同株系B染色体出现的频率不同,如株系4有33.33%,株系1有32%,株系3有26.67%,而株系2中并未观察到B染色体。同一株系不同细胞含B染色体数目也不同,株系1的B染色体数目从1~5不等;株系4中B染色体数目有3条、4条、5条、6条、8条和9条共6种;株系3中B染色体数目多为2条或3条。
[1]汪发缵,唐 进.中国植物志:第14卷(百合科)[M].北京:科学出版社,1980:159-165.
[2]刘堂茂,吴年炜,孙晓玉,等.条叶百合的保护与利用[J].韶关学院学报,2005,26(6):86-89.
[3]孙晓玉,杨利平,姜浩野,等.条叶百合种子萌发的研究[J].植物研究,2003,23(1):61-65.
[4]顾地周,赵淑玲,郭 伟,等.条叶百合和垂花百合高效快繁体系的建立[J].福建农林大学学报:自然科学版,2009,38(3):244-247.
[5]赵 芳,向地英,孙晓玉,等.条叶百合的开花生物学特性研究[J].河北农业大学学报,2010,33(1):45-49.
[6]杨利平,李 蕊,程千钉.百合远缘杂交育种及其真实性鉴定[J].植物遗传资源学报,2011,12(6):896-903.
[7]张俊芳,刘庆华,王奎玲,等.秋水仙素诱导青岛百合四倍体研究[J].核农学报,2009,23(3):454-457.
[8]杨英杰,葛蓓孛,魏 倩,等.秋水仙素诱导细叶百合多倍体研究[J].中国农业大学学报,2013,18(1):128-133.
[9]陈 艾,杨利平,谭 艳,等.秋水仙素诱变离体卷丹多倍体的研究[J].植物遗传资源学报,2014,15(6):1385-1389.
[10]安学丽,蔡一林,王久光,等.化学诱变及其在农作物育种上应用[J].核农学报,2003,17(3):239-242.
[11]王玉元.染色体遗传中的一个不解之谜——B染色体[J].武汉植物学研究,1997,15(1):73-79.
[12]李懋学,龙雅宜,龚维忠.岷江百合B染色体的初步观察[J].植物学报,1984,26(2):151-155.
[13]刘华敏,智 丽,赵丽华,等.四种野生百合核型分析[J].植物遗传资源学报,2010,11(4):469-473.
[14]杨利平,丁 冰,刘香环,等.东北百合属植物的细胞遗传多样性[J].东北林业大学学报,1996,24(5):19-23.
(责任编辑:刘忠丽)
In vitro Polyploid Induction of Lilium callosum
WU Xuejuan,YANG Liping*,CHEN Min
(College of Life Science and Technology,Yangtze Noramal University,Chongqing408100,China)
L.callosummaterial used for experiment were polypoidized to improve the plant disease resistance of the species.Bulblets of L.callosumwere treated by colchicine of different concentration with 2.00%dimethyl sulfoxide for in vitro addition.The results indicated that 0.10%colchicine had the best induction,100%of the 1.4cm bulblets and 92%of the 0.7cm bulblets were inducted.By examining the chromosome for the four obtained mutative strains which were possibly the polyploids,only one strain showed 48chromosomes,and the proportion of tetraploid was 63%.After the separation and purification,finally one tetraploid strain(2n=4x=48)was obtained.Besides the normal chromosomes,B chromosomes with varying number were observed in some strains with the proportion of nearly 30%of the total cells.
Lilium callosum;polyploid;colchicine;chromosome;B chromosome
S682.2+9
A
1001-3601(2016)08-0346-0084-03
2016-01-12;2016-07-09修回
重庆市涪陵区科技计划项目“西南地区特色百合资源收集与种质创新”(FLKJ,2012ABB1086)
吴雪娟(1994-),女,本科,研究方向:花卉育种。E-mail:1164418577@qq.com
*通讯作者:杨利平(1962-),男,教授,博士,从事花卉育种工作。E-mail:836711655@qq.com

